Несмотря на успехи в выхаживании глубоко недоношенных новорожденных проблема постнатальной гипотрофии у детей с экстремально и очень низкой массой тела (ЭНМТ и ОНМТ)
является одной из нерешенных и в настоящее время требует пересмотра подходов к нутритив-
ной поддержке [1].
Если стратегия форсированной дотации нутриентов парентеральным способом, заключающаяся в раннем назначении белков, жиров, углеводов и в быстром темпе их наращивания в период ранней неонатальной адаптации, твердо занимает свои позиции, то с переходом на полное энтеральное питание выбор оптимального субстрата для глубоко недоношенных новорожденных остается дискутабельным по сей день. Целью данной работы был сравнительный анализ эффективности использования трех энтеральных субстратов при вскармливании недоношенных детей – нативного грудного молока как единственного питательного субстрата, грудного молока, обогащенного мультинутриентным фортификатором Frisо и специализированной смеси для недоношенных.
Материал и методы исследования
Исследование проводилось с 2008 по 2010 г. в ФГБУ НЦ АГиП им. акад. В.И. Кулакова на базе
отделения реанимации и интенсивной терапии новорожденных, а также отделения патологии
новорожденных и недоношенных детей. Нами обследованы 52 недоношенных новорожденных
сроком гестации при рождении от 26 до 32 нед и массой тела при рождении менее 1500 г. Критерии исключения: тяжелые врожденные пороки развития, структурные поражения мозга,
сепсис, острая почечная недостаточность, гемолитическая болезнь новорожденных, требующая
заменного переливания крови. Оценка результатов клинико-лабораторных исследований проводилась с рождения до 38-й нед постконцептуального возраста или до момента выписки ребенка из стационара, если она наступала раньше.
В зависимости от вида основного энтерального субстрата недоношенные новорожденные были
разделены на три группы:
· I группа (НМ) – 11 детей, получавших нативное материнское молоко.
· II группа (ОНМ) – 23 ребенка, получавших нативное материнское молоко, обогащенное
мультинутриентным фортификатором Friso (Фризленд Фудс, Нидерланды).
· III группа (СС) – 18 детей, получавших специализированную смесь для недоношенных
на основе цельного белка коровьего молока.
Сравнительный анализ демографических данных I, II и III групп не выявил статистически
достоверных различий по сроку гестации при рождении, массе при рождении, частоте задержки внутриутробного развития, оценке по шкале Апгар на 1-й и 5-й минутах, оценке по шкале
клинического индекса риска новорожденного [4], что позволяет считать исследуемые группы
однородными.
Методика вскармливания новорожденных
Учитывая тяжелую соматическую патологию матерей, осложненное течение их беременности
и послеродового периода, что требует проведения терапии препаратами, не разрешенными при лактации, назначение нативного молока в качестве начального энтерального субстрата было невозможным. В связи с этим стартовым энтеральным субстратом для всех исследуемых являлась специализированная смесь для недоношенных детей, введение которой начиналось с 6–12 ч жизни в разовом объеме от 0,5 до 1 мл, болюсным способом через зонд каждые три часа. Продолжительность «трофического питания» составила 2,8±0,7; 3,1±0,8 и 3,0±1,1 дня в I, II и III группах соответственно. Всем детям проводилось парентеральное питание с включением аминокислот с 1-х сут жизни в начальной дозе не менее 1 г/кг/сут с форсированным темпом их наращивания до 3 г/кг на 4–5-й день жизни, обеспечением небелковыми калориями не менее 20 на 1 г аминокислот на протяжении всего периода парентеральной дотации нутриентов.
В дальнейшем, при отсутствии противопоказаний и наличии молока у матери, основным энтеральным субстратом с 6,2±2,4 и 7,8±1,8 дня жизни в I и II группах соответственно являлось нативное молоко, в последующем обогащенное мультинутриентным фортификатором во II группе с 13,4±1,8 дня жизни. При невозможности естественного вскармливания продолжалось
вскармливание специализированной смесью для недоношенных детей. Объем ежедневного наращивания энтерального питания составил от 10 до 22 мл/кг/сут, что обеспечило его объем ≥150 мл/кг/сут на 12,8±2,3; 14,9±2,1 и 14,2±1,8 сут жизни в I, II и III группах соответственно.
Состав используемых энтеральных субстратов представлен в табл. 1.
Таблица 1. Химический состав и энергетическая ценность энтеральных субстратов.
Расчет фактического поступления пластических и энергетических нутриентов с энтеральным
и парентеральным питанием производился ежедневно на протяжении всего периода исследования.
Для определения количества поступившего белка и жира при дотации нативного молока, мы провели анализ содержания в молоке данных нутриентов в зависимости от срока лактации (табл. 2).
Таблица 2. Показатели содержания белка и жира в нативном молоке женщин, родивших детей
с ОНМТ и ЭНМТ (в г/100 мл).
Методы оценки нутритивного статуса: клиническая оценка, включая ежедневную
динамику массы тела
Баланс азота определяли расчетным методом, исходя из содержания азота в суточной моче,
остальные потери были приняты за 15% от вводимого с питанием азота. Мониторирование
изменений жировой массы тела производили с помощью анализатора состава тканей грудных детей PEA POD (LMi, США). Принцип действия устройства PEA POD заключается в использовании неинвазивного метода плетизмографии всего тела – технологии замещения воздуха и определения плотности тела исследуемого путем измерения его массы и объема с последующим определением относительного (в процентах) и абсолютного массового количества жировой и безжировой тканей. Преальбумин и мочевину сыворотки крови определяли на биохимическом анализаторе А15 «Biosystems» (Испания).
В связи с тем что переход на полное энтеральное вскармливание в среднем происходил
на 13,61±2,34 день жизни, сравнительный анализ проводили с 3-й по 9-ю нед жизни, что позволяло
исключить воздействие парентеральных компонентов питания на исследуемые показатели.
Результаты исследования и их обсуждение
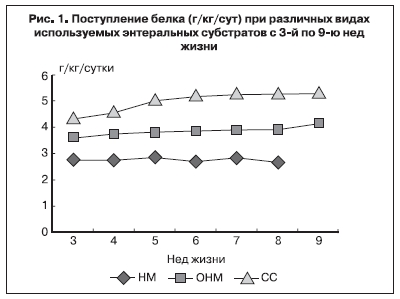
При определении поступления основных макронутриентов в исследуемых группах, было выявлено, что объем энтерального питания был одинаковым, но обеспечение белком было различным: группа НМ в среднем получала 1,5–2,0 г/кг/сут, группа ОНМ – 3,2–3,8 г/кг/сут, группа СС – 3,7–5,0 г/кг/сут (рис. 1). Таким образом, количество белка, полученное детьми группы НМ, было ниже рекомендуемой нормы. Достоверных различий в величине энергообеспечения по группам выявлено не было, но дети группы НМ получали больше жира, а группы СС и ОНМ – больше углеводов.
Сравнительный анализ динамических изменений массы тела у исследуемых новорожденных
показывал, что ежедневный набор массы в группе, получавшей обогащенное грудное молоко, выше по сравнению с группами НМ и СС и составляет в среднем 16,13 г/кг/сут против 14,2 и 13,8 г/кг/сут соответственно.
Рисунок 2. Модель "набора массы тела" в зависимости от вида используемого энтерального субстрата.
В модели «набора массы тела» (рис. 2), построенной с помощью полиномиальных уравнений
регрессии, отображено, что дети группы ОНМ имеют наибольшую скорость набора массы тела
по сравнению группами НМ и СС, что подтверждается статистически значимыми различиями
(р<0,05) в относительных показателях массы тела с 33-х сут жизни между исследуемыми группами
ОНМ и НМ, ОНМ и СС.
Определение показателей азотистого баланса является одним из приоритетных критериев
в оценке белково-энергетического обмена и позволяет своевременно диагностировать катаболическую стадию, оценить эффективность нутритивной поддержки и динамику анаболических процессов в организме.
Таблица 3. Показатели азотистого баланса (мг/кг/сут) в зависимости от вида используемого энтерального субстрата на протяжении 3–5-й нед жизни.
Анализ суточного азотистого баланса (табл. 3) выявил, что средние его показатели выше в группах СС и ОНМ по сравнению с группой НМ на протяжении 3-й нед жизни, в дальнейшем статистически достоверных различий не выявлено.
Динамические показатели жировой массы у детей с 32-й нед постконцептуального возраста
и скорость ее набора у детей, получивших обогащенное молоко мультинутриентным фортификатором, максимально приближены к внутриутробным [2], в отличие от детей групп НМ и СС, чьи показатели значительно ниже фетальных (рис. 3).
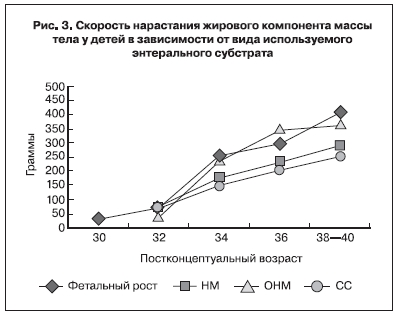
Таким образом, сопоставление скорости прибавки массы тела и его жирового компонента,
величина баланса азота позволяют сделать вывод о предпочтительности использования материнского молока, обогащенного мультинутриентным фортификатором при вскармливании детей с ОНМТ и ЭНМТ [3]. Использование этого вида питания позволило, наряду с оптимально проведенным парентеральным питанием в первые нед жизни, обеспечить скорость роста недоношенного ребенка, сопоставимую со скоростью роста плода, что является признанным стандартом адекватности питания недоношенного ребенка.



