Проблема преэклампсии в акушерстве в настоящее время по-прежнему остается не менее острой и актуальной, и попытки найти ее истинную причину мировое научное сообщество не оставляет и по сей день. В связи с чем в изложенной статье будут коротко представлены некоторые перспективные направления современных исследований, посвященных данной проблеме.
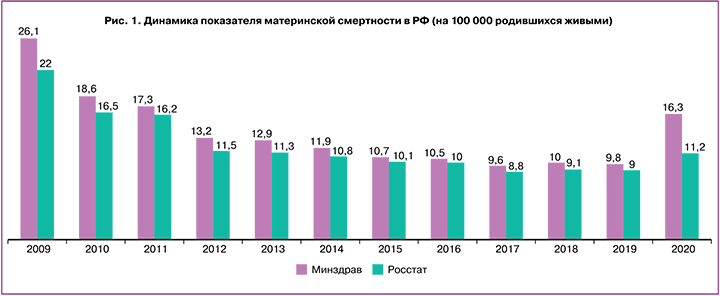
Как известно, показатель материнской смертности в Российской Федерации (РФ) имел явную тенденцию к снижению до 2019 г. Однако в 2020 г. в связи с новой коронавирусной инфекцией (COVID-19) уровень материнской смертности вырос на 24,4%, а в 2021 г. (по предварительным данным) увеличился почти в 3 раза (рис. 1) [1–3].
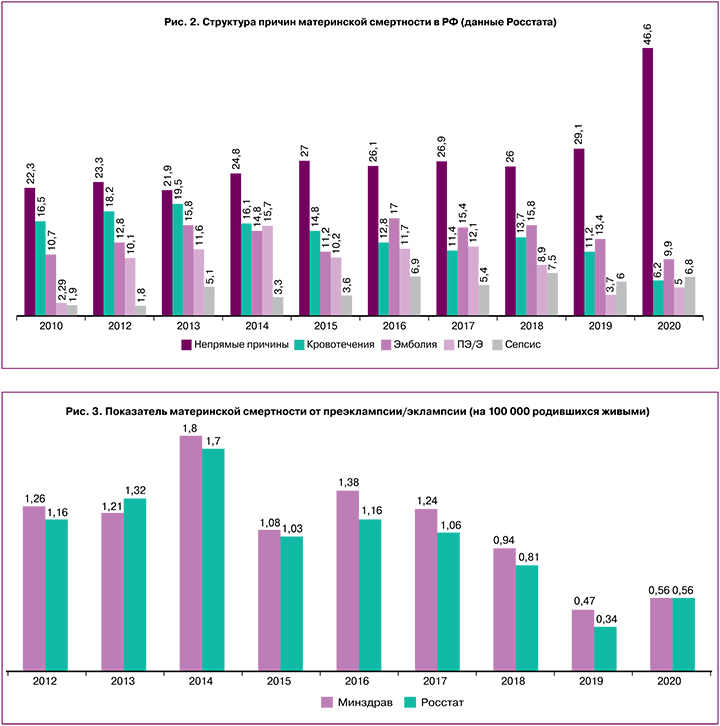
При этом структура основных причин материнской смертности практически не меняется, преэклампсия/эклампсия по-прежнему остаются в числе ведущих причин (рис. 2).
Согласно данным Минздрава РФ, показатель материнской смертности от преэклампсии с 2019 г. ежегодно растет в 1,8 раза (рис. 3).
Кроме того, нельзя не учитывать влияние новой коронавирусной инфекции (COVID-19) на материнские и перинатальные исходы. Недавнее многонациональное когортное исследование, затронувшее 18 стран мира, выявило корреляцию между беременными с диагностированной COVID-19 инфекцией и высоким риском материнской смертности, перинатальной заболеваемости и смертности, преждевременных (не индуцированных) родов, а также с развитием преэклампсии/эклампсии [4].
Таким образом, наличие дефектов в прогнозировании и диагностике, отсутствие своевременной профилактики, неверная оценка степени тяжести преэклампсии и последующая ошибочная тактика ведения пациенток с тяжелым течением заболевания, недостаток эффективных методов лечения во многом обусловлены отсутствием понимания истинной причины преэклампсии, патофизиологических механизмов ее развития от молекулярного уровня до явной клинической симптоматики.
Все вышеуказанное служит хорошим мотивационным толчком для дальнейшего научного поиска и повторного анализа уже имеющихся данных. Так, концепция недостаточности инвазии цитотрофобласта, как причины преэклампсии в настоящее время ставится под сомнение, поскольку не может объяснить все ее клинические фенотипы – ранняя и поздняя, умеренная и тяжелая, с задержкой роста плода (ЗРП) и без нее, варианты клинических проявлений на фоне различных сопутствующих заболеваний.
Ранняя преэклампсия, с клинической манифестацией симптомов до 34 недель, составляет от 5 до 20% всех случаев преэклампсии. Ее развитие связывают с поверхностной инвазией вневорсинчатого цитотрофобласта, отсутствием адекватной гестационной перестройки маточно-плацентарных артерий, изменением перфузии плаценты, ЗРП в 60–80% с типичными изменениями кровотока в маточных артериях и артериях пуповины. Интересно, что все вышеперечисленные характеристики ранней преэклампсии обнаруживаются и при «чистой» тяжелой ЗРП без преэклампсии [5]. Частая комбинация двух данных синдромов вызывает сомнения относительно того, с чем ассоциировать недостаточность инвазии цитотрофобласта – с ранней преэклампсией или с ЗРП.
Подавляющее же большинство случаев преэклампсии (80–95%) относится к позднему фенотипу, при котором гестационные преобразования маточно-плацентарных артерий происходят в полном объеме, и темпы роста плода, как правило, не нарушены, в связи с чем поздняя преэклампсия рассматривается, как чисто материнский синдром. Однако проведенные исследования свидетельствуют о возможности рождения детей даже в более тяжелом состоянии у некоторых женщин с поздней преэклампсией без характерных изменений кровотока в сосудах фетоплацентарного комплекса [5]. Эти данные были подтверждены еще в 2014 г. Verlohren S. et al., которые на когорте более 26 000 женщин показали прямую корреляцию между высоким индексом резистентности в маточных артериях и ЗРП, независимо от развития преэклампсии [6].
Известны и другие исследования, посвященные прогностической значимости оценки кровотока в маточных артериях (косвенного маркера нарушения гестационной перестройки) в сроки 11–14 недель беременности. По данным Demers S. et al., частота выявления ранней преэклампсии при патологических параметрах скоростей кровотока составила лишь 45% при 10% ложноположительных результатов. Прогностическая ценность для поздней преэклампсии была крайне низка [7]. В других публикациях чувствительность данного параметра в отношении прогнозирования ранней преэклампсии еще меньше – 33,3%, а для преэклампсии в целом – лишь 21%.
В опубликованных исследованиях отсутствуют доказательства прямой причинно-следственной связи между нарушением инвазии трофобласта и преэклампсией. При этом факты свидетельствуют о том, что неспособность трофобласта к глубокой инвазии и полноценному ремоделированию спиральных артерий явно связана с идиопатической ЗРП.
Таким образом, концепция недостаточности инвазии трофобласта может объяснить не более 5–20% всех случаев преэклампсии и в большей мере сопровождает ЗРП. Кроме того, в настоящее время опубликованы исследования, указывающие на то, что ремоделирование спиральных и радиальных артерий матки может быть трофобласт-независимым и не ассоциируется с глубиной инвазии цитотрофобласта [8]. Данный процесс опосредуется децидуальными макрофагами и NK-клетками, которые секретируют множество факторов, способствующих лизису мышечного и эластического компонента, разрушению эндотелия спиральных артерий. Это связано со способностью эндотелиоцитов спиральных артерий реагировать на сигналы клеток инвазивного трофобласта выбросом хемокинов, которые рекрутируют NK-клетки и макрофаги. Последовательность событий можно представить следующим образом: синтез хемокинов, интерлейкинов вневорсинчатым трофобластом → индукция синтеза хемокинов эндотелиоцитами спиральных артерий → активация NK-клеток, макрофагов, лейкоцитов → секреция матриксных металлопротеиназ-1, -2, -7, -9 и -10, ряда интерлейкинов, фактора роста фибробластов B, сосудисто-эндотелиального фактора роста-A (VEGF-A) и др. → ремоделирование спиральных артерий [9].
Разработка концепции недостаточности инвазии цитотрофобласта, как причины развития преэклампсии является примером классического подхода к научным исследованиям, когда первоначально формулируется гипотеза, а далее подбираются факторы/маркеры, соответствующие данной гипотезе.
Однако, современные реалии – наступление эры персонализированной медицины, требующей инновационных научных подходов, которые включают широкомасштабные, многопараметрические, беспристрастные исследования с последующим биоинформационным анализом полученных массивов данных, и лишь после этого формулируются практические выводы и рекомендации.
Такими возможностями в полной мере обладают так называемые «омиксные» технологии – геномика, эпигенетика, транскриптомика, протеомика, метаболомика. Современные достижения в области высокопроизводительных технологий («big data») позволяют изучать преэклампсию на новом системном уровне. Используя преимущества таких методов, как секвенирование следующего поколения, масс-спектроскопия высокого разрешения и массивы чипов, платформы «omics» способны генерировать колоссальные объемы данных за короткий период времени. Путем синтеза знаний, полученных с помощью систематического мультиомного дизайна, можно получить полное и обстоятельное представление о преэклампсии. В данный момент такие исследования, учитывая их сложность, носят исключительно научный характер.
Полногеномные исследования (Genome wide association studies, GWAS) представляют собой методы, используемые для анализа влияния однонуклеотидных полиморфизмов (single-nucleotide polymorphisms, SNP) на фенотипы заболеваний. Наиболее крупное на сегодняшний день исследование GWAS по преэклампсии включало 4380 детей, рожденных пациентками с преэклампсией, и 310 238 здоровых. Авторы обнаружили, что именно SNP в sFlt-1 в геноме плода связаны с риском преэклампсии [10].
В самом крупном исследовании GWAS материнского генома по преэклампсии приняли участие 3050 женщин (133 с преэклампсией и 2917 здоровых) [11]. Проанализировано в общей сложности более одного миллиона SNP. Однако ни один SNP не был значимо связан с преэклампсией. Вполне вероятно, что при таком многофакторном осложнении, как преэклампсия, имеет место взаимодействие нескольких аллелей, в связи с чем будущие исследования с полигенным анализом могут оказаться более информативными.
Геном человека статичен, его анализ может предоставить полную информацию обо всех возможных заболеваниях индивидуума. Кроме определения генных мутаций, учитываются также уровни функциональной активности самих генов. Особенности функционирования генома в конкретных условиях являются предметом изучения постгеномных технологий – транскриптомики, протеомики, метаболомики.
Эпигенетика изучает наследуемые изменения экспрессии генов, не связанные с какими-либо нарушениями структуры ДНК. Наиболее широко изученной эпигенетической модификацией является метилирование ДНК [12]. Поскольку метилирование ДНК влияет на экспрессию генов и последующую трансляцию белков, оно потенциально может быть важным фактором развития преэклампсии. Проведены исследования, в которых анализировались гиперметилированные и гипометилированные участки генов, а также некодирующие РНК, ассоциированные с преэклампсией [13, 14]. Выявлено большое количество генов, участвующих в процессах метилирования ДНК. Однако необходимы дальнейшие исследования для изучения взаимосвязи между дифференциально метилированными локусами и различными сигнальными путями, и патофизиологическими изменениями, свойственными преэклампсии.
Помимо генов, кодирующих какие-либо белки, опубликованы данные о дифференциальном метилировании при преэклампсии нескольких промоторных областей, связанных с микроРНК (miR548, miR519, miR301, miR487, miR 185, miR 329, miR194, miR376, miR486 и miR744 и др.) [15]. Из-за потенциала микроРНК изменять экспрессию генов-мишеней, модификации метилирования микроРНК особенно интересны в отношении дальнейших исследований.
Транскриптомика в настоящее время является одной из наиболее быстро развивающихся областей знаний, позволяет получить информацию обо всех транскриптах (порядка 1012), синтезируемых одной клеткой или группой клеток организма: это различные кодируемые (мРНК, рРНК, тРНК) и некодируемые РНК, образующиеся в результате транскрипции.
Профилирование экспрессии генов может дать более широкое представление о механизмах развития преэклампсии и выявить потенциальные многообещающие «биомаркеры» этого осложнения беременности. Недавние исследования позволили успешно идентифицировать связанные с преэклампсией транскрипты в крови и тканях материнского организма [16, 17].
Транскриптомный анализ позволил выявить наличие «перепрограммирования» плаценты в процессе ее формирования, которое характеризуется изменением профиля экспрессии множества генов при развитии беременности. Происходит потеря или снижение одних клеточных функций и активация других, специфичных и необходимых для данного срока беременности [18]. Например, показано, что в I триместре имеет место высокая экспрессия генов клеточной пролиферации и регуляции клеточного цикла, в III триместре – генов созревания ворсин плаценты, а также группы генов, участвующих в индукции родов [19–21].
К настоящему времени идентифицировано более 1500 дифференциально экспрессируемых генов при преэклампсии, участвующих в таких процессах, как клеточная пролиферация и апоптоз, ангиогенез, адгезия клеток, воспалительные и иммунные реакции, окислительный стресс, ответ на гипоксию, регуляция артериального давления, рост и развитие плода, секреция гормонов, метаболизм, гомеостаз и др. [22].
Наиболее новые и современные методики позволяют изучить транскриптом отдельных, единичных клеток (так называемый Singl-Cell Profiling). В этом отношении наиболее перспективны исследования транскриптома инвазивных клеток цитотрофобласта и его микроокружения (NK-клеток, децидуальных макрофагов, лимфоцитов, дендритных стромальных клеток и др.), поскольку их правильное взаимодействие поддерживает иммунологическую толерантность матери к полуаллогенному плоду, обеспечивает адекватное ремоделирование маточно-плацентарных артерий, рост и развитие плода [23, 24].
Группой отечественных авторов во главе с академиком Сухих Г.Т. подробно изучены фенотипы децидуальных макрофагов у пациенток с преэклампсией. При ранней преэклампсии выявлен провоспалительный паттерн с преобладанием децидуальных макрофагов, ассоциированных с воспалением, и сопутствующее снижение макрофагов «противовоспалительного фенотипа», а также выраженная эндотелиальная дисфункция в децидуальных сосудах. Авторами также описано развитие «цитокинового шторма» у беременных с тяжелой преэклампсией, требующего экстренного родоразрешения в связи с тяжестью состояния женщины или плода [25].
Одним из практических применений «высокой» науки в прогнозировании и диагностике преэклампсии является «Liquid biopsy» («жидкостная биопсия») плаценты с определением в материнском кровотоке продуктов аномальной экспрессии генов трофобласта, которые могут быть потенциальными неинвазивными маркерами нарушения функции плаценты.
Так, опубликованы исследования, посвященные транскриптомному анализу внеклеточных РНК в кровотоке матери, патологические изменения которых регистрируются уже с 5–6 недель беременности и отражают особенности патогенеза преэклампсии, а в перспективе могут применяться для прогнозирования ее развития за несколько месяцев до появления клинических симптомов [26].
«Liquid biopsy» занимается изучением экзосом. Экзосомы – экстрацеллюлярные везикулы диаметром около 50–100 нм, содержащие белки, липиды, микроРНК, мРНК и ДНК и способные к модификации функции «клеток-реципиентов» аутокринным и паракринным путем (подавление/активация иммунных клеток, формирование иммунной толерантности, индукция пролиферации и инвазии трофобласта, блокада апоптоза и др.). Последние данные свидетельствуют о том, что экзосомы, высвобождаемые из плаценты (синцитиотрофобласта ворсин) в материнский кровоток, могут вызывать системные патофизиологические изменения при преэклампсии. Плацентарные и/или фетальные экзосомы обнаруживаются в периферической крови беременных уже с первого триместра, и их уровень увеличивается к доношенному сроку, что дает бесценную информацию о состоянии фетоплацентарной системы [27, 28].
У женщин с преэклампсией регистрируются более высокие уровни экзосом плацентарного происхождения (особенно при раннем фенотипе), которые могут быть причиной или усугубляющим фактором повреждения эндотелия и эндотелиальной дисфункции, поскольку экзосомы в большом количестве содержат sFlt-1 и sEng [29, 30].
В настоящее время активно изучаются и перспективы использования экзосом с терапевтической целью. Существует мнение о возможности коррекции полиорганной дисфункции матери при преэклампсии путем снижения числа экзосом плацентарного генеза, а также их использования в качестве системы доставки лекарственных средств непосредственно к клеткам-мишеням [30, 31]. Например, выявлено, что экзосомы, полученные из мезенхимальных стволовых клеток, обладают противораковым эффектом и могут также изменять патофизиологию преэклампсии посредством регулирования клеточной пролиферации, ингибирования апоптоза, противовоспалительного и иммуносупрессивного действий [32–34]. Однако необходимы дальнейшие исследования данного вопроса.
Анализ профиля микроРНК в экзосомах позволяет подробнее изучить патофизиологические особенности преэклампсии. Salomon C. et al. идентифицировали у беременных женщин более 300 микроРНК в экзосомах, полученных из плаценты, а также микроРНК в периферическом кровотоке [35]. Резко повышенные уровни miRNA-486-1-5p и miRNA-486-2-5p у женщин с преэклампсией позволили авторам предложить их в качестве биомаркера данного осложнения беременности.
В целом микроРНК являются ключевым звеном в широком спектре клеточных процессов, таких как пролиферация, дифференцировка и апоптоз. МикроРНК представляют собой короткие некодирующие РНК (18–25 нуклеотидов), которые участвуют в посттранскрипционной регуляции генов путем деградации мРНК или блокировании ее трансляции [36].
Как показано, аберрантная экспрессия некоторых микроРНК играет важную роль в развитии преэклампсии [37, 38]. В настоящее время уже изучено большое количество мироРНК с измененным профилем экспрессии при преэклампсии, которые могут быть потенциальными неинвазивными биомаркерами в диагностике заболевания и играть ключевую роль в его прогнозировании [39].
Также описано значимое изменение экспрессии микроРНК плацентарного происхождения (miR-515-3p, miR-517a, miR-517c and miR-518b) при преэклампсии, регулирующих миграцию и инвазию вневорсинчатого трофобласта [40].
Выявлена высокая прогностическая значимость оценки микроРНК, ассоциированных с сердечно-сосудистыми заболеваниями, в отношении поздней преэклампсии [41]. Включение в рутинный скрининг I триместра панели из 6 микроРНК (миР-20а-5р, миР-143-3р, миР-145-5р, миР-146а-5р, миР-181а-5р и миР-574-3р) позволило авторам повысить прогностическую точность выявления преэклампсии в 1,5 раза уже с ранних сроков беременности.
Опубликованы результаты исследований, свидетельствующих о патологической экспрессии при преэклампсии микроРНК, участвующих в процессах инвазии и миграции цитотрофобласта, апоптоза, клеточной пролиферации, ангиогенеза и эндотелиальной дисфункции, которые могут быть потенциальными биомаркерами преэклампсии [42–44]. Однако требуются дальнейшие исследования роли различных микроРНК в развитии преэклампсии и других плацентарных синдромов, анализ их диагностической и прогностической значимости.
В поиске биомаркеров различных заболеваний, так же как и преэклампсии, широко используются и достижения современной протеомики, которая позволяет провести количественный анализ тысячи белков в различных биологических жидкостях и тканях с дальнейшей их идентификацией. Протеом представляет собой набор всех продуцируемых белков в клетке, ткани или организме. Золотым стандартом протеомного анализа являются методы, основанные на жидкостной хроматографии-масс-спектрометрии с высоким разрешением, высокой точностью и высокой воспроизводимостью [45]. Идентифицировано большое количество белковых биомаркеров, ассоциированных с преэклампсией, однако с учетом сложности методики и анализа массива получаемых данных, в настоящее время эти исследования проводятся только с научной целью.
Сравнительный анализ протеомного профиля плазмы крови беременных, представленный Tarca A.L. et al. [46], позволил авторам выделить наиболее важные белковые предикторы преэклампсии в разные сроки беременности и прогнозировать ее развитие с достаточно высокой точностью (особенно раннего и тяжелого фенотипа). В частности, в сроки 16–22 недели авторами выявлено высокое содержание матриксной металлопротеиназы-7 и комплекса гликопротеинов IIbIIIa, которые могут быть надежными предикторами ранней преэклампсии в этом гестационном сроке (чувствительность 71% при 10% ложноположительных результатов). В сроки 22–28 недель отмечено снижение уровня плацентарного фактора роста (PlGF) и VEGF-A, изоформы 121 (VEGF-121), а также повышение иммуноглобулиноподобного лектина 6, связывающего сиаловую кислоту (siglec-6), и активина-А (чувствительность 81% при 10% ложноположительных результатов). В более поздние сроки гестации чувствительность протеомных моделей составила 85% (при 10% ложноположительных результатов), наилучшими предикторами указаны активированная молекула лейкоцитарной клеточной адгезии, siglec-6 и VEGF-121.
Метаболомика – изучение метаболома, представляющего собой глобальный профиль низкомолекулярных метаболитов (например, аминокислот, липидов, сахаров и гормонов), которые обнаруживаются при определенных условиях. Интересные данные получены, к примеру, в отношении исследования молекулярных механизмов эффективности применения сульфата магния при преэклампсии. Kawasaki K. et al. изучили метаболомный профиль плацент у женщин с преэклампсией, обработанных данным препаратом [47]. Выявлены значительные метаболические различия между плацентами женщин с преэклампсией и в контрольной группе; в частности, обнаружено снижение активности пути метаболизма глутатиона. При этом добавление сульфата магния стимулировало выработку глутатиона в иммортализованной клеточной линии трофобласта в условиях окислительного стресса (но не в нормальных условиях), а также подавляло индуцированное перекисью водорода образование активных форм кислорода, что свидетельствует о наличии у сульфата магния антиоксидантного эффекта на трофобласт.
Колоссальный объем данных, полученных с помощью омиксных технологий, требует сложного биоинформационного и статистического анализа для клинической интерпретации информации. Интеграция нескольких «омик» позволяет более детально понять биологические процессы и патофизиологию того или иного заболевания и осложнения беременности [48].
Примером мультиомиксного подхода в исследованиях является, к примеру, широкомасштабное изучение формирования и функций синцитиотрофобласта, находящегося в непосредственном контакте с материнскими тканями и обеспечивающего основные обменные процессы в плаценте. Синцитиотрофобласт имеет ограниченную продолжительность жизни и должен регулярно пополняться путем контролируемой дифференцировки и слияния подлежащих клеток цитотрофобласта. Комплексное использование омиксных технологий позволило изучить этот сложный и тщательно организованный процесс, включающий биохимические и морфологические изменения [48]. Обнаружено, что биохимическая дифференцировка начинается с выхода клеток цитотрофобласта из клеточного цикла [49] и репрессии генов (таких как ELF5, TP63, ID2, TEAD4), участвующих в поддержании их состояния в качестве предшественников. Одновременно индуцируются факторы, участвующие в транспорте питательных веществ, иммуномодуляции, биосинтезе и метаболизме гормонов. Интеграция множественных сигнальных путей и факторов транскрипции, а также эпигенетических регуляторов вовлечена в процесс дифференцировки цитотрофобласта. Подробная их характеристика обсуждается в нескольких всесторонних обзорах [50–52].
Заключение
Таким образом, интегрированный «мультиомный» подход системной биологии является в настоящее время незаменимым инструментом для анализа сложных массивов биологических данных, позволяющим найти новые ассоциации между различными патогенетическими звеньями многокомпонентного процесса, определить наиболее значимые физиологические и патологические биомаркеры, построить модели развития заболеваний и осложнений беременности. Мультиомные исследования в перспективе являются многообещающими и в отношении изучения проблемы преэклампсии. Дальнейшее совершенствование способов получения и анализа больших массивов данных (big data analysis), возможно, позволит разобраться в этиопатогенетических механизмах и клинических вариантах данного осложнения беременности.



