Новая коронавирусная инфекция 2019 (COVID-19) – острое инфекционное заболевание, вызываемое РНК-содержащим вирусом рода Betacoronavirus семейства Coronaviridae. Международный комитет по таксономии вирусов 11 февраля 2020 г. присвоил возбудителю официальное название – SARS-CoV-2. Первый случай заболевания был зарегистрирован в городе Ухань провинции Хубэй (Китайская Народная Республика) в декабре 2019 г. [1].
Стремительный рост заболеваемости и молниеносное распространение вируса по всему миру вызвали большую озабоченность среди медицинского сообщества. 11 марта 2020 г. Всемирная Организация Здравоохранения (ВОЗ) объявила вспышку COVID-19 пандемией. Несмотря на меры, предпринимаемые правительствами многих стран, эпидемиологическая обстановка остается тяжелой, а вирус продолжает распространяться. Особое опасение представляют группы риска повышенной восприимчивости и тяжелого течения инфекции COVID-19, к которым относят беременных [2].
Согласно прошлому опыту течения респираторных вирусных инфекций, во время беременности отмечалась высокая частота материнских осложнений, таких как самопроизвольные выкидыши, преждевременное излитие околоплодных вод и преждевременные роды, потребность перевода в отделение реанимации и интенсивной терапии, необходимость в искусственной вентиляции легких [3, 4]. Установлено, что вирусная пневмония, протекающая на фоне таких сопутствующих заболеваний, как хронические сердечно-сосудистые и респираторные заболевания, ожирение, сахарный диабет, увеличивает материнскую и неонатальную смертность [5].
Учитывая накопленные знания о неблагоприятных исходах беременностей, ассоциированных с SARS-CoV или MERS-CoV, было высказано много опасений по поводу влияния SARS-CoV-2 на течение и исходы беременности [6]. Это привело к каскаду многочисленных исследований, проводимых во всем мире по изучению влияния SARS-CoV-2 на течение беременности, акушерские и неонатальные исходы.
Физиологические изменения во время беременности
Согласно данным, опубликованным за последний год, здоровые беременные, вероятно, более восприимчивы к инфекции SARS-CoV-2, чем небеременные женщины репродуктивного возраста [7]. Это связано с адаптационно-приспособительными изменениями, которые происходят в организме беременной.
Особенности ответных иммунных реакций во время беременности делают женщину уязвимой к инфекционным агентам. Анатомические изменения, которые происходят в дыхательной системе беременной: высокое стояние диафрагмы, уменьшение вертикального объема грудной клетки, приводят к снижению функциональной остаточной емкости легких, объема конечного выдоха и к компенсаторному увеличению частоты дыхания, способствуют повышенной восприимчивости к респираторным заболеваниям. Миорелаксанты и прогестерон расширяют дыхательные пути и подавляют активность мукоцилиарного клиренса, приводящие в конечном итоге к снижению местных защитных функций. В связи с тем, что потребность в кислороде при беременности увеличивается, беременные труднее, чем небеременные, переносят гипоксию любого генеза и степени тяжести [8, 9]. Это наиболее значимые факторы, которые позволяют отнести беременных к группе риска по заболеваемости и тяжелому течению респираторных инфекций, включая COVID-19.
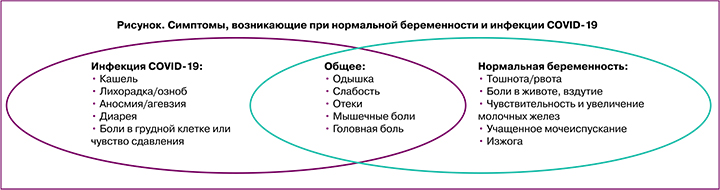
Гиперкоагуляция во время беременности увеличивает риск развития осложнений и летальных исходов, связанных с инфицированием беременных SARS-CoV-2. Гемостазиологический статус при беременности характеризуется увеличением потенциала свертывания крови, повышением структурных свойств сгустка, угнетением ферментативной фибринолитической активности, повышенной выработкой тромбина, плазминогена, VII, VIII, X факторов свертывания, усиление внутрисосудистого воспаления. Беременные подвергаются повышенному риску развития тромбоэмболических осложнений, а при присоединении новой коронавирусной инфекции 2019 этот риск многократно увеличивается. Появляющиеся данные свидетельствуют о том, что дисфункция эндотелиальных клеток играет большую роль в возникновении и прогрессировании острого респираторного дистресс-синдрома, который является основной причиной смерти при COVID-19. Дисфункция эндотелиальных клеток также наблюдается у пациенток с преэклампсией [10]. В результате исследования INTERCOVID были получены данные, что преэклампсия увеличивает риск инфицирования COVID-19 и связанных с ним осложнений [11]. Уникальные физиологические изменения затрудняют распознавание легочной патологии во время беременности, а широкий спектр симптомов инфекции COVID-19 осложняет своевременную постановку диагноза и начало лечения у беременных (рисунок) [12].
Течение инфекции COVID-19
Большинство беременных, инфицированных SARS-CoV-2, имеют бессимптомное течение. В систематическом обзоре PregCOV-19, посвященном скринингу на COVID-19 во время беременности, включающем более 64 000 беременных женщин по всему миру с подозрением или подтвержденным COVID-19 (до 29 ноября 2020 г.), было показано, что 74% женщин имели бессимптомное течение. Другое исследование из США сообщило, что 86% беременных, которые были госпитализированы во время родов и обследованы на SARS-CoV-2, имели положительный результат теста, но при этом не имели симптомов инфекции. При симптоматическом течении инфекции COVID-19 женщины отмечают легкие или умеренные жалобы; аналогичная картина наблюдается при ОРВИ или гриппе. Наиболее распространенными симптомами COVID-19 у беременных были кашель (41%) и лихорадка (40%). Менее частыми симптомами были одышка (21%), миалгия (19%), аносмия/агевзия (14%) и диарея (8%). Беременные с COVID-19 реже страдали лихорадкой и миалгией, чем небеременные женщины того же возраста. Подобные результаты были опубликованы и в других обзорах [13].
Исследование PRIORITY – реестр исходов COVID-19 во время беременности, продолжающееся проспективное когортное исследование беременных в США, показало, что наиболее распространенными первыми симптомами у инфицированных женщин были кашель (20%), боль в горле (16%), миалгия (12%) и лихорадка (12%). В этой группе из 594 женщин с симптомами у 25% сохранялись стойкие симптомы через 8 недель и более после начала заболевания. В настоящее время не ясно, является ли беременность фактором, который влияет на развитие длительных признаков или симптомов после острой инфекции COVID-19 (так называемое «длительное заболевание COVID-19», или постковидное состояние) [13].
По данным метаанализа, проведенного группой авторов из Австралии, Пакистана и Канады, беременные с тяжелым течением COVID-19 были примерно на 3,7 года старше, и риск тяжелого COVID-19 был выше среди женщин в более высокой возрастной группе (>35 лет). Риск развития тяжелой формы COVID-19 также был выше среди женщин, страдающих ожирением, сахарным диабетом или гестационным сахарным диабетом, хронической артериальной гипертензией, преэклампсией, курением. Сопутствующие заболевания были идентифицированы как фактор риска госпитализации беременной в отделение реанимации и интенсивной терапии. Почти половина всех женщин имели бессимптомное течение. Лихорадка, кашель, слабость, аносмия/агевзия являются наиболее распространенными симптомами у беременных; 7% женщин были госпитализированы в отделение реанимации и интенсивной терапии, 8% потребовалась искусственная вентиляция легких, 15% – неинвазивная вентиляция легких и 0,3% переведены на экстракорпоральную мембранную оксигенацию. Около 50% беременных были родоразрешены путем операции кесарева сечения, причем 60% имели акушерские показания, а около 40% – показания, связанные с COVID-19; 25% всех родов были преждевременными. Частота кесарева сечения была почти в 1,5 раза выше в группе беременных с тяжелой формой течения COVID-19 [14, 15].
По мнению ВОЗ, беременные не подвержены более высокому риску заражения SARS-CoV-2. Тем не менее, по данным ряда исследований, в случае заражения беременные подвержены более высокому риску развития тяжелого течения COVID-19 по сравнению с небеременными аналогичного возраста [16].
Вертикальная трансмиссия
Вопрос о возможности внутриутробной передачи вируса от матери плоду остается открытым. Вертикальная передача – это способ передачи патогенов от матери к плоду/новорожденному в период до и после рождения. Она включает передачу через плаценту во время беременности, через родовые пути в процессе родов и через грудное молоко во время грудного вскармливания.
Плацента выполняет барьерную функцию, защищая плод от патогенов, однако некоторые инфекционные агенты способны проходить через плацентарный барьер, вызывая врожденные инфекции [9].
В ранних сообщениях из Китая отмечалось, что внутриутробная передача маловероятна [17–19]. Однако обнаружение антител в пуповинной крови и в венозной крови у новорожденных вызвало озабоченность [20]. Для подтверждения вертикальной передачи необходимо провести тестирование плацентарной ткани, амниотической жидкости (до разрыва околоплодных оболочек), пуповинной крови, крови новорожденного в первые 12 ч и мазка из носоглотки новорожденного методом ПЦР в раннем неонатальном периоде [21]. Первоначальные исследования, в ходе которых были протестированы данные образцы, не обнаружили никаких доказательств, подтверждающих вертикальную трансмиссию [22–24]. Однако недавно опубликованные отчеты свидетельствуют об обратном [25–28]. Отсутствие внутриутробной передачи предполагает, что роды через естественные родовые пути не могут быть фактором риска передачи COVID-19 новорожденному, что подтверждается многими исследованиями, документирующими отсутствие SARS-CoV-2 во влагалищных выделениях [21, 29, 30]. Но нельзя с уверенностью исключить внутриутробную передачу, поскольку для ее диагностики требуется исследование мазка из носоглотки новорожденного сразу после рождения и в течение 24–48 ч. В большинстве сообщений новорожденные впервые проходили тестирование более чем через 24–48 ч после рождения. Кроме того, в последнее время SARS-CoV-2 также был зарегистрирован во влагалищных выделениях [27, 31].
Saadaoui M. et al. проанализировали 38 исследований, в которых оценивалось влияние COVID-19 на беременность, используя биологические образцы новорожденных, взятые у матерей с подтвержденной инфекцией COVID-19. Авторы пришли к выводу, что вертикальная передача COVID-19 в III триместре возможна, но происходит очень редко. Вертикальная трансмиссия SARS-CoV-2 составила примерно 2,9% по результатам неонатального исследования ПЦР мазка из носоглотки и 7,7 и 2,9% – при исследовании плаценты и пуповинной крови соответственно, в то время как это не было подтверждено при анализе околоплодных вод и мочи новорожденных. При этом возможность вертикальной передачи была отмечена в 9,7% при анализе проб кала и мазков из прямой кишки новорожденных [32].
Raschetti R. еt al. провели метаанализ, включивший 174 случая неонатальной инфекции, и показали, что 70 и 30% инфекций вызваны окружающей средой и вертикальной передачей соответственно. У 55% инфицированных новорожденных было симптоматическое течение, которое включало лихорадку (44%), желудочно-кишечные (36%), респираторные (52%) и неврологические симптомы (18%). Данные CDC и других исследований показали, что у большинства инфицированных новорожденных наблюдались бессимптомное или легкой степени тяжести течение. Однако в ходе национального популяционного когортного исследования в Великобритании у 42% инфицированных новорожденных наблюдались тяжелые симптомы. Крупномасштабное международное исследование показало, что новорожденные у женщин с COVID-19 во время беременности имели значительно более высокий риск тяжелой перинатальной заболеваемости и смертности. Эти риски оставались статистически значимо высокими после корректировки на недоношенность, что указывает на прямое влияние COVID-19 на новорожденных [33].
Song D. et al. провели анализ 145 родильниц, у которых был положительный результат теста на SARS-CoV-2 во время беременности. У 86 пациенток было симптоматические течение, из них 78 женщин перенесли инфекцию COVID-19 легкой и средней степени тяжести, а 8 беременных – тяжелого и крайне тяжелого течения. Авторы оценили показатель серопозитивности женщин при родах, который составил 65%, и пуповинной крови – 58%. Уровни IgG достоверно коррелировали между материнской и пуповинной кровью. Коэффициент трансплацентарного переноса IgG был значительно выше, когда первый положительный результат ПЦР был получен за 60–180 дней до родов, по сравнению с теми, у кого отмечалось менее 60 дней. Частота серореверсии IgG у младенцев в течение периодов наблюдения 1–4, 5–12 и 13–28 недель составила 8% (4/48), 12% (3/25) и 38% (5/13) соответственно. Серопозитивность IgG у новорожденных была достоверно связана с уровнем IgG в пуповинной крови и сохранялась до 6-месячного возраста. У 2 новорожденных в возрасте 2 недель наблюдалась сероконверсия с высокими уровнями IgM и IgG, в том числе у 1 недоношенного ребенка с подтвержденной внутриутробной инфекцией. Антитела класса G к SARS-CoV-2 эффективно переносятся через плаценту, когда инфекции возникают более чем за 2 месяца до родов. Пассивный иммунитет, полученный от матери, сохраняется у младенцев до 6 месяцев жизни. Новорожденные способны вырабатывать сильный антигенный ответ на перинатальную инфекцию SARS-CoV-2 [34].
Грудное вскармливание
Научные исследования последних лет доказали неоспоримые преимущества грудного вскармливания не только для новорожденных, но и для матерей. Грудное молоко способствует нервно-психическому развитию, защищает новорожденных от инфекционных и хронических болезней. Исключительно грудное вскармливание способствует снижению смертности детей первого года жизни. Особый интерес представляет роль грудного вскармливания в вертикальной передаче SARS-CoV-2 от матери новорожденным через грудное молоко и потенциальные защитные свойства целевых антител и других иммунопротекторных компонентов грудного молока против COVID-19 [35, 36].
В начале пандемии из-за отсутствия знаний о новой коронавирусной инфекции 2019 рекомендации носили консервативный и осторожный характер. Подтвержденная инфекция COVID-19 являлась противопоказанием к грудному вскармливанию [37].
Chen H.J. et al. и Hascoët J.M. et al. в своих исследованиях показали отсутствие проникновения SARS-CoV-2 в грудное молоко [38, 39].
При этом Tam P.C. et al. и Bastug A. et al. в своих работах обнаружили вирус SARS-CoV-2 в грудном молоке методом ПЦР [40, 41]. Важно отметить, что обратной стороной диагностических тестов ПЦР является то, что они определяют вирусную нуклеиновую кислоту в течение 12 недель, даже если человек больше не заразен [42]. Обнаружение вирусной РНК с помощью ПЦР в режиме реального времени не обязательно означает контагиозность пациента.
Несколько крупных исследований продемонстрировали отсутствие передачи вируса SARS-CoV-2 от матери новорожденному через грудное молоко [37]. В ряде исследований показано, что грудное молоко, вырабатываемое инфицированными матерями, является источником антител IgA и IgG к SARS-CoV-2 и нейтрализует активность вируса [37].
По мнению ВОЗ, при бессимптомном или легком течении COVID-19 грудное вскармливание может быть продолжено при соблюдении защитных мер. Перед каждым кормлением женщина должна тщательно вымыть руки, обработать молочные железы, обработать руки антисептиком, кормление осуществлять в маске [43].
R.M. Pace et al. в своем исследовании не обнаружили РНК SARS-CoV-2 в грудном молоке женщин с легким и среднетяжелым течением COVID-19. Кроме того, они показали, что грудное молоко содержит антитела против SARS-CoV-2, и что их концентрация коррелирует со способностью грудного молока эффективно нейтрализовать SARS-CoV-2. Они обнаружили РНК SARS-CoV-2 в области ареолы/соска нескольких женщин. Однако наличие РНК на поверхности кожи молочных желез не говорит о жизнеспособности вируса. По мнению авторов, инфицированные женщины не должны регулярно обрабатывать молочные железы перед грудным вскармливанием или сцеживанием молока. Авторы рекомендуют поддерживать грудное вскармливание женщинам с легким и среднетяжелым течением COVID-19 [44].
В настоящее время недостаточно данных, чтобы сделать выводы о вертикальной передаче COVID-19 через грудное молоко. У новорожденных риск заражения COVID-19 невысокий, а при инфицировании заболевание в большинстве случаев протекает в легкой форме или бессимптомно, в то время как последствия отказа от грудного вскармливания и разделение новорожденного и матери могут нанести большой урон как для физического, так и ментального здоровья. На данный момент инфекция COVID-19 у новорожденных представляет меньшую угрозу для выживания и здоровья, чем другие потенциальные инфекции, от которых защищает грудное молоко. Беременные, которые переболели COVID-19 в III триместре и выздоровели к моменту родов, должны быть нацелены на грудное вскармливание.
Вакцинация
Острая необходимость внедрения методов профилактики новой коронавирусной инфекции 2019 индуцировала многочисленные исследования, направленные на разработку эффективных вакцин против COVID-19. Несмотря на подверженность беременных тяжелому течению инфекции, данная категория женщин не была включена в клинические испытания имеющихся вакцин против COVID-19 в связи с этическими нормами. Профессиональные сообщества во всем мире рекомендуют проведение вакцинации данной категории женщин для снижения неблагоприятных воздействий COVID-19 на течение и исходы беременности [13, 45].
Министерство здравоохранения Российский Федерации разрешило использовать вакцину от инфекции COVID-19 «Спутник V» в конце июня 2021 г. для беременных с высоким риском тяжелого течения заболевания. На сегодняшний день нет данных, свидетельствующих о негативном влиянии вакцинации на течение беременности и перинатальные исходы. Проанализированы данные 773 женщин, вакцинированных от COVID-19 во время беременности, предоставленные 26 субъектами Российской Федерации. Заболеваемость COVID-19 у вакцинированных пациенток была низкой – 2%, из них 93,7% пациенток перенесли инфекцию в легкой форме. Беременность завершилась у 20,3% женщин, у 79,7% беременность пролонгируется. Преждевременные роды произошли в 5,9% случаев от общего числа родов. Самопроизвольная потеря беременности до 22 недель произошла в 13,3%, из них в 86,2% – в I триместре, в 13,8% – во II триместре. Частота осложнений беременности у пациенток, вакцинированных от COVID-19 во время беременности, была не выше, чем в популяции, и значительно ниже, чем при заболевании COVID-19 во время беременности, что свидетельствует в пользу вакцинации беременных женщин с целью профилактики неблагоприятных перинатальных исходов [46]. В 5-й версии временных клинических рекомендаций «Организация оказании медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной COVID-19» от ноября 2021 г. рекомендуется проведение вакцинации в группе риска тяжелого течения COVID-19 с 12 недель беременности. Лактация не является противопоказанием [47].
После того, как было выдано разрешение на использование вакцин мРНК BNT162b2 (Pfizer-BioNTech) и мРНК-1273 (Moderna), группы населения с наибольшим риском заболеваемости и смерти, связанных с коронавирусной инфекций 2019, были в приоритете для вакцинации. Среди них были беременные, несмотря на то, что они были исключены из первоначальных испытаний вакцины. В недавней публикации Центра по контролю и профилактики заболеваний (CDC) [48] сообщается, что более 30 000 женщин подверглись воздействию мРНК-вакцин в США. Боль в месте инъекции отмечалась чаще у беременных, чем у небеременных, в то время как головные боли, миалгия, озноб и лихорадка отмечались реже. Беременные не сообщали о серьезных реакциях чаще, чем небеременные женщины, за исключением тошноты и рвоты, о которых сообщалось несколько чаще только после введения второго компонента. В общей сложности было проанализировано 827 исходов беременности среди 5230 беременных женщин, включенных в проспективный реестр v-safe pregnancy. В результате исследования 712 случаев беременности (86,1%) закончились живорождением, самопроизвольным абортом – 12,6% (104 случая), мертворождением – 0,1% (1 случай) и искусственным прерыванием беременности или внематочной беременностью – 1,2% (10 случаев). Среди 724 живорожденных младенцев, включая 12 случаев многоплодной беременности, 9,4% родились недоношенными (60 из 636 вакцинированных до 37 недель), 3,2% имели низкую массу тела для гестационного срока и 2,2% – серьезные врожденные аномалии. На момент опроса не было зарегистрировано ни одной смерти новорожденного. Случаи самопроизвольного выкидыша, осложнений беременности, недоношенности и врожденных дефектов были сопоставимы с общепопуляционными.
Предварительные данные американских коллег продемонстрировали передачу материнских антител плоду через плаценту, хотя еще слишком рано делать вывод о том, что это защитит будущих новорожденных [49].
Неживые вакцины не увеличивают риск развития врожденных пороков развития. Данные о других неживых вакцинах, таких как вакцина против гриппа, обнадеживают [50]. Известно, что мРНК-вакцины действуют локально (в месте инъекции) и быстро удаляются лимфатической системой. Вероятность того, что вакцина достигнет плаценты и пройдет ее, считается низкой. Учитывая эти данные, вакцинацию можно считать для беременных условно безопасной со II триместра (период наименьшего риска тератогенного действия и прерывания беременности) и необходимой, особенно при наличии факторов риска тяжелого течения COVID-19 или высокого риска заражения [51].
Заключение
Пандемия COVID-19 оказала катастрофическое влияние на мир с начала декабря 2019 г. Новая коронавирусная инфекция 2019 стала главной головоломкой для врачей всех специальностей.
Повышенный риск неблагоприятных исходов у беременных подчеркивает необходимость национальных и/или международных рекомендаций и руководствующих принципов для оптимизации существующих мер профилактики и лечения, снижения материнской смертности от COVID-19 во время беременности и в послеродовом периоде. Активная и пассивная профилактика COVID-19 одобрена в качестве эффективной стратегии для женщин, которые находятся на прегравидарном этапе, во время беременности и в период грудного вскармливания. Понимание того, что беременные являются уязвимой группой населения, имеет важное значение для улучшения медицинской помощи в условиях пандемии COVID-19. В целом имеющиеся данные свидетельствуют о том, что большинство беременных перенесут инфекцию COVID-19 бессимптомно. Врожденная инфекция возможна, но заболеваемость крайне низка, и чаще всего трансмиссия происходит при горизонтальной передаче при контакте с инфицированной мамой или бессимптомным медицинским персоналом. Доктора и медицинские сестры должны проводить профилактические беседы с беременными и/или родильницами о важности грудного вскармливания в эпоху пандемии и о возможных способах профилактики.



