Рак шейки матки является одним из наиболее распространенных злокачественных новообразований органов репродуктивной системы женщин. Несмотря на визуальную локализацию, среди впервые выявленных пациенток в 40–60% случаев встречаются стадии заболевания IIb–IIIb (FIGO, 2009) [1–3]. За последние десятилетия наметилась неблагоприятная тенденция к омоложению контингента больных злокачественными новообразованиями шейки матки. Так, среди пациенток в возрастной группе 20–39 лет заболеваемость за 10 лет увеличилась на 17%, до 70% из них поступает с IIb–IV стадиями заболевания. Летальность в течение первого года с момента установки диагноза составляет примерно 20%, что свидетельствует о поздней диагностике данного заболевания и не всегда хороших результатах терапии [4–8].
При лечении больных раком шейки матки стадий Iа–Ib1 (FIGO, 2009), как правило, применяется хирургическое вмешательство [5, 9, 10], в то время как пациенткам с местнораспространенными формами заболевания (стадии IIb–IIIb, FIGO, 2009) проводится в основном химиолучевая терапия [11–14]. Несмотря на то что современная лучевая терапия обладает техническими возможностями подведения необходимых доз к опухолевому очагу, достигнуть устойчивого эффекта не всегда удается, частота рецидивов достигает 30–50%, сопровождаясь ростом частоты и тяжести лучевых осложнений. Так, при IIb стадии заболевания 5-летняя выживаемость составляет 63,1%, при IIIa – 44,5%, IIIb – 31,5% [15–17].
В связи с неудовлетворительными результатами лечения больных местнораспространенным раком шейки матки на протяжении нескольких десятилетий производится исследование эффективности противоопухолевых лекарственных препаратов при этом заболевании. Показано, что использование в комплексном лечении таких пациенток неоадъювантной химиотерапии позволяет достичь значительного уменьшения опухоли в размерах, резорбции параметральных инфильтратов, и в ряде случаев дает возможность выполнить радикальную операцию. Наибольшая эффективность отмечена при включении в схему лекарственной терапии таксанов и производных платины. В связи с этим многие авторы склонны рассматривать данный подход как альтернативу химиолучевому методу лечения [18–21].
Требованиями сегодняшнего дня в хирургии являются не только выполнение высокотехнологичных операций, но и достижение высокого уровня реабилитации после этих вмешательств [22]. Это привело к внедрению лапароскопии практически во все области хирургии. В онкогинекологии основным условием является применение онкологических принципов, используемых при открытых вмешательствах, с реализацией преимуществ, предоставляемых малоинвазивными технологиями [23, 24].
В зарубежной литературе сравнительно давно было показано, что онкологические результаты радикальной гистерэктомии, выполненной при начальных стадиях рака шейки матки, не различаются при использовании лапароскопического и лапаротомического доступов [24–26]. Исследования результатов лапароскопической радикальной гистерэктомии, выполненной у больных местнораспространенным раком шейки матки после неоадъювантной химиотерапии, крайне малочисленны и содержат разноречивые результаты.
Цель исследования: изучение эффективности неоадъювантной химиотерапии с последующей лапароскопической радикальной гистерэктомией в комплексном лечении больных местнораспространенным раком шейки матки.
Материал и методы исследования
Данная работа представляет собой пилотное исследование случай-контроль, в которое включена 81 больная местнораспространенным раком шейки матки, пролеченная в отделении инновационной онкологии и гинекологии ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России и ФГБУ РНЦРР Минздрава России за период с 2003 по 2016 гг. У всех пациенток был верифицирован инвазивный плоскоклеточный рак по данным гистологического исследования.
На первом этапе комплексного лечения исследованным больным проводилась неоадъювантная химиотерапия, после чего оценивался ее результат, и при достижении состояния резектабельности опухолевого процесса по результатам дооперационного обследования (использование стандартных клинических методов, ультразвукового исследования (УЗИ), магнитно-резонансной томографии (МРТ) подтверждало полную или частичную регрессию опухоли) выполняли хирургическое вмешательство.
У 6 больных (7,4%) после проведения неоадъювантного лекарственного лечения процесс был расценен как нерезектабельный за счет недостаточной резорбции инфильтратов в параметриях или сохранения больших размеров опухоли. Этим пациенткам была проведена стандартная химиолучевая терапия по радикальной программе без включения хирургического вмешательства.
Операция была произведена 75 пациенткам (92,6%), которые для проведения ретроспективного анализа были разделены на 2 группы: основную составили 15 больных, прооперированных с использованием эндовидеохирургической техники, и контрольную – 60 пациенток, оперативное вмешательство которым проведено с применением лапаротомического доступа.
Возраст больных основной группы варьировал от 28 до 61 года, в среднем составляя 39,9±5,6 года, в группе контроля – от 32 до 65 лет, в среднем – 46,0±11,0 года.

По стадиям (классификация FIGO 2009) исследованные пациентки распределились следующим образом: среди больных основной группы рак шейки матки стадии IIb диагностирован у 13 (86,6%), IIIb – у 2 (13,4%) пациенток. В контрольной группе стадия заболевания IIb была выявлена у 42 (70,0%) больных, IIIb – у 18 (30,0%). Среди пациенток, которым оперативное лечение не проводилось, у 4 (66,7%) отмечался рак шейки матки стадии IIIb, у 2 (33,3%) – IIb.
До начала лечения, а также на всех его этапах пациенткам выполнялось комплексное обследование, включающее, помимо стандартных клинико-лабораторных методов, МРТ и 3D УЗИ органов малого таза. С целью объективной оценки полученных данных определяли объем шейки матки. При использовании клинического исследования и МРТ фиксировали размеры опухоли в трех плоскостях (A, B, C) и применяли формулу расчета объема шейки матки 4/3 π*(A+B+C)/6. При УЗИ определяли объем опухоли шейки матки на основании количественной оценки данных, полученных в режиме статического трехмерного сканирования, с помощью программы VOCAL.
Исследованным больным проводили курс неоадъювантной химиотерапии по схеме карбоплатин AUC-6 и паклитаксел 175 мг/м2. Эффективность лечения определялась через 2 недели. Для этого применяли единую систему критериев оценки ответа солидных опухолей (Response Evaluation Criteria In Solid Tumors – RECIST1.1) [27]. Данная система включает в себя четыре степени ответа опухоли:
- полная регрессия – исчезновение всех поражений;
- частичная регрессия – большее или равное 30% уменьшение размеров опухоли шейки матки и отсутствие прогрессирования других очагов;
- прогрессирование заболевания – большее или равное 20% увеличение размеров опухоли шейки матки или появление новых поражений;
- отсутствие изменений – при изменении размеров опухоли, не отвечающим критериям «частичный ответ», «прогрессирование заболевания».
В случае достаточной резорбции новообразования выполняли хирургическое вмешательство. При сохранении параметральных инфильтратов, больших размеров опухоли шейки матки оперативное лечение не проводили, пациентки направлялись на химиолучевую терапию по радикальной программе.
Хирургическое вмешательство выполнялось в объеме радикальной экстирпации матки Piver III (тип C2 по классификации Querleu–Morrow [28, 29]). Особенности оперативных вмешательств, проведенных с использованием лапароскопического и лапаротомического доступов, сравнивали в исследованных группах пациенток.
После получения патоморфологического описания операционного материала исследованных больных выявлялись группы риска по развитию прогрессирования заболевания, при необходимости пациентки направлялись на адъювантную лучевую терапию [30].
Результаты и обсуждение
81 пациентке была проведена неоадъювантная химиотерапия в запланированных дозах. После проведения курса лекарственного лечения тошнота зарегистрирована у 68 пациенток (83,9%), во всех случаях I степени. Рвота I степени отмечена у 26 исследованных больных (32,1%). Проявления миелотоксичности, периферической нейротоксичности, гепатотоксичности были минимальны и не потребовали специального лечения. Продолжительность госпитализации пациенток составляла от 3 до 6 (4,0±0,9) дней.
При оценке объема шейки матки после неоадъювантной химиотерапии было выявлено уменьшение этого показателя у всех по данным клинического исследования, УЗИ и МРТ (таблица 1).
Полная регрессия опухоли отмечена у 4 пациенток (4,9%), частичная регрессия – у 77 (95,1%) (см. рис. 1, 2). Прогрессирования заболевания после курса неоадъювантной химиотерапии мы не наблюдали. 75 пациенткам (92,6%) проведено радикальное хирургическое лечение, у 6 больных (7,4%), несмотря на выраженный местный эффект в виде уменьшения размеров опухоли, процесс был расценен как нерезектабельный за счет недостаточной резорбции инфильтратов в параметриях. Эти пациентки были отправлены на химиолучевую терапию по радикальной программе.
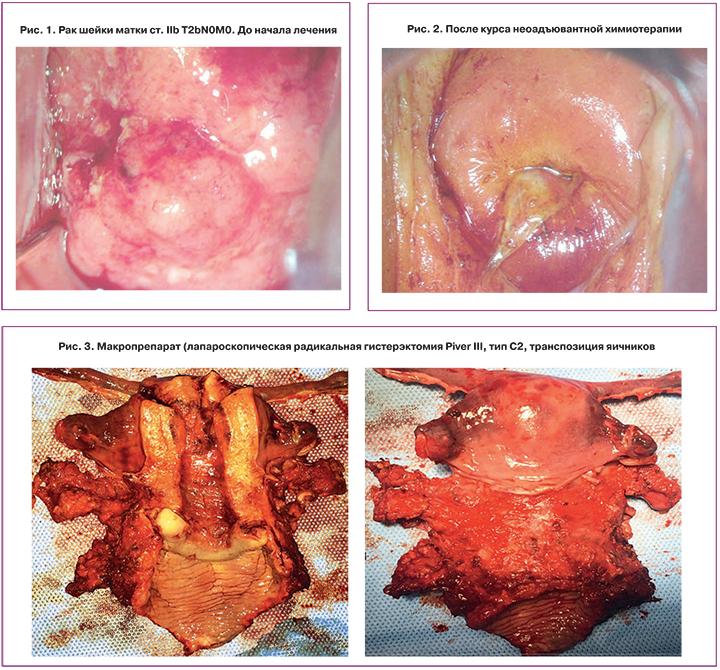
Оперативное лечение выполняли в объеме радикальной гистерэктомии Piver III [28] (тип C2 по классификации Querleu–Morrow [29]) (см. рис. 3), использовали лапароскопический (основная группа) или лапаротомический доступы (группа контроля). У пациенток репродуктивного возраста производилась транспозиция яичников в верхние отделы брюшной полости (на уровне нижних полюсов почек). Сравнение результатов оперативных вмешательств представлено в табл. 2.
Продолжительность радикальной гистерэктомии, выполненной посредством лапаротомического доступа, оказалась достоверно ниже таковой при использовании лапароскопии, составляя 154,2±6,2 и 270,5±21,9 минут соответственно (p<0,05). Объем кровопотери в группе больных, прооперированных лапароскопически, был достоверно ниже, чем среди пациенток, подвергнутых оперативному вмешательству открытым способом (234,6±37,6 и 738,5±47,4 мл соответственно, p<0,05). Продолжительность госпитализации оказалась выше в группе пациенток, оперированных лапаротомическим доступом (табл. 2).
Интраоперационных осложнений в обеих группах пациенток отмечено не было. В послеоперационном периоде у всех пациенток основной группы и у 15 пациенток группы контроля (25,0%) наблюдалась атония мочевыводящих путей. Лечение проводили консервативным способом, функция мочевого пузыря восстанавливалась полностью во всех случаях.
При гистологическом исследовании операционного материала у всех прооперированных пациенток обеих групп была обнаружена остаточная опухоль в шейке матки с признаками лечебного патоморфоза 1–3-й степени, отсутствовали опухолевые клетки по линии отсечения влагалища и параметриев (R0). Количество тазовых лимфоузлов было примерно одинаковым в обеих группах пациенток, составляя от 7 до 12 с каждой стороны. У 7 (46,7%) больных основной группы и у 30 (50%) пациенток группы контроля выявлены метастазы в тазовых лимфоузлах. Длина удаленных крестцово-маточных связок и параметриев, а также влагалищной манжеты не различалась в исследованных группах пациенток.
После хирургического лечения пациентки, относящиеся к группам высокого и среднего рисков прогрессирования заболевания, направлялись для проведения адъювантной лучевой терапии [30]. Среди прооперированных больных 72 (96,0%) потребовалось проведение адъювантной лучевой терапии, 3 пациентки с полной резорбцией опухоли (4,0%) в адъювантном лечении не нуждались. По данным некоторых авторов [31], сочетание хирургического и лучевого воздействия на ткани малого таза приводит к трофическим нарушениям и, как следствие, повышенной вероятности образования свищей. За период наблюдения в обеих группах пациенток после проведенного комплексного лечения формирования свищей мы не наблюдали.
Таким образом, среди исследованных больных местнораспространенным раком шейки матки после неоадъювантной химиотерапии радикальное оперативное лечение удалось произвести в 75 из 81 случаев (92,6%).
Побочные эффекты химиотерапии были незначительны и не повлияли на сроки проведения хирургического вмешательства.
При сравнении результатов операций, выполненных с использованием лапароскопического доступа и лапаротомии, выявлено, что гистопатологические показатели (количество лимфоузлов, уровень удаления связочного аппарата, длина влагалищной «манжеты», отсечение в пределах неизмененных тканей) не отличались достоверно в различных группах пациенток. При этом в группе больных, оперированных с применением лапароскопии, отмечено сокращение объема кровопотери, уменьшение времени госпитализации, что позволило достичь в более короткие сроки реабилитации пациенток и начать при необходимости адъювантное лечение.
Техническая сложность выполнения хирургического вмешательства с использованием лапароскопического доступа у больных после неоадъювантной химиотерапии определяет важность высокой квалификации хирургов, анестезиологов и оснащенности медицинского учреждения.
Небольшой срок наблюдения в данном исследовании не позволяет оценить отдаленные результаты у пациенток с местнораспространенным раком шейки матки, пролеченных с включением неоадъювантной химиотерапии и оперативного вмешательства. Кроме того, требуются дальнейшие работы по изучению сравнительной эффективности эндовидеохирургических и традиционных лапаротомических операций в хирургическом этапе лечения данных пациенток.
Выводы
1. Проведение неоадъювантной химиотерапии – эффективный метод повышения резектабельности опухолевого процесса у больных местнораспространенным раком шейки матки.
2. Включение хирургического этапа в комплексное лечение больных местнораспространенным раком шейки матки позволит более точно установить распространенность опухолевого процесса, снизит количество пациенток, подвергшихся лучевой терапии, позволит в ряде случаев сохранить яичники у женщин репродуктивного возраста.
3. Гистопатологические показатели лапароскопической радикальной гистерэктомии при местнораспространенном раке шейки матки являются сопоставимыми с таковыми при использовании традиционного лапаротомического доступа.



