Стремительное развитие медико-биологических наук и трансляционной медицины расширили наши представления о молекулярных основах жизнедеятельности в различные периоды жизни человека. Особое место при этом занимает изучение биологических «не репродуктивных» эффектов стероидных гормонов, в частности прогестерона, который длительное время рассматривался как эссенциальный гормон – индикатор фертильности менструального цикла и ключевой гормон беременности [1–4]. Интерес исследователей и клиницистов к изучению геномных и внегеномных эффектов прогестерона связан с его участием в метаболических процессах центральной нервной системы (ЦНС), а во время беременности – с влиянием не только на ее успешный исход, но и на ЦНС плода, а также «качество» психического здоровья новорожденного [5, 6]. Настоящий обзор посвящен роли прогестерона в акушерстве и перинатологии.
Метаболизм прогестерона
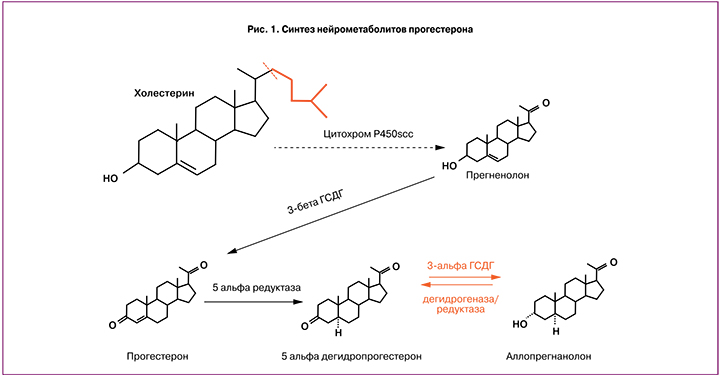
Как и любой стероидный гормон, прогестерон синтезируется из холестерина и формируется в два последовательных этапа: превращение холестерина в прегненолон в митохондриях клеток с помощью фермента цитохрома P450scc, далее под действием 3β-гидроксистероид дегидрогеназы прегненолон трансформируется в прогестерон (рис. 1).
Поскольку прогестерон синтезируется из холестерина, который открывает цепь биосинтеза стероидных половых гормонов и кортикостероидов и содержится повсеместно в клеточных мембранах человека, в том числе в ЦНС, то становятся понятными многогранные эффекты прогестерона на системном, органном, тканевом и локальном уровнях [7].
Классические и неклассические рецепторы прогестерона и его метаболитов
Основной биологический эффект прогестерона осуществляется с помощью классических рецепторов (тип А и тип В), ответственных в основном за геномные эффекты и распространенных во всех отделах головного мозга [5, 8]. Внегеномные эффекты прогестерона осуществляются благодаря его мембранным рецепторам, которые локализуются преимущественно в пре- и постсинаптических отделах нейронов и, предположительно, их взаимодействие с лигандом обеспечивает прямые и быстрые эффекты на синаптическом уровне [9]. Кроме того, данное парасинаптическое расположение экстрагипоталамических рецепторов прогестерона в ЦНС способствует формированию более быстрого ответа на стимул гормона ввиду отсутствия необходимости в прохождении геномного пути реализации соответствующего эффекта [10, 11]. Прогестерон связывается с этими рецепторами с высокой селективностью и сродством, что необходимо для реализации его нейропротекторных свойств [12].
Нейропротекторные свойства прогестерона и аллопрегнанолона
Защитные и трофические эффекты прогестерона и его нейрометаболитов на нервные клетки являются предметом активного изучения. Важнейшим нейрометаболитом прогестерона является аллопрегнанолон, который участвует в метаболических и биохимических процессах головного мозга беременной и развитии нервной системы плода [13]. Важно отметить, что данным метаболитом обладает только натуральный прогестерон. Синтетические гестагены лишены таких производных и, следовательно, не имеют связанных с ними нейропротективных свойств.
В одном из экспериментальных исследований у беременных овец моделировался гипоксический стресс путем пережатия пуповинной артерии. При этом концентрация аллопрегнанолона в головном мозге их плодов значительно повышалась в сравнении с первоначальным уровнем, что свидетельствует о его непосредственном участии в защитных процессах нервной ткани при гипоксических состояниях. При введении ингибитора синтеза аллопрегнанолона уровень гормона в мозге снижался, а количество погибших нервных клеток в результате ишемии значительно увеличивалось. Это позволило предположить, что резкое снижение уровня аллопрегнанолона может способствовать повышенной уязвимости головного мозга к различным видам повреждений [14]. В результате экспериментальных исследований было установлено, что аллопрегнанолон снижал объем зоны ишемии головного мозга у особей как с сохраненной, так и с подавленной экспрессией прогестероновых рецепторов [15, 16].
Психофармакологические свойства аллопрегнанолона (анксиолитическое, антидепрессивное, анестетическое, противосудорожное, болеутоляющее) обусловлены его воздействием на ГАМК (γ-аминомасляная кислота) рецепторы нервных клеток и влиянием на нейрональную возбудимость [17–20].
В последнее время внимание ученых привлекает роль прогестерона и аллопрегнанолона в процессе миелинизации нервных волокон, пролиферации и дифференцировке нервных клеток. Кроме того, аллопрегнанолон участвует в созревании нервных клеток после рождения, способствует дальнейшей миелинизации нервных волокон, что является непрерывным продолжением процесса формирования нервной системы [7]. Миелинизация в ЦНС человека начинается во втором триместре внутриутробного развития. В это время головной мозг плода подвергается влиянию больших концентраций прогестерона и его нейрометаболитов. Уровень циркулирующего прогестерона снижается сразу после рождения и остается на достаточно низком уровне до конца пубертатного периода [21]. Однако в течение первых двух недель жизни концентрация прогестерона преобладает над всеми остальными стероидными гормонами [22]. В это время происходит активный синтез прогестерона и аллопрегнанолона в головном мозге, где наблюдаются их аутокринные и паракринные механизмы действия [7]. При проведении экспериментов на самцах крыс было установлено, что концентрация прогестерона и аллопрегнанолона в головном мозге выше, чем в плазме крови, что может свидетельствовать о непосредственном участии этих гормонов в созревании нервных клеток [16], что крайне важно в формировании ЦНС в целом.
Значение синтеза прогестерона и аллопрегнанолона в головном мозге было изучено на различных животных моделях в неонатальном периоде. Полученные результаты показали, что прогестерон опосредованно через внутриклеточные прогестероновые рецепторы (ПР), а аллопрегнанолон – через ПР-независимые пути (в основном действуя через ГАМК-рецепторы) способствуют созреванию и дифференцировке нейронов, стимулируют формирование дендритов и синаптических контактов между ними, оказывают трофическое влияние на клетки ЦНС [13,16].
Аллопрегнанолон продемонстрировал нейропротекторный эффект в период развития головного мозга в эксперименте на мышах с моделированной болезнью Ниманна–Пика типа C, при которой нарушается внутриклеточный транспорт ганглиозидов холестерина и других липидов, и, соответственно, нарушается синтез стероидных нейрометаболитов [23]. У животных с проведенной заместительной терапией аллопрегнанолоном наблюдалось значительное снижение количества погибших нервных клеток и лучшие неврологические исходы в сравнении с мышами, находившимися без аллопрегнанолоновой гормональной поддержки [24]. Это исследование в очередной раз продемонстрировало важную нейропротекторную роль прогестерона и его метаболитов при развитии ЦНС.

Роль прогестерона и его метаболитов в формировании ЦНС плода
Развитие головного мозга человека идет под постоянным воздействием прогестерона и его метаболитов: 5α-дигидропрогестерона и аллопрегнанолона, которые играют ключевую роль в защите незрелых клеток ЦНС и нервного волокна [19, 21, 25]. Прогестерон и его нейрометаболиты играют фундаментальную роль в формировании и функционировании ЦНС плода [25–27]. Прогестерон стимулирует рост дендритов, соматогенез, спиногенез, а также увеличение конуса роста аксона в незрелых нейронах [28]. Прогестерон и его метаболит аллопрегнанолон снижают вазогенный и цитотоксический отек мозга, оказывают благотворное воздействие на гематоэнцефалический барьер и функции внутричерепного давления, влияют на производство ряда воспалительных цитокинов, увеличивают экспрессию антиоксидантных ферментов, ограничивают глиоз и апоптоз. На фоне применения прогестерона улучшается когнитивное и поведенческое восстановление [29–31]. При этом прогестерон и аллопрегнанолон оказывают эффекты не только через классические ядерные ПР-рецепторы, но и опосредованно через неклассические сигнальные пути (рис. 2).
Действие метаболитов прогестерона на аффективное и социальное поведение осуществляется через ГАМК, глутамат, и дофаминовые рецепторы [27].
Существуют убедительные данные о том, что недостаточный уровень данных стероидов в ЦНС новорожденного при ранних преждевременных родах ведет к нарушению нейрогенеза с задержкой психомоторного и умственного развития, а иногда – к развитию серьезных неврологических заболеваний, в том числе церебрального паралича [25, 26]. В связи с этим в настоящее время активно изучается заместительная прогестероновая поддержка у недоношенных детей. Так, в 2012 году было проведено клиническое исследование с участием младенцев, рожденных до 29 недель беременности с экстремально низкой массой тела, с целью определения влияния прогестероновой заместительной поддержки на неврологические исходы. Одна группа детей получала поддерживающую дозу прогестерона, а другая – плацебо. При достижении детьми 5-летнего возраста исследуемая группа прогестерона показала лучшие когнитивные и неврологические результаты: у них был ниже риск развития церебрального паралича, проявления мышечной спастичности и аметропии [21]. Тем не менее, до сих пор данный вид нейропротекторной гормональной терапии не применяется в практическом здравоохранении. Однако, ввиду особой актуальности проблемы преждевременных родов, не вызывает сомнений необходимость данного направления научного поиска.
Физиологическая роль прогестерона в половой дифференцировке плода
Натуральный прогестерон является субстратом для раннего тестикулярного синтеза тестостерона у плодов мужского пола, который начинается с 6–7-й недели беременности и достигает пика к 12–16-й неделе [32]. Установлена роль прогестерона в половой дифференцировке головного мозга плода. Так, экспериментальные исследования продемонстрировали, что распространенность прогестероновых рецепторов в головном мозге во многом определяет дальнейшую половую дифференцировку [33]. Важно отметить значительную экспрессию прогестероновых рецепторов в ЦНС плодов мужского пола и практически их отсутствие в ЦНС плодов женского пола, что, возможно, определяет дальнейшую дифференцировку сексуального поведения [34].
Влияние нейрометаболитов прогестерона на процессы миелинизации и ремиелинизации
Трудно переоценить роль прогестерона и аллопрегнанолона в процессах миелинизации и формировании белого вещества головного и спинного мозга. В центральной нервной системе аксоны окружаются миелинизированными олигодендроцитами, способствующими быстрому проведению нервного импульса, а также обеспечивающими трофическую функцию нейронов, необходимую для сохранения целостности нейрональной сети. У человека созревание и дифференцировка олигодендроцитов начинается во втором триместре беременности и продолжается длительное время после рождения [25]. Таким образом, формирование белого вещества является довольно длительным и сложным процессом. Во время образования и созревания белое вещество ЦНС довольно чувствительно к повреждающим факторам, особенно в диапазоне от 23 до 32 недель внутриутробного развития. Основной формой повреждения белого вещества головного мозга у недоношенных является перивентрикулярная лейкомаляция, которая лежит в основе развития церебрального паралича [35]. Главными повреждающими факторами при данной патологии являются непосредственно преждевременные роды, внутриутробная инфекция, гипоксические состояния, воспалительные процессы. Во время всего периода развития, когда белое вещество нервной системы наиболее уязвимо, в нем преобладают незрелые олигодендроциты [25, 36]. Повреждающие нейротоксические факторы задерживают развитие и дифференцировку клеток предшественников олигодендроцитов, что ведет к нарушению процесса миелинизации нервных волокон, повреждению белого вещества мозга и развитию неблагоприятных неврологических последствий [25, 37].
Исследование, проведенное на животных моделях, показало важное защитное свойство и прогестерона, и его метаболитов в процессе миелинизации и созревании олигодендроцитов. Данные были получены при изучении гистологических срезов мозжечков мышей. При этом в случае применения прогестерона у мышей наблюдалось умеренное повышение скорости миелинизации нервных волокон [35]. Аллопрегнанолон стимулирует митогенную клеточную активность предшественников олигодендроцитов посредством аутокринных сигнальных механизмов. При этом сами преолигодендроциты синтезируют прогестерон и аллопрегнанолон в значительном количестве, что стимулирует их собственную пролиферацию [36, 37]. На дальнейшем этапе созревания и дифференцировки олигодендроцитов, когда наблюдается наибольшая их уязвимость перед повреждающими нейротоксическими факторами, прогестерон стимулирует пролиферацию и дифференцировку клеток посредством ПР-ассоциированных механизмов (рис. 3).
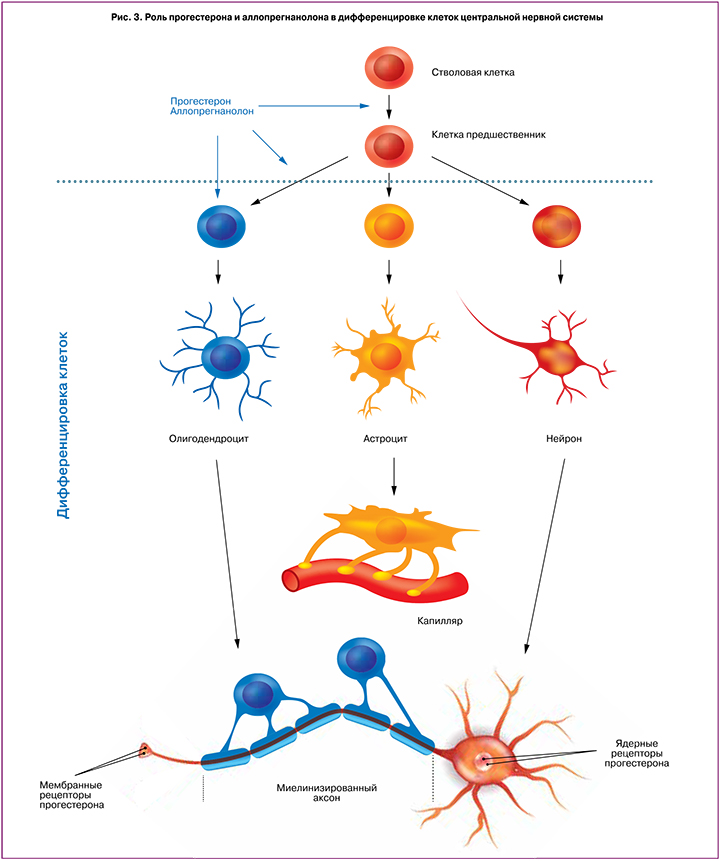
Однако эти полезные свойства прогестерона могут быть утрачены при действии антагониста ПР (мифепристона). В отличие от этого, аллопрегнанолон, действуя опосредованно через ГАМК-рецепторы, по-прежнему не теряет способность проявлять свои защитные свойства [37]. Важная роль прогестерона при созревании предшественников олигодендроцитов была продемонстрирована в эксперименте при повреждении спинного мозга мышей, когда нарушалась дифференцировка, наблюдалась задержка развития нервных клеток и замедлялся процесс миелинизации в белом веществе [17, 38]. Полученные результаты исследования показали, что полное созревание предшественников олигодендроцитов наблюдалось преимущественно у животных, которые получали поддерживающую гормональную терапию прогестероном [17, 39]. Действие прогестерона, а также его нейрометаболитов было не только направлено на процессы пролиферации преолигодендроцитов, но и оказывало положительное влияние на нейроны, астроглию и нейровоспалительный процесс [36, 40].
Подобные данные получены и при экспериментальном аутоиммунном энцефаломиелите у животных: прогестерон оказывает стимулирующее влияние на процесс миелинизации, обладает нейропротекторным, противовоспалительным действием и улучшает неврологические исходы [41]. В другом исследовании при аутоиммунной демиелинизации нервного волокна под воздействием прогестерона и аллопрегнанолона наблюдались процессы восстановительной ремиелинизации, активное возрождение утраченной миелиновой оболочки [42]. Рядом ученых-исследователей были сделаны выводы, что нарушение синтеза прогестерона и аллопрегнанолона в головном мозге может играть ключевую роль в демиелинизации нервных волокон и приводить к развитию рассеянного склероза [43].
Таким образом, прогестерон, действуя на внутриклеточные ПР, и аллопрегнанолон, действуя на ГАМК-рецепторы как в центральной, так и в периферической нервной системе, способствуют процессам миелинизации и ремиелинизации, воздействуя на Шванновские клетки, которые, как и олигодендроциты в ЦНС, выполняют функцию изоляции аксона, и, как следствие, обеспечивают возможность быстрого сальтаторного проведения нервных импульсов [44]. Несколько проведенных исследований в эксперименте показали важную роль прогестерона и аллопрегнанолона в миелинизации и ремиелинизации после повреждения периферических нервных волокон [42].
Прогестероновый дефицит и неврологические исходы
Этиология большинства врожденных неврологических заболеваний до сих пор остается неизвестной. Одним из таких достаточно распространенных заболеваний является аутизм. Ученые всего мира пытаются найти причину аутизма и разработать эффективные меры его профилактики. В результате проведенного исследования появились небезосновательные предположения, что дефицит прогестерона у матери во время беременности может приводить в дальнейшем к развитию аутизма у детей [45, 46]. Наблюдение было проведено на группе детей, страдающих аутизмом, в сравнении с группой здоровых детей. Полученные результаты свидетельствовали, что вероятность развития аутизма у ребенка, рожденного от матери, имевшей больше факторов риска дефицита прогестерона во время беременности, выше по сравнению с теми, кто не имел этих факторов риска. Авторами была выдвинута теория, что, вероятно, низкая концентрация прогестерона во время беременности приводит к морфологическим изменениям в нервной системе, обусловливающим развитие аутизма [46]. Поэтому очень большое значение имеет поддержание определенного нормального уровня прогестерона в течение всей беременности [47].
Заключение
Приведенные в обзоре данные ставят новые вопросы перед специалистами, осуществляющими наблюдение за течением беременности. Во время внутриутробного развития плод подвергается воздействию материнского прогестерона и его метаболитов, в особенности аллопрегнанолона. Ввиду наличия убедительных доказательств можно с уверенностью констатировать, что эти стероидные гормоны не только играют важную роль в развитии и формировании ЦНС, особенно во второй половине беременности, но и оказывают защитные эффекты при неблагоприятных обстоятельствах, в первую очередь при гипоксических состояниях. Снижение нормальных материнских и, следовательно, фетальных концентраций этих нейростероидов во время беременности может оказывать негативное влияние на развитие головного мозга, нервной системы в целом и приводить к неблагоприятным неврологическим исходам. Поддержание достаточного уровня прогестерона в течение всей беременности играет очень важную роль в развитии нервной системы плода.
Не вызывает сомнения важность применения препаратов натурального прогестерона при прогестерон-дефицитных состояниях в аспекте описанных его нейропротекторных свойств, способности влияния на развитие нервной системы плода. При этом использование синтетических гестагенов не обеспечивает всего этого спектра физиологических нейрометаболических эффектов.
Растущий интерес к роли нейростероидов в формировании здорового потомства, экспериментальные и клинические исследования в области нейроэндокринологии открывают перспективы для трансляционной медицины и пересмотра традиционных взглядов на невынашивание беременности и профилактику преждевременных родов как перинатально-акушерскую проблему.



