В настоящее время для профилактики хромосомной патологии наряду с инвазивными методами исследования используют неинвазивный скрининг беременных женщин. Он включает ультразвуковые, биохимические, компьютерные исследования, которые являются безопасными как для матери, так и для плода [2–4, 7, 9, 11, 12].
Вместе с тем эти методы имеют ряд негативных сторон: применение в позднем сроке беременности, возможность получения ложноотрицательных и ложноположительных результатов, затруднения в выявлении некоторых наследственно обусловленных заболеваний, а также в интерпретации полученных данных при многоплодии, угрозе прерывания в сочетании с лекарственной терапией в силу неспецифичности анализируемых сывороточных маркеров крови женщины [1, 6, 8, 10].
В связи в вышеизложенным возникает необходимость изучения роли используемых технологий
в оценке риска аномального потомства.
Целью работы явилось определение диагностической значимости программы пренатальной диагностики с использованием неинвазивных и инвазивных исследований наиболее распространенной хромосомной патологии (синдромов Дауна и Эдвардса) и некоторых мультифакториальных пороков развития эмбриона/плода (дефектов развития невральной трубки) в различные сроки при одноплодной и многоплодной беременностях с нормальным течением и осложненным угрозой прерывания.
Материал и методы исследования
Проведено проспективное обследование 2022 беременных женщин: с одноплодной беременностью в I триместре – 483, во II триместре – 594, в I и II триместрах (в динамике) – 309, в I триместре при угрозе прерывания беременности и применении гормональной терапии – 505 (основная группа) и с нормальным течением беременности в качестве контрольной группы – 78; с многоплодной беременностью в I триместре – 22 и 22 в качестве группы сравнения с одноплодной беременностью и во II триместре – 9 беременных.
Схема обследования была единой и включала в качестве неинвазивных методов ультразвуковое исследование (УЗИ), биохимический скрининг с определением уровней свободной β-субъединицы человеческого хорионического гонадотропина (HCGβ), ассоциированного с беременностью плазменного протеина А (РАРР-А – pregnancy associated plasma protein A) в I триместре; HCG, альфа-фетопротеина, эстриола – во II триместре; компьютерные программы «LIFE CYCLE» в I триместре и «PRISCA» – во II триместре беременности. В качестве инвазивных методов использовали хориоцентез, плацентоцентез, амниоцентез, кордоцентез [2, 5].
Оценку результатов осуществляли с помощью компьютерной программы Excell; чувствительность, специфичность и ложноположительные результаты рассчитывали по формулам.
Результаты исследования и обсуждение
При обследовании 483 женщин в I триместре беременности были выделены 2 группы: с низким (323) и высоким (160) риском рождения ребенка с хромосомной патологией. В группе низкого риска при УЗИ особенностей фенотипа эмбриона не выявлено. Изменения уровней сывороточных маркеров были у 130 женщин. Пренатальная диагностика кариотипа эмбриона была проведена по желанию у 77 женщин. Ни у одной из них, так же как и у остальных из этой группы по исходам беременности, не выявлена трисомия 21-й или 18-й хромосомы (табл. 1).
Таблица 1. Число обследований в I и/или II триместрах беременности с помощью неинвазивных и
инвазивных методов пренатальной диагностики.
В группе из 160 женщин высокого риска у 81 были изменения сывороточных маркеров и у 88, по результатам УЗИ, отмечены особенности фенотипа эмбриона. При пренатальной диагностике кариотипа в 92 наблюдениях и изучении исхода у остальных женщин этой группы у 4 установлен синдром Дауна. Обращало внимание, что все эти эмбрионы имели увеличенные размеры воротниковой области от 3 до 4 мм при нормальных уровнях сывороточных маркеров в крови женщин. Высокий риск хромосомной патологии 1:130 – 1:5 был обусловлен увеличением размеров воротниковой области эмбриона (табл. 2).
Таблица 2. Результаты обследования женщин группы высокого риска при наличии хромосомной
патологии эмбриона/новорожденного.
Так же как в I триместре 594 женщины, обследованные во II триместре беременности, были разделены на 2 группы: 259 составили группу низкого риска и 335 – высокого. Ни у одной из женщин группы низкого риска не было изменений сывороточных маркеров. Фенотип и кариотип плода были нормальными (табл. 1).
В группе высокого риска особенности фенотипа плода, по данным УЗИ, были выявлены у 71 женщины (атрезия 12-перстной кишки, порок развития центральной нервной системы, порок сердца, омфалоцеле, гигрома шеи, диафрагмальная грыжа, гидронефроз), отклонения от нормативных показателей сывороточных маркеров обнаружены в 293 наблюдениях (табл. 1). Хромосомная патология плода, по результатам цитогенетического анализа соответствующая синдрому Дауна и синдрому Эдвардса, была выявлена в 17 наблюдениях – 12 и 5 соответственно, причем у 7 женщин молодого возраста – до 35 лет (табл. 1). Аномалии фенотипа были отмечены у 12 из 17 плодов с хромосомной патологией. Отклонения от нормативных уровней сывороточных маркеров в периферической крови выявлены у 16 женщин.
Результаты, полученные при обследовании женщин в разные сроки беременности с учетом рассчитанных чувствительности, специфичности и частоты ложноположительных значений, были
неоднозначны и не позволили сделать заключение о диагностической значимости неинвазивного
скрининга в зависимости от триместра (табл. 1). В связи с этим было решено провести обследование в I и II триместрах беременности, т.е. в динамике.
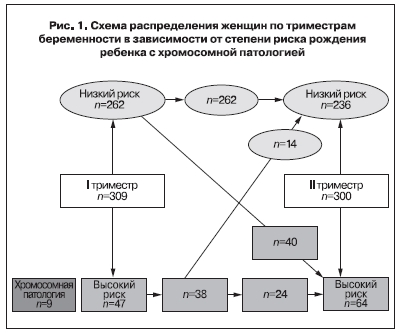
В I и II триместрах беременности, т.е. в динамике, обследованы 309 женщин. На основании результатов неинвазивной пренатальной диагностики все женщины были разделены на две группы: с низким и высоким риском рождения ребенка с хромосомной патологией (рис. 1).
В I триместре беременности, по данным компьютерной программы, группу низкого риска составили
262 женщины, высокого риска – 47. Во II триместре беременности низкий риск установлен у 236 женщин, в том числе у 14, имевших высокий риск в I триместре (рис. 1).
Патология кариотипа плода в I триместре беременности в группе женщин высокого риска выявлена в 9 наблюдениях. Подробные сведения о них представлены в табл. 3.
Таблица 3. Патология кариотипа эмбриона в I триместре беременности.
Из табл. 3 видно, что практически у всех женщин при УЗИ было отмечено увеличение размеров воротниковой области эмбриона, что и обусловило высокий риск хромосомной патологии. Только одна женщина 42 лет имела нормальные показатели ультразвукового и биохимического скринингов. Высокий риск у нее был обусловлен возрастным фактором.
Во II триместре беременности, особенностей фенотипа плода при эхографии, которые могли бы служить маркерами возможной хромосомной патологии, не отмечено. Патологии кариотипа плода ни в одном наблюдении не выявлено.
В результате проведенного комплексного обследования 31 женщины с многоплодной беременностью было установлено следующее. В I триместре беременности у 10 из 22 женщин один из эмбрионов имел особенности фенотипа: 9 – увеличение размеров воротниковой области от 3 до 5 мм и один – порок развития невральной трубки (отсутствие эхографических признаков костей свода черепа) (табл. 4).
Таблица 4. Результаты обследования беременных с многоплодием в I триместре (n=22).
Изменения уровней сывороточных маркеров, обусловленные в основном повышением уровня РАРР-А,
выявлены у 16 женщин (табл. 4). По результатам биохимического скрининга, показатели МоМ при многоплодной беременности находились в пределах 0,6–5,1 для HCGβ (среднее значение 1,5) и 0,7–6.1 для PAPP-A (среднее значение 2,6). При одноплодной беременности в группе сравнения эти показатели соответствовали для HCGβ 0,2–5,3, среднее – 1,2 и для PAPP-A 0,2–2,4, среднее – 1,09 соответственно.
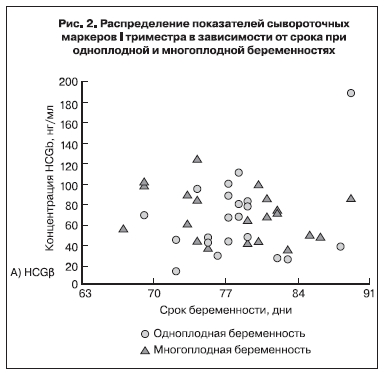
На рис. 2 представлено распределение показателей сывороточных маркеров I триместра в зависимости от срока при многоплодной и одноплодной беременностях. Как следует из представленных на рис. 2 данных, на уровень HCGβ плодность не оказывает влияния, тогда как показатели PAPP-A при многоплодии возрастают. При статистической обработке данных различия показателей сывороточных маркеров в крови женщин при одноплодной и многоплодной беременностях были недостоверны для HCGβ (при одноплодной беременности M±m=1,25±0,126,
при многоплодной – M±m=1,54±0,666, p<0,132) и достоверны для PAPP-A (при одноплодной беременности – M±m=1,098±0,128, при многоплодной – M±m=2,62 ±0,225, p<0,0001).
При определении степени риска рождения больного ребенка, по данным компьютерного анализа, на его повышение оказывали влияние или возраст женщины, или увеличение размеров воротниковой области эмбриона: высокий риск хромосомных нарушений установлен у всех женщин старше 35 лет и во всех наблюдениях при увеличении воротниковой области эмбриона, независимо от возраста женщины или показателей сывороточных маркеров.
Корреляция между показателями сывороточных маркеров, высоким риском хромосомных нарушений
по компьютерной программе и патологией кариотипа не обнаружена. Цитогенетическое обследование 44 эмбрионов (основная группа) и 22 (группа сравнения) позволило выявить у 2 из них (в основной группе) патологию кариотипа – трисомию 21 и трисомию 18 (табл. 4). Обе женщины были в возрасте до 35 лет. В обоих наблюдениях, по данным компьютерного анализа, был высокий риск хромосомной патологии (1:5), обусловленный увеличением размеров воротниковой области эмбрионов до 3 и 5 мм. На основании полученных результатов была проведена селективная редукция аномальных эмбрионов.
Во II триместре беременности были обследованы 9 женщин с многоплодием (в том числе 2 тройни). По данным УЗИ, особенностей фенотипа плодов не выявлено. Показатели сывороточных маркеров были в пределах референсных значений, разработанных для одноплодной беременности. По результатам компьютерной диагностики, все женщины имели высокий возрастной риск рождения ребенка с трисомией 21-й хромосомы. В связи с высоким риском была проведена инвазивная цитогенетическая диагностика. Кариотипы всех плодов были нормальными.
Обследованы 505 женщин с течением беременности, осложненным угрозой прерывания (кровянистыми выделениями из половых путей и наличиегематом, по данным УЗИ), которые с целью терапии получали гестагенные и/или глюкокортикоидные препараты, и 78 женщин с нормально протекающей беременностью в качестве группы сравнения.
В контрольной группе отклонения концентраций сывороточных маркеров от нормативного диапазона выявлены у 36 женщин. Однако риск рождения ребенка с хромосомной патологией, рассчитанный с
помощью компьютерной программы, был установлен только у 3 (3,8%) женщин. У всех этих женщин при УЗИ было отмечено увеличение размеров воротниковой области эмбриона свыше 2 мм. При исследовании кариотипа эмбрионов патологии не выявлено.
Из 505 обследованных женщин у 171 (33,8%) были отклонения анализируемых показателей: увеличение размеров воротниковой области эмбриона (свыше 2 мм) – у 33, изменения показателей сывороточных маркеров – у 125, сочетанные нарушения – у 13. Согласно данным компьютерного анализа, 37 (7,3%) пациенток, имеющих риск наличия у эмбриона синдрома Дауна, были выделены в группу риска. Из 37 женщин у 32 (86,0%) размеры воротниковой области эмбриона превышали 2 мм и у 5 были изменения в показателях биохимического скрининга. Частота отклонения концентраций сывороточных маркеров от нормативного диапазона у женщин основной и контрольной групп была достаточно высокой. Достоверных различий, согласно результатам статистической обработки, между группами не выявлено. Установлено статистически значимое увеличение частоты высокого риска хромосомной патологии в основной группе по сравнению с контрольной за счет увеличения размеров воротниковой области эмбриона.
При цитогенетическом исследовании у одного эмбриона с величиной воротниковой области 4,5 мм
была диагностирована хромосомная патология, соответствующая синдрому Дауна. Риск оценивался как
1:5. Беременность протекала без угрозы прерывания на фоне приема утрожестана и дексаметазона. В связи с наличием у эмбриона синдрома Дауна беременность была прервана. Остальные 504 женщины родили детей без хромосомных аномалий.
Помимо изучения основной группы в целом, проанализированы показатели с учетом приема гестагенов или глюкокортикоидов. На рис. 3 в графическом изображении представлены полученные результаты.
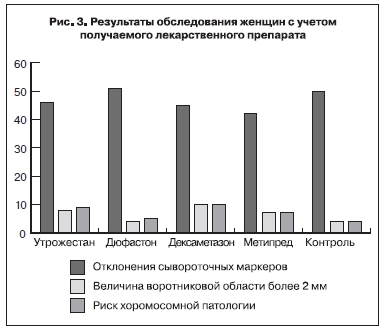
Частота отклонения концентраций сывороточных маркеров от нормативного диапазона у женщин основной группы, принимавших метипред, составила 41,4%, принимавших дюфастон – 51,8%. В контрольной группе этот показатель составил 46,1%. По результатам статистической обработки,
достоверных различий не выявлено. Значимость различий категориальных данных оценивали с
помощью χ²-теста с принятием уровня достоверности р<0,05 (статистическая программа Epi Info v. 6). В то же время выявлено статистически значимое отличие частоты высокого риска хромосомной патологии в основной группе: от 5,9% (прием дюфастона) до 10,1% (прием дексаметазона) по сравнению с контрольной – 3,8%. Обращает на себя внимание тот факт, что частота высокого
риска практически полностью совпадает с частотой увеличения воротниковой области эмбриона.
Поскольку число наблюдений с этим эхографческим признаком в контрольной группе было минимальным, то и частота высокого риска в этой группе была низкой.
Заключение
На основании полученных результатов были сформулированы некоторые положения обследования
беременных женщин с использованием скринирующих программ.
С помощью неинвазивных методов среди беременных можно выделить группу риска по рождению
аномального ребенка и, таким образом, расширить показания к пренатальной диагностике.
Основное значение в формировании группы высокого риска по рождению ребенка с хромосомной
патологией и пороками развития невральной трубки имеют ультразвуковые маркеры.
При обнаружении особенностей фенотипа эмбриона/плода необходима инвазивная пренатальная
диагностика.
При выявлении высокого риска рождения ребенка с хромосомной патологией в I триместре беременности необходимо определить кариотип эмбриона, не дожидаясь результатов II триместра; обследование во II триместре беременности следует выполнять только при отсутствии его в ранние сроки.
При многоплодной беременности проведение биохимического скрининга нецелесообразно, так как
трактовка полученных результатов затруднительна, следует ориентироваться только на возраст женщины и наличие УЗ-маркеров патологии эмбриона/плода.
Применение гормональной терапии при осложненном течении беременности не влияет на показания к
проведению инвазивной пренатальной диагностики.
Ни один из использованных неинвазивных подходов к диагностике хромосомной патологии эмбриона/плода не обладает абсолютной специфичностью, решающее значение имеют только инвазивные методы.



