Проблема гиперпластических процессов эндометрия (ГПЭ) имеет важное клиническое значение [1, 2].
Высокая частота встречаемости ГПЭ, отсутствие должной эффективности от гормональной терапии, а также вероятность их озлокачествления ставит ГПЭ в ряд наиболее актуальных проблем современной медицины.
Часто имеют место диагностические расхождения между клинико-анамнестическими данными, гистероскопической картиной и результатами патоморфологического исследования соскобов эндометрия [3].
Затруднение верификации хронического эндометрита, сочетающегося с гиперплазией эндометрия (ГЭ), не исключает пересмотра традиционного подхода к лечению и нуждается в уточнении. Изучение морфологических особенностей сочетания ГПЭ и хронического эндометрита, выраженности пролиферативной активности, особенностей характера васкуляризации и рецептивности эндометрия позволяет раскрыть новые патогенетические аспекты при сочетанной патологии матки [4]. Это особенно важно для проведения профилактики и эффективной терапии.
Целью настоящего исследования стало изучение молекулярно-биологических особенностей при различных вариантах гиперпластических процессах эндометрия.
Материалы и методы исследования
Проведено проспективное исследование, в которое были включены 1490 пациенток, находившихся на стационарном лечении с 2004 по 2011 гг. в гинекологических отделениях ГКБ № 14 им. В.Г. Короленко и ГКБ № 40. После обследования всем пациенткам проводилось раздельное диагностическое выскабливание матки под контролем гистероскопии. В зависимости от результатов гистологического исследования соскобов были сформированы две группы. Основная группа – 620 женщин с подтвержденным гистологически гиперпластическим процессом эндометрия. Группа сравнения – 870 пациенток, у которых по данным морфологического исследования не было выявлено патологии в эндометрии.
На заключительном этапе исследования после комплексного иммуноморфологического исследования были сформированы пять основных групп: I группа – 248 женщин с простой гиперплазией эндометрия без атипии, II группа – 94 пациентки со сложной гиперплазией эндометрия без атипии, III группа – 42 пациентки с простой и сложной гиперплазией эндометрия с атипией, IV группа – 142 пациентки с гиперпластическими процессами эндометрия в сочетании с хроническим эндометритом (ХЭ), V группа – 94 женщины с хроническим эндометритом и реактивной гиперплазией эндометрия.
Критерии включения пациенток в исследование: перименопаузальный период, отсутствие онкологических заболеваний, отсутствие эндокринной патологии (сахарный диабет, гипо- и гипертиреоз, ожирение II–III ст.), отсутствие острого воспалительного процесса органов малого таза. В исследование не были включены пациентки с полипами эндометрия, миомой матки больших размеров и с субмукозной локализацией миоматозных узлов, аденомиозом II–III ст.
Показаниями к госпитализации пациенток в стационар были: маточные кровотечения различного характера и/или наличие эхографических признаков патологии эндометрия.
Комплексное обследование женщин включало сбор анамнеза, оценку соматического статуса, менструальной и репродуктивной функции.
Морфологическое исследование проводили в Московском городском центре патологоанатомических исследований при Городской клинической больнице № 14 им. В.Г. Короленко и кафедре патологической анатомии ГБОУ ВПО Московский государственный медико-стоматологический университет Минздрава России (руководитель центра и зав. кафедрой – проф. О.В. Зайратьянц). Иммуноморфологические исследования уровней продукции фермента лизилоксидазы (LOX), белков сурвивина и его антагониста SMAC проводили в Институте биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН (руководитель – д.х.н. М.И. Шахпаронов). Материалом для морфологического исследования были соскобы эндометрия, полученные при раздельном диагностическом выскабливании матки.
Использовали иммунопероксидазный и иммунофлуоресцентный методы исследования и 14 первичных специфических моно- и поликлональных антител (производства DAKO, UK, Germany и Lab Vision, USA) к следующим антигенам: маркеру пролиферирующих клеток, ядерному белку Ki-67, Всl-2, ингибитору апоптоза, Вах, индуктору апоптоза, сосудисто-эндотелиальному фактору роста (VEGF, клон G153-694), трансформирующему фактору роста – β1 (TGFβ1), фибронектину. иммуноглобулинам М (IgM), иммуноглобулинам G (IgG). Экспрессию LOX- компонента внеклеточного матрикса определяли с помощью иммуногистохимического исследования, которое проводилось методом непрямой иммунофлуоресценции с использованием специфических поликлональных антител к лизилоксидазе на парафиновых срезах. Уровень продукции белка – ингибитора апоптоза – сурвивина (митохондриальная форма) и его антагониста – белка SMAC определяли в тех же образцах эндометрия. Использовали лизаты полученного тканевого материала, взятие которого производили согласно стандартной процедуре. Образцы лизатов хранили при температуре от –20 до –80°С в течение 4 суток в условиях отсутствия микробной контаминации. Образцы подвергали замораживанию-оттаиванию только однократно. После размораживания образцы тщательно перемешивали. Не использовали образцы с повышенным содержанием липидов и с признаками бактериального зароста. В данной работе для исследования образцов эндометрия был использован диагностический набор «Пептосурвим».
Результаты исследования и обсуждение
Результаты гистологического исследования, которое проводились двумя независимыми патологами, показали низкую воспроизводимость действующей классификации ВОЗ. Кроме того, были отмечены трудности в морфологической дифференциальной диагностике сочетания признаков простой гиперплазии и хронического эндометрита. Дифференциальная диагностика этих заболеваний не представляется возможной без тщательного анализа клинико-лабораторных данных и проведения иммуноморфологического исследования с выявлением диагностических критериев.
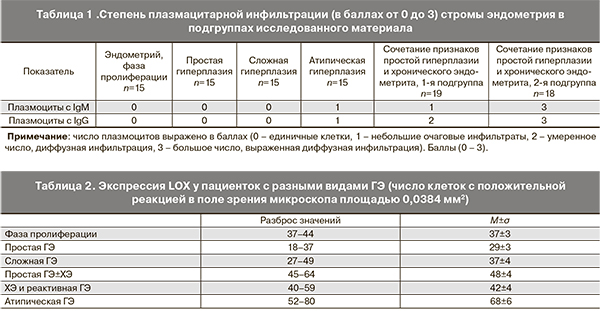
Результаты проведенного иммуноморфологического исследования по выявлению плазмоцитов, продуцирующих IgM и IgG, показали, что их количество крайне мало в неизмененном эндометрии в фазе пролиферации, а также при простой и сложной типической гиперплазии эндометрия (табл. 1). При атипической гиперплазии в строме появлялись небольшие группы плазмоцитов, продуцирующие как IgM, так и IgG, но в целом их число оставалось незначительным.
Наличие очаговых скоплений плазмоцитов, вырабатывающих как IgM, так и IgG, а также гистологические признаки простой гиперплазии, и умеренно выраженного хронического воспаления позволило сделать вывод, что у таких пациенток простая гиперплазия осложнилась развитием реактивного воспаления, со временем приобретшего черты хронического эндометрита. Следовательно, речь идет о простой гиперплазии эндометрия, осложненной ХЭ.
Диффузная плазмоцитарная инфильтрация стромы эндометрия, со значительным преобладанием в инфильтрате плазмоцитов, продуцирующие IgG, с гистологически выраженным перигландулярным склерозом стромы и мономорфным видом желез, доказывает принадлежность таких наблюдений к ХЭ, а изменения желез, сходные с ПГ, являются реактивными изменениями эпителия.
Комплексное иммуногистохимическое исследование позволило дать характеристику ключевых молекулярно-биологических особенностей простой и сложной ГЭ с атипией и без нее и представить их профиль (диаграмма 1, см. на вклейке).
В отличие от женщин группы сравнения (0,4±0,06), у пациенток с простой и сложной (без атипии) гиперплазией эндометрия уровень сурвивина достоверно повышен, практически в 2 раза (0,8±0,02 и 0,76±0,046 соответственно). При атипической гиперплазии (АГЭ) содержание сурвивина было повышено в 3 раза (1,2±0,1), и его содержание было также достоверно больше контрольных значений и показателей при гиперплазии эндометрия без атипии (р<0,05). В IV и V группах также отмечена гиперсекреция сурвивина (0,92±0,034 и 0,93±0,043), что указывает на глубокие нарушения в регуляции процессов пролиферации и апоптоза клеток эндометрия.
Параллельное исследование продукции антагониста сурвивина – белка SMAC показало, что его концентрация при изученных патологических процессах статистически достоверно не меняется, в том числе и по сравнению с контрольными наблюдениями (р>0,05).
Полученные данные об экспрессии других маркеров апоптоза – Bcl-2 и ВАх позволяют предположить, что процессы апоптоза подавлены уже при простой и сложной ГЭ без атипии и значительно угнетаются при атипической ГЭ.
Результаты иммуногистохимического исследования маркера пролиферации показали, что экспрессия Ki-67 ГЭ без атипии снижена в эпителиальном и стромальном компонентах, что свидетельствует об отсутствии активации процессов пролиферации. Сниженный уровень экспрессии VEGF в этих же группах свидетельствует о недостаточной активности процессов ангиогенеза в растущей ткани эндометрия и наряду с тромбозом сосудов является причиной его очаговой ишемии. Повышенная продукция ТGFβ1 при угнетенном апоптозе сдерживает пролиферативную активность и дает возможность предположить, что ГЭ без атипии на данном этапе остается подконтрольным процессом и после лечения или даже самостоятельно может регрессировать (диаграмма 2, см. на вклейке).
Экспрессия фибронектина была минимальна и равномерно выражена при простой и сложной гиперплазии эндометрия без атипии (рис. 1–2 см. на вклейке) . Достоверных различий в продукции и накоплении LOX нами выявлено также не было, что еще раз подтверждает схожесть морфологических и иммуногистохимических изменений при данных патологических состояниях и предопределяет однонаправленную тактику ведения (табл. 2).
Таким образом, простая и сложная гиперплазия эндометрия без атипии схожи по молекулярно-биологическим параметрам, а уровень апоптоза при данных патологических состояниях позволяет в достаточной мере нивелировать пролиферативные процессы.
Молекулярно-биологическими прогностически неблагоприятными факторами развития неоплазии в наших исследованиях были: высокая пролиферативная активность стромального компонента (Ki-67), угнетение процесса апоптоза (гиперэкспрессия белков ингибитора апоптоза сурвивина и Bcl-2), активация ангиогенеза (высокая экспрессия VEGF), усиленное склерообразование (продукция и накопление ТGFβ1, фибронетина, LOX). Эти молекулярно-биологические особенности были характерны для пациенток с атипической гиперплазией эндометрия и при сочетании ГЭ с хроническим воспалительным процессом (диаграмма 3, рис. 3–4, см. на вклейке).
Таким образом, резюмируя особенности экспрессии исследуемых нами молекулярно-биологических маркеров, следует отметить следующее.
На начальных этапах формирования патологических процессов в эндометрии имеет место тенденция к снижению уровня апоптоза и усилению активности процессов склерозирования (повышенный уровень TGFβ1) как в эпителии желез, так и во внеклеточном матриксе, что было характерно для пациенток с простой и сложной гиперплазией без атипии.
На ранних стадиях прогрессии патологического процесса отмечается угнетение апоптоза, в ЭЦМ имеют место активно идущие процессы стромообразования и неоангиогенеза (высокая продукция и накопление LOX, фибронектина,VEGF, TGFβ1), что характерно для пациенток с наличием хронического эндометрита в сочетании с простой гиперплазией эндометрия и реактивной гиперплазии.
Белки ингибиторы апоптоза – сурвивин и Bcl-2 – более активно экспрессируются при наличии хронического воспалительного процесса и появлении клеточной атипии, что может указывать на их участие в процессах злокачественной трансформации клеток и значение в процессах инвазивного роста.
Результаты проведенного исследования показали, что при атипической гиперплазии эндометрия и хроническом воспалительном процессе имеет место гипоксическое поражение ткани эндометрия, то есть гипоксия является важным компонентом патогенеза развития данного заболевания. Гиперпродукция ТGFβ1 может рассматриваться как причинный фактор развития гипоксии, а ее следствием является повышение индукции LOX и стимуляция ангиогенеза вследствие высокой экспрессии VEGF. Сам процесс хронического воспаления может быть решающим фактором развития гипоксии, а гипоксия, в свою очередь, индуцирует опухолевую прогрессию путем промоции ангиогенеза и увеличения количества клеток, содержащих LOX не только в цитоплазме, но и в строме.
Таким образом, молекулярно-биологический профиль при сочетании ГПЭ и хронического эндометрита указывает на повышенную пролиферативную активность клеток ЭЦМ, интенсивную экспрессию факторов роста, активацию процессов склерозирования и ангиогенеза, что доказывает роль воспалительного фактора в формировании оптимальных условий для опухолевой трансформации ткани эндометрия.