На протяжении долгого времени полость матки считалась стерильной, а основными барьерами, препятствующими ее контаминации бактериями из влагалища, были шейка матки и цервикальная слизь [1]. По мере развития науки и внедрения современных методов лабораторной диагностики концепция стерильности эндометрия была пересмотрена. С середины 1980-х гг. проведено множество исследований, посвященных изучению и уточнению состава внутриматочной микробиоты в норме и при различных патологических состояниях [2].
Микробиом эндометрия принято рассматривать как совокупность разнообразных микроорганизмов, включающих более 20 родов бактерий: Lactobacillus, Staphylococcus, Enterococcus, Micrococcus, Schlegelella, Delftia, Gardnerella, Burkholderia, Prevotella, Sphingobacterium, Vagococcus, Megasphaera, Ralstonia, Hydrogenophaga, Cloacibacterium, Limnohabitans, Dietzia, Atopobium, Sediminibacterium, Rothia, Exiguobacterium [3, 4]. В зависимости от соотношения микроорганизмов биоценоз полости матки может быть классифицирован на вариант с доминирующей лактобациллярной флорой (содержание лактобацилл превышает 90% всех других микроорганизмов) и с не доминирующей лактобациллярной флорой (в полости матки присутствует >10% бактерий, отличных от Lactobacillus, таких как A. vaginae, G. vaginalis, виды родов Clostridium, Megasphaera, Parvimonas, Prevotella, Sphingomonas, Sneathia) [4].
Состав микробиоты полости матки зависит от концентрации стероидных гормонов, реактивности факторов врожденной и приобретенной иммунной системы, биоценоза влагалища и кишечника. Повышение уровня эстрогенов в преовуляторный период сопровождается усиленной продукцией противомикробных пептидов и снижением уровня противовоспалительных цитокинов, что приводит к уменьшению концентрации условно-патогенных бактерий во влагалище и предотвращает инфицирование полости матки восходящим путем [5, 6].
В настоящее время выделено 4 возможных пути проникновения возбудителей инфекции в полость матки [5].
1. Восходящий путь: в результате нарушения барьерной функции цервикального канала (пассивное инфицирование при манипуляциях на шейке матки и активное инфицирование за счет передвижения бактерий на сперматозоидах и трихомонадах).
2. Лимфогенное и гематогенное инфицирование: за счет распространения возбудителей через систему регионарных микрососудов (травмы эндометрия при манипуляциях и в родах).
3. Нисходящее гематогенное распространение инфекции из экстрагенитальных очагов.
4. Контактное или прямое инфицирование при распространении бактерий из параметральной клетчатки и органов малого таза.
Даже при условии нормоценоза влагалища проведение внутриматочных манипуляций может повышать риск механического занесения бактерий и вирусов в полость матки. Интраоперационно (в связи с травматизацией ткани и временной иммуносупрессией) создаются условия, повышающие вероятность изменения маточного биоценоза и формирования избыточного бактериального роста в эндометрии. Для ряда пациенток это может стать дополнительным фактором, повышающим риски развития эндометрита и ухудшающим прогноз реализации репродуктивной функции.
В связи с этим целью нашего исследования стала модификация риска реализации восходящего инфицирования полости матки при проведении гинекологических процедур путем профилактической медикаментозной санации влагалища.
Материалы и методы
Набор пациенток проводился на базе консультативно-диагностического отделения родильного дома при ГКБ им. А.К. Ерамишанцева Департамента здравоохранения города Москвы в 2022 г. Работа проводилась с использованием когортного проспективного метода. Проверка первичной документации была выполнена на кафедре акушерства и гинекологии лечебного факультета ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
Критерии включения в исследование.
1. Подписанное добровольное информированное согласие на участие в исследовании.
2. Возраст от 20 до 40 лет включительно.
3. Наличие показаний для проведения гистеросальпингографии и диагностической офисной гистероскопии (обследование в программах ВРТ, подозрение на полип эндометрия и внутриматочные синехии).
4. Нормоценоз влагалища по данным микроскопического исследования с окрашиванием по Граму, 1-я степень чистоты.
5. Согласие воздерживаться от любых влагалищных манипуляций в период исследования (половые контакты, спермициды, тампоны, спринцевания, диафрагмы, презервативы).
Критерии невключения в исследование.
1. Любые отклонения по данным микроскопического исследования влагалищного отделяемого (бактериальный вагиноз, вагинит).
2. Беременность.
3. Гиперчувствительность к любому компоненту препарата «Тержинан».
4. Прием системных или местных противогрибковых, антибактериальных, антипротозойных и антисептических препаратов в течение 2 недель до включения в исследование.
5. Применение внутриматочных устройств (содержащих и не содержащих гормональный компонент).
6. Соматические заболевания в стадии суб- и декомпенсации (сахарный диабет, иммунодефицит, ВИЧ-инфекция, заболевания почек и печени).
7. Известная или подозреваемая наркотическая/алкогольная зависимость.
Были сформированы 2 группы, разделенные случайным способом по принципу проведения (основная группа, n=40) и не проведения (группа сравнения, n=40) курса санирующей терапии. В ранее опубликованных исследованиях [7] было показано, что после интраоперационной обработки влагалища раствором хлоргексидина не удается полностью исключить внутриматочную контаминацию вагинальной флорой. В связи с этим нами были продолжены исследования с целью снижения вероятности механического пассивного распространения влагалищной флоры при амбулаторных диагностических процедурах (гистеросальпингография, диагностическая гистероскопия).
Пациентками сформированных групп было осуществлено 2 визита. На первом подписывались информированные согласия, в основной группе проводился забор материала из влагалища для бактериологического исследования и назначался препарат «Тержинан» по профилактической схеме на 6 дней. Препарат представляет собой комплексное лекарственное средство, в состав которого входят тернидазол 200 мг, неомицина сульфат 100 мг, нистатин 100 000 ЕД и преднизолон 3 мг, позволяющие перекрыть весь спектр наиболее распространенных бактерий, занимающих вагинальный биотоп.
На втором визите у пациенток основной группы повторно проводился забор материала из влагалища и первично из полости матки (до проведения манипуляции), у пациенток группы сравнения – первичный забор материала из влагалища и из полости матки (до проведения манипуляции).
Забор материала из влагалища проводился до бимануального исследования и обработки влагалища антисептическими растворами, после введения зеркал Куско. При помощи универсального зонда № 2 получали материал из заднего свода влагалища, помещали его в эппендорф с транспортной средой и в течение 24 часов с соблюдением температурного режима (+4°С) доставляли с лабораторию «Геномед» для проведения молекулярно-биологического исследования методом ПЦР с детекцией результатов в режиме реального времени (ПЦР-РВ) при помощи тест-системы «Фемофлор-16» (ООО «НПО ДНК-Технология»). Далее, после обработки влагалища и шейки матки раствором хлоргексидина при помощи стерильного зонда Pipelle de Cornier, производился забор из полости матки. Полученный аспирационный материал также помещался в эппендорф с транспортной средой и в течение 24 ч доставлялся с лабораторию «Геномед» для молекулярно-биологического тестирования системой «Фемофлор-16» (ООО «НПО ДНК-Технология»).
Количественная оценка биоценоза проводилась в абсолютных и в относительных показателях, которые рассчитывались программным обеспечением приборов для ПЦР-РВ (ДТ96, ДТ322) на основании номера «порогового» цикла. Количество ДНК искомого микроорганизма в образце выражалось в геном-эквивалентах (ГЭ), которое пропорционально количеству микроорганизма.
Статистический анализ
Статистическая обработка результатов проводилась при помощи методов параметрической и непараметрической статистики с использованием программного обеспечения SPSS24. Значимыми принимались различия при p≤0,05.
Результаты
Клиническая характеристика обследованных
Пациентки сформированных групп были сопоставимы по возрасту, паритету и анамнестическим данным. Не было выявлено статистически значимых различий в индексе массы тела, гинекологических и соматических заболеваниях (табл. 1).

Показаниями для проведения гистеросальпингографии и офисной гистероскопии у пациенток основной группы и группы сравнения были бесплодие неясного генеза у 18 (18/40, 45%) и 19 (19/40, 47,5%) (р=0,59), подозрение на полип эндометрия у 21 (21/40, 52,5%) и 17 (17/40, 42,5%) (р=0,08) и внутриматочные синехии у 1 (1/40, 2,5%) и 4 (4/40, 10%) (р=0,05) соответственно.
Результаты микробиологического исследования
При анализе результатов микробиологического исследования оценивалась общая бактериальная масса во влагалищном и в полости матки, качественный и количественный состав микрофлоры.
Показатель общей бактериальной массы во влагалище у пациенток обеих групп не имел статистически значимых различий и составил lg 6,3 и 6,2 ГЭ/образец (р=0,94) (табл. 2).
После проведения санирующей терапии у пациенток основной группы отмечено статистически значимое снижение общей бактериальной обсемененности влагалища до lg 4,8 (Q1–Q3: 4,4–5,05) (р=0,03) (рис. 1, табл. 3).
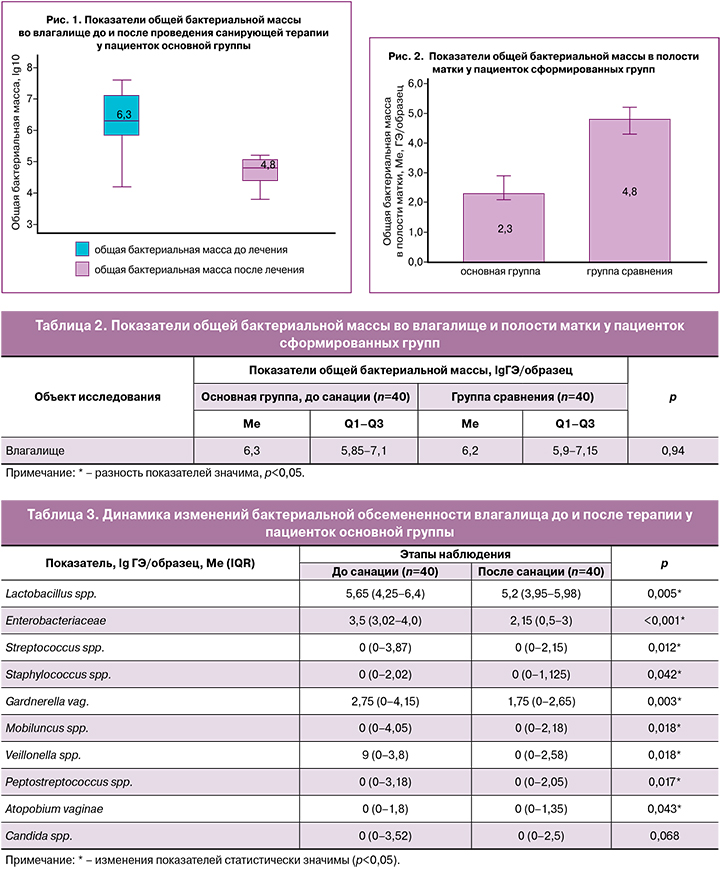
При использовании критерия Уилкоксона было установлено статистически значимое снижение количества всех изучаемых вагинальных бактерий по-сле проведенного санирующего лечения (р<0,05), за исключением грибов рода Candida (р=0,068) (табл. 3).
Общая бактериальная масса в полости матки у пациенток основной группы составила lg 2,3 ГЭ/образец (Ме, IQR 2,05–2,95), а в группе сравнения – lg 4,8 ГЭ/образец (Ме, IQR 4,25–5,2). Была выявлена статистически значимая разница, демонстрирующая, что в группе с проведенной санацией влагалища количество бактерий в полости матки было в 2,1 раза меньше, чем в группе пациенток, которым терапия до процедуры не проводилась (р<0,001) (рис. 2).
При сравнении показателей бактериальной обсемененности полости матки с данными влагалищного биоценоза после проведенной санации были выявлены значимые различия. У 62,5% (25/40) пациенток в полости матки выявлялись только лактобактерии. У 37,5% (15/40) сохранялись представители условно-патогенной флоры в минимальных титрах с преобладанием лактобактерий. По сравнению с их концентрацией во влагалищном биотопе отмечено статистически значимое снижение количества Peptostreptococcus spp., Veilonella spp. и Mobiluncus spp. у 17,5% (7/40) пациенток (р=0,018), у 12,5% (5/40) – Staphylococcus spp. (р=0,043) и Atopobium vaginae (р=0,042), Streptococcus spp. – у 20% (8/40, р=0,012), Gardnerella vaginalis – у 27,5% (11/40, р=0,003) и представителей семейства Enterobacteriaceae – у 35,5% (15/40, р=0,01).
У пациенток группы сравнения состав биоценозов влагалища и полости матки был более разнообразным как по качественному, так и по количественному составу (рис. 3).
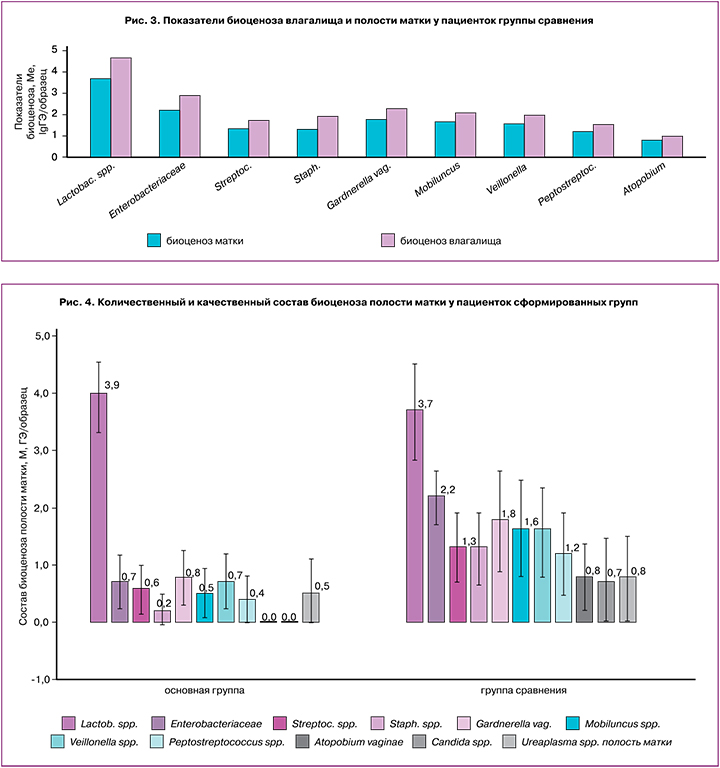
Анализ полученных результатов показал, что у пациенток группы сравнения в полости матки состав микробиоценоза был идентичен влагалищному по качественному составу. Количество Lactobacillus spp., Staphylococcus spp., Veilonella spp. и представителей семейства Enterobacteriaceae статистически значимо снижалось (р<0,001).
Сравнительное исследование состава микробиоценоза полости матки у пациенток сформированных групп выявило значимые различия (табл. 4).
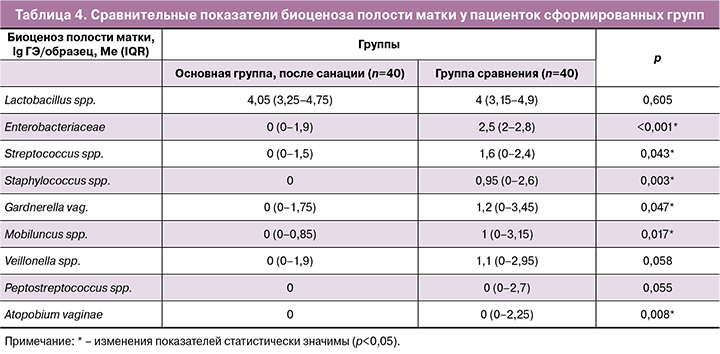
Сравнение показателей биоценоза полости матки у пациенток сформированных групп показало, что после проведения санирующей терапии в полости матки статистически значимо в меньшем количестве встречались практически все изучаемые микроорганизмы, за исключением Lactobacillus spp. (р=0,605), Veilonella spp. (р=0,058) и Peptostreptococcus spp. (р=0,055) (рис. 4).
У всех пациенток основной группы биоценоз полости матки можно было охарактеризовать как лактобациллодоминирующий, так как 98% всех микроорганизмов были представлены Lactobacillus spp. В группе сравнения доминирующий лактобациллярный тип биоценоза был выявлен в 42,5% (17/40), в 57,5% (23/40) случаев был выявлен смешанный тип биоценоза.
Корреляционная связь общей бактериальной массы во влагалище до и после терапии, оцененная с помощью критерия ранговой корреляции Спирмена, была статистически значима (р=0,03; rxy=0,63) и имела заметную тесноту по шкале Чеддока.
Были установлены статистически значимые прямые корреляционные связи общей бактериальной массы во влагалище после терапии с количеством в полости матки Lactobacillus spp. (rxy=0,514; p=0,02) и Gardnerella vaginalis (rxy=0,55; p=0,01). Все выявленные связи имели заметную тесноту по шкале Чеддока.
Обсуждение
В 2007 г. методом секвенирования гена 16S рРНК состав микробиоценоза полости матки был подробно описан [1, 2, 8]. В связи с близким анатомическим расположением влагалища биоценозы полости матки и влагалища в норме приближены по качественному составу, но различаются количественно [9]. Озвучивалось предположение, что трансцервикальный забор материала для изучения внутриматочной флоры не позволяет исключить контаминацию полости вагинальными бактериями и, соответственно, установить истинный состав микробиома. Однако исследования, выполненные путем забора материала из матки после гистерэктомии, подтвердили отсутствие значимых различий в качественном, но не в количественном составе биоценоза эндометрия при различных вариантах получения образцов (трансцервикально или трансабдоминально) [9, 10]. В проведенном нами исследовании даже после асептической обработки влагалища и влагалищной порции шейки матки, при проведении манипуляций не удалось исключить восходящую контаминацию полости матки бактериями из влагалища и цервикального канала. В ранее проведенных исследованиях были получены идентичные результаты [7]. У пациенток, которым исследование проводилось без предварительной санации, в полости матки микробиота была идентична вагинальной по качественному составу, а в группе женщин, которым проводилась санация, микрофлора преимущественно состояла из лактобактерий. В количественном эквиваленте показатели общей бактериальной массы в полости матки были в 2 раза ниже, чем у пациенток без предоперационной санации.
В норме в вагинальном и цервикальном микробиоме преобладают Lactobacillus spp., что определяет состав бактериальной флоры в полости матки и маточных трубах. Немаловажную роль в формировании нормоценоза влагалища и матки играет и микрофлора кишечника, обеспечивающая формирование резистентности слизистых к патогенным микроорганизмам и эффективность работы факторов врожденного и приобретенного иммунитета [11].
Исследование, проведенное Moreno I. et al., показало, что присутствие в полости матки бактерий рода Lactobacillus коррелирует отрицательно с появлением патогенных бактерий и положительно с комменсальными бактериями, отражая стабильность эндометриальной экосистемы [12, 13]. Также было показано, что отсутствие Lactobacillus sp. и наличие таких микроорганизмов, как Atopobium sp., Bifidobacterium sp., Chryseobacterium spp., Gardnerella sp., Streptococcus sp. или Klebsiella sp., в эндометриальной жидкости и/или в биопсии эндометрия связаны с неудачными репродуктивными исходами. Исследование показало, что дисбиотический профиль микрофлоры эндометрия, состоящий из Atopobium sp., Bifidobacterium sp., Chryseobacterium sp., Gardnerella sp., Haemophilus sp., Klebsiella sp., Neisseria sp., Staphylococcus sp., Streptococcus sp. был связан с низким уровнем вынашивания беременности и живорождения [12, 13].
В проведенном нами исследовании были получены схожие результаты. Состав вагинальной и внутриматочной микробиоты у пациенток группы сравнения характеризовался присутствием лактобактерий и разнообразных факультативных анаэробов. В основной группе преобладал доминирующий лактобациллярный тип внутриматочной микробиоты, а общее количество бактерий было в 2 раза меньше, чем в группе сравнения.
В настоящее время в основе развития большинства воспалительных заболеваний органов малого таза, в частности эндометрита, лежит проникновение возбудителей инфекции в полость матки восходящим путем из влагалища. Присутствие в ткани Streptococcus групп А и В, Staphylococcus, E. coli, Klebsiella pneumoniae, Enterococcus, Proteus, Peptostreptococcus, Bacteroides, Prevotella, Clostridium, Gardnerella vaginalis, Ureaplasma urealyticum, Corynebacterium, Pseudomonas aeruginosa, Mycoplasma spp., Saccharomyces и Candida spp. ассоциировано с риском развития острого и хронического воспаления [10, 12–14]. Исследователи пришли к выводу, что колебания в численности микроорганизмов в самом биоценозе матки также могут приводить к развитию патологических изменений.
Заключение
Проведение мероприятий, способствующих снижению показателей колонизации эпителия влагалища бактериальной флорой, ассоциировано со снижением риска внутриматочной контаминации при проведении гинекологических манипуляций. Проведенное нами исследование продемонстрировало, что применение профилактической предоперационной санации влагалища поликомпонентным препаратом «Тержинан» позволяет снизить общую бактериальную обсемененность влагалища и предотвратить избыточную контаминацию полости матки во время гинекологических манипуляций, что может быть важно для снижения риска развития и частоты постманипуляционных осложнений.



