Проблема гнойно-септических инфекций (ГСИ) особенно актуальна в неонатологии, поскольку учреждения родовспоможения лидируют в статистике внутрибольничной заболеваемости [1, 2]. В соответствие с данными микробиологических исследований происходит расширение микробного спектра за счет многочисленных представителей коагулазо-негативных Staphylococcus и Enterococcus [3–5]. В то же время вспышки ГСИ, в том числе и в отделениях интенсивной терапии новорожденных, как правило, обусловлены грамотрицательными бактериями родов Klebsiella, Proteus, Pseudomonas [6–9]. Более того, с применением антибиотиков для профилактики стрептококковой инфекции повышается риск развития септических осложнений у новорожденных, обусловленных грамотрицательными микроорганизмами [10–12].
Pseudomonas aeruginosa, не ферментирующие грамотрицательные микроорганизмы, могут быть причиной разнообразных патологических состояний у новорожденных, включая сепсис, пневмонию, менингит, диарею, конъюнктивит и инфекции кожи [13, 14]. По некоторым данным, доля Р. aeruginosa при сепсисе в неонатальном периоде может составлять до 60% [15]. Принято считать, что роль P. aeruginosa как этиопатогена при вспышках ГСИ в учреждениях родовспоможения менее значима по сравнению с другими грамотрицательными бактериями. Однако в последние годы показано, что наряду с возможным персистированием/сохранением в различных экологических резервуарах [16, 17] эти микроорганизмы быстро приобретают устойчивость к антибактериальным препаратам различных классов [18, 19]. Вместе с тем в акушерских стационарах выбор антимикробных препаратов ограничен в силу того, что некоторые из них могут оказывать на организм новорожденных токсическое действие, угнетать функцию органов кроветворения и иммунной системы. В совокупности эти факторы создают в неонатальной клинике потенциальную угрозу вовлечения P. aeruginosa в эпидемически значимые процессы.
Цель данной работы – мониторинг P. аeruginosa в акушерских стационарах с учетом антибиотикорезистентности и генетического родства штаммов.
Материал и методы исследования
На базе бактериологической референс-лаборатории г. Перми проанализированы результаты микробиологического мониторинга, проводимого в учреждениях родовспоможения. Микроорганизмы выделены от здоровых новорожденных (колонизация) и в случае ГСИ в период с января 2006 г. по октябрь 2012 г. Бактериологические исследования смывов с поверхности кожи и заушной складки, слизистой оболочки полости рта (зева) и конъюнктивы проводили согласно традиционному регламенту микробиологического исследования новорожденных. В случае ГСИ клиническим материалом служили отделяемое пупочной ранки, моча, мокрота, ликвор, кровь. Оценку антибиотикочувствительности бактерий осуществляли в соответствии с Методическими указаниями МУК 4.2.1890-04. Формирование базы данных для анализа структуры циркулирующей микрофлоры и характера ее чувствительности к антибиотикам осуществлялось с помощью программы WHONET v.5.3. Обобщены результаты микробиологического анализа 409 807 проб различного биологического материала. Эпидемиологические показатели – среднемноголетний уровень инфицированности, темп ее прироста оценивали за период 2006-2010 гг. при помощи программы EpiTrend v.1.4.1. Полученные данные обрабатывали с использованием методов вариационной статистики. При статистической обработке результатов вычисляли среднее значение и ее ошибку (М±σ).
В период 2008–2012 гг. формировали банк ДНК штаммов P. аeruginosa. Тотальную ДНК получали как описано у G.G. Stone и соавт. (1994) [20]. Генетическое типирование осуществляли посредством полимеразной цепной реакции (ПЦР) с универсальным праймером М 13 (RAPD-ПЦР) [21] и BOX-ПЦР [22]. Для амплификации гена blaOXA-50 были использованы праймеры A/AS (фрагмент 869 п.н.), предложенные D. Girlich и соавт. (2004) [23]. Условия и режимы специфической амплификации соблюдали согласно авторскому протоколу. Все праймеры были синтезированы ЗАО «Синтол» (Москва). Визуализацию полос, документирование данных и интерпретацию результатов амплификации и типирования осуществляли после окрашивания геля бромистым этидием с использованием программного обеспечения системы гельдокументации BioDocAnalyze (Biometra, Германия).
Определение нуклеотидных последовательностей генов blaOXA-50 проводили c использованием набора реактивов SEQ Dye Terminator Cycle Sequencing Kit на автоматическом секвенаторе 3500xL Genetic Analyzer (Applied Biosystems, США) согласно рекомендациям производителя. Для секвенирующей ПЦР использовали те же праймеры, что и для наработки ампликонов. Поиск гомологичных нуклеотидных и аминокислотных последовательностей выполнен с использованием программы BLAST и базы данных GenBank/EMBL/DDBJ (http://www.ncbi.nlm.nih.gov). Далее их анализировали с использованием программ CLUSTAL X 1.83, TREECON version 1.3b. Анализ первичной структуры белков осуществляли с помощью программы Vector NTI 10 (http://www.catalog.invitrogen.com).
Результаты исследования
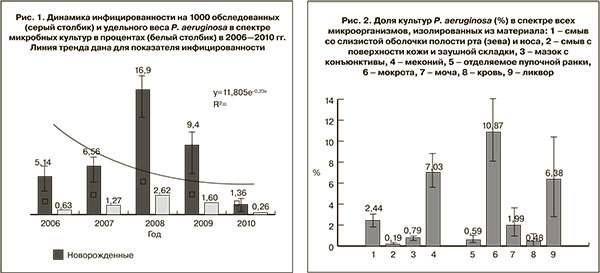
В Перми за 2006–2010 гг. было обследовано 113 523 новорожденных, из клинического материала которых изолировано 70 604 бактериальных и грибковых культур, в том числе 865 P. aeruginosa. Среднемноголетний уровень инфицированности P. aeruginosa составил 7,9±5,8 на 1000 обследованных. Направленность пятилетней динамики характеризовалась общей тенденцией к снижению со среднегодовым темпом прироста -7,0%. Прослеженная нами динамика показателей (рис. 1) обусловлена атипичной эпидемической ситуацией в 2008 г., когда было выявлено широкое распространение носительства P. aeruginosа среди детей в крупном акушерском стационаре города с последующим распространением в неонатальные отделения детских клиник (второй этап выхаживания новорожденных) [24].
Среднемноголетняя доля P. aeruginosа в спектре всех изолированных культур составила 1,23±0,04%. Этот показатель напрямую зависел от показателя инфицированности (рис. 1). Начиная с 2010 г. и в последние годы (2011–2012 гг.) доля P. aeruginosa составила 0,26±0,14% всех культур, и 0,39±0,16% в совокупности с другими псевдомонадами.
Встречаемость P. aeruginosa при исследовании различных материалов/биотопов существенно различалась. P. aeruginosa практически не высевали из смывов со слизистой оболочка полости рта (зева) и носа, поверхности кожи, конъюнктивы (рис. 2). Определенную настороженность вызывает высокая доля P. aeruginosa в спектре микробных культур из мекония и желудочного сока новорожденных. E. Borderon и соавт. (1990) не выявили связи ГСИ с колонизацией этими микроорганизмами гастроинтестинального тракта новорожденных [25]. Вместе с тем исследования последних лет с использованием молекулярных методов анализа позволили установить такую связь для других видов бактерий [26].
В случае ГСИ P. aeruginosa наиболее часто изолировали из мокроты, которая сохраняет свою приоритетную значимость в контексте выделения этих бактерий [27]. Удельный вес этих бактерий в ликворе составил более 6%. При этом частота встречаемости P. aeruginosa в биопробах, характеризующих раневые инфекции, инфекции мочевыделительной системы, септические состояния оказалась значительно ниже (рис. 2).
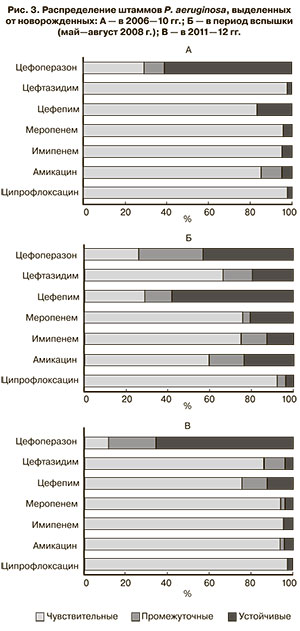 Анализ антибиотикочувствительности штаммов, выделенных от новорожденных в «спокойный» период 2006–10 гг., выявил, что доля изолятов, устойчивых к антибактериальным препаратам различных фармакологических групп, не превышала 20%, за исключением цефоперазона (рис. 3А). То есть практически все исследованные препараты обладали клинически значимой активностью.
Анализ антибиотикочувствительности штаммов, выделенных от новорожденных в «спокойный» период 2006–10 гг., выявил, что доля изолятов, устойчивых к антибактериальным препаратам различных фармакологических групп, не превышала 20%, за исключением цефоперазона (рис. 3А). То есть практически все исследованные препараты обладали клинически значимой активностью.
В 2011–12 гг. устойчивость культур к антибиотикам в акушерских стационарах оставалась на традиционно низком уровне (рис. 3Б). Анализ антибиотикофенотипов P. aeruginosa, изолированных в отделениях реанимации и интенсивной терапии (ОРИТ) и «неОРИТ», не выявил существенной разницы в чувствительности этих штаммов. Изучение профиля антибиотикорезистентности во время вспышки 2008 г. показало, что более 50% штаммов проявляли устойчивость к цефепиму, около 20% – к цефтазидиму (рис. 3B). Нечувствительность к карбапенемам и амикацину также встречалась значительно чаще. Наиболее активным в отношении данной группы штаммов оказался ципрофлоксацин, к которому были чувствительны более 95% штаммов. Сравнение антибиотикограмм культур P. aeruginosа, выделенных от новорожденных в этот период, выявило, что 80,7% штаммов имели сходные фенотипические характеристики. По-видимому, ситуация осложнилась формированием и распространением госпитального штамма P. aeruginosа, что и нашло отражение в общей структуре антибиотикочувствительности культур в данный период.
Для проверки данной гипотезы методом RAPD-ПЦР и BOX-ПЦР было проведено генотипирование «вспышечных» штаммов P. aeruginosa (n=114). В результате чего подавляющее большинство (n=111) из них отнесено к 3 геномовариантам и оценены как близкородственные. Данные культуры, скорее всего, были результатом персистирования «модального» штамма в отделениях акушерского стационара и двух детских больницах. Три штамма имели отличный генетический профиль.
Для подтверждения родства изолятов дополнительно выполнена специфическая амплификация и секвенирование blaOXA-50. Такая возможность была основана на двух известных фактах: продукция данных ферментов может считаться видовым признаком P. aeruginosa, но существует более 150 различных OXA-β-лактамаз. На наш взгляд, обнаружение идентичных оксациллиназ могло послужить дополнительным критерием их родства [23].
Сравнение нуклеотидных и аминокислотных последовательностей показало, что большая часть штаммов P. aeruginosa, циркулирующих в детской клинике, имеют последовательности, на 100% идентичные гену blapoxB (blaOXA-50-like) P. aeruginosa MF 6 (GenBank AY597439.1, AAT09630.1). Геномы 2 изолятов содержали последовательность blaOXA-50I P. aeruginosa KSM PAE0922 (GenBank HQ833036.1, AEK06328.1) и одного – blaOXA-50-like P. aeruginosa P23 (GenBank GQ141728.1, ACS45294.1). Такое единообразие, учитывая вариабельность OXA-50-подобных генов, позволило предположить формирование эпидемически значимого клона в замкнутом контуре: акушерский стационар – неонатальные отделения детской клиники.
Заключение
В последние годы сформировалось представление о ведущей этиологической значимости условно патогенных бактерий в развитии внутрибольничных инфекций новорожденных. Результаты проведенных исследований свидетельствуют, что P. aeruginosa не играет существенной роли ни в качестве колонизирующего микроорганизма, ни в качестве этиопатогена. Наиболее значимой P. aeruginosa может быть только в случае ГСИ дыхательных путей, при всех других воспалительных процессах ее доля меньше 10%.
С микробиологической точки зрения мы объясняем прослеженные особенности в первую очередь тем, что микробиом, формирующийся у новорожденных при благоприятных условиях, не содержит P. aeruginosa. Инфекция возникает в подавляющем большинстве случаев как экзогенная, обусловленная чаще всего нозокомиальными штаммами, и ассоциирована с резервуарами внутрибольничной среды, включая медицинский персонал [28]. С учетом уязвимости контингента она носит вспышечный характер, но благодаря жесткости требований к санитарно-эпидемическому режиму в акушерских стационарах ликвидируется в короткие сроки. Это подтверждается и анализом антибиотикорезистентности изолятов. Штаммы, выделенные от новорожденных, в значительном проценте случаев чувствительны к антибиотикам большинства групп. Исключение составляют «вспышечные» изоляты, но, учитывая кратковременность персистирования в отделении, поливалентная устойчивость у них, как правило, не формируется. Такая благоприятная ситуация в учреждениях родовспоможения свидетельствует о стабильности процессов, обеспечивающих биологическую безопасность медицинских услуг, что, как правило, предотвращает возможность формирования и распространения госпитальных штаммов P. aeruginosа среди новорожденных.
Авторы выражают благодарность Главному бактериологу г. Перми Н.С. Авдеевой, заведующей микробиологической лабораторией ООО «ПРО-МЕД» С.В. Проворовой за оказанное содействие в сборе материала и нозокомиальных культур P. aeruginosa.



