Вспомогательные репродуктивные технологии (ВРТ) стали революционным способом преодоления бесплодия, которые сделали возможным наступление беременности даже у пар, ранее считавшихся стерильными. По некоторым оценкам, к 2017 г. уже около 6 млн людей появились на свет благодаря ВРТ, а на сегодняшний день этот показатель достиг еще более высокого значения [1].
На протяжении долгого времени исследования, направленные на совершенствование методов ВРТ, преимущественно касались влияния именно на женский фактор. Сейчас, однако, все больше внимания уделяется тому, как качество сперматозоидов может повлиять на результативность ВРТ. Накапливаются данные о прогрессивных методах отбора сперматозоидов [2].
Сперматозоиды – сложные и уязвимые клетки, функция которых может нарушаться из-за сравнительно небольших морфологических, физиологических или биохимических изменений [3, 4]. Даже если бесплодие в паре связано не с мужским фактором как таковым, эти изменения способны оказать отрицательное влияние на результат ВРТ. Подготовка мужчины с целью оптимизации сперматогенеза и улучшения пула сперматозоидов является задачей уролога-андролога, но все последующие этапы находятся в зоне ответственности репродуктолога и клинического эмбриолога.
Принятие решения о выборе метода обработки мужского биологического материала и какого-либо специфического способа отбора сперматозоидов зависит от результатов ранее выполненной спермограммы и спермиологических тестов, а также от качества спермы, полученной непосредственно в день трансвагинальной пункции фолликулов. Методы селекции направлены на отбор сперматозоидов с высоким качеством ДНК и хорошим потенциалом фертилизации. Некоторые из них позволяют выделить субпопуляцию сперматозоидов с более благоприятными характеристиками, а некоторые – изолировать отдельные сперматозоиды для последующей интрацитоплазматической инъекции в ооцит (ИКСИ).
Центрифугирование в градиенте плотности
Центрифугирование в градиенте плотности разделяет сперматозоиды в коллоидной суспензии частиц диоксида кремния, стабилизированных гидрофильным силаном. Обычно градиент создается путем создания верхней и нижней фаз. Образец, содержащий сперматозоиды, помещается в качестве верхнего слоя. Градиент плотности может быть и непрерывным, с постепенным повышением плотности сверху вниз [5]. В основе метода лежит тот принцип, что нормальные сперматозоиды отличаются по плотности от измененных сперматозоидов и других клеток. Зрелые морфологически нормальные сперматозоиды имеют плотность более 1,1 г/мл, а незрелые и измененные сперматозоиды характеризуются плотностью в диапазоне 1,06–1,09 г/мл [6]. В результате центрифугирования в градиенте плотности можно получить субпопуляцию сперматозоидов с высокой подвижностью и нормальной морфологией. Лейкоциты, измененные сперматозоиды и продукты деградации клеток остаются в верхних слоях [7].
Фракция сперматозоидов, выделенная таким способом, характеризуется меньшей частотой анеуплоидии и диплоидии [8]. Центрифугирование позволяет выделить более подвижные сперматозоиды без усиления оксидативного стресса [9]. Тем не менее, чтобы минимизировать образование активных форм кислорода, рекомендуется использовать наименьшую продолжительность и силу центрифугирования (20 минут на 300g). Если образец остается слишком вязким даже после того, как прошло время разжижения эякулята, силу центрифугирования можно увеличить до 600g [10]. Реагенты должны находиться при комнатной температуре не более 1 часа, чтобы избежать смешивания двух фаз. Также рекомендуется не вносить в градиент слишком много биологического материала, так как это может приводить к агрегации сперматозоидов и нежелательных клеточных элементов при центрифугировании [11].
Микрофлюидные технологии
Микрофлюидика – это новая группа технологий, основанных на физических и химических особенностях поведения жидкости при объеме менее 1 микролитра в управляемых условиях. В репродуктивной медицине активно изучается возможность применения микрофлюидики для отбора сперматозоидов с имитацией процессов, которые происходят in vivo. Разработанные микрофлюидные устройства предназначены для научных целей и пока мало подходят для клинической практики [12–14]. Они могут отбирать сперматозоиды по их способности двигаться по химическому градиенту (хемотаксис), термическому градиенту (термотаксис) или их ответу на направление потока жидкости (реотаксис) [14–17]. Первые сообщения о потенциальном применении микрофлюидики для отбора прогрессивно подвижных сперматозоидов датируются 2003 г. Метод был основан на способности активно двигающихся сперматозоидов преодолевать микротечения в ламинарном потоке жидкости. Разработанное устройство позволило отделять подвижные сперматозоиды от других клеток [18, 19]. Современные прототипы способны даже разделять фракции сперматозоидов с разной скоростью передвижения [20]. Специальные наномеханические сенсоры могут фиксировать вибрацию, создаваемую хвостами сперматозоидов, и по ней определять их подвижность [21]. Также было предложено упростить спермиологический анализ с помощью микрофлюидного устройства. Chen C.Y. et al. продемонстрировали, что полученные с помощью этого метода показатели количества и подвижности сперматозоидов не более чем на 5% расходятся с показателями, полученными при традиционном подсчете в камере Маклера [22]. Трехмерный массив микроловушек позволяет выделить единичные подвижные сперматозоиды для дальнейшего изучения, что в обычных условиях невозможно сделать без их иммобилизации [23]. Известно, что на траекторию сперматозоидов в микрофлюидных условиях влияют не только их количество и подвижность, но и внешние факторы, такие как сдвиговое течение и течение Пуазейля (ламинарное течение через каналы в виде прямого кругового цилиндра или слоя между двумя неподвижными плоскостями) [24]. Как правило, микрофлюидные устройства для работы со сперматозоидами являются пассивными (работают без внешнего источника энергии) и основаны на гравитационном или гидростатическом принципе [25]. Ограничением этой технологии является ограниченное поле зрения при микроскопии, которое затрудняет наблюдение за активно подвижными сперматозоидами. С целью преодоления этого недостатка микрофлюидных устройств был разработан безлинзовый прибор с зарядовой связью, позволяющий охватить более широкое поле зрения [26].
Особым направлением в репродуктивной микрофлюидике является биомимикрия: микрофлюидный чип разрабатывается таким образом, чтобы сперматозоид попадал в условия, приближенные к женским половым путям по степени влияния реотаксиса, термотаксиса и хемотаксиса [27]. Разработано устройство (рисунок) с 6500 параллельных каналов, имитирующее прохождение сперматозоидов через плотно сложенный эпителий женского репродуктивного тракта [28].
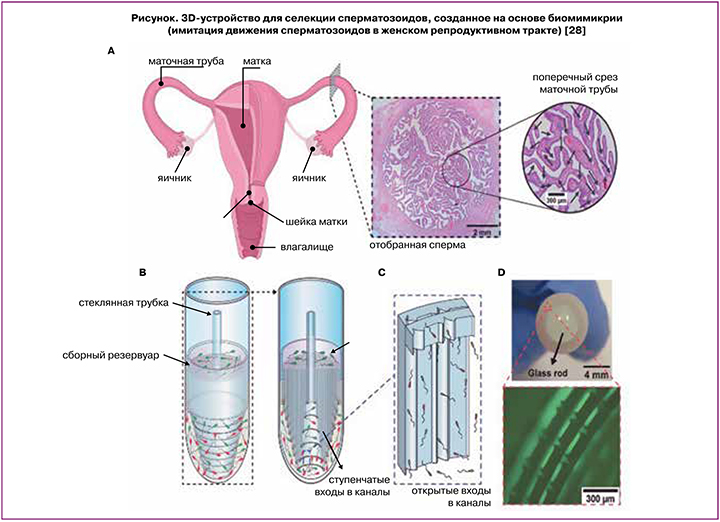
В литературе мало данных о преимуществах и недостатках микрофлюидики. Предполагается, что главным преимуществом такого метода отбора будет отсутствие необходимости в центрифугировании образца, которое может нанести сперматозоидам вред. Это может оказаться полезным при работе с образцами, полученными у мужчин с тяжелой олигозооспермией, хотя микрофлюидика не позволит выделить неподвижные живые сперматозоиды, все еще условно пригодные для ИКСИ [29]. Итальянские авторы предложили более простой и дешевый метод отбора сперматозоидов по горизонтальной миграции в чашке для ИКСИ, не требующий центрифугирования [30]. Несмотря на то, что он не относится напрямую к микрофлюидике, он использует схожие принципы: на чашке формируются три капли среды, соединенные перемычками, по которым могут передвигаться сперматозоиды. Частота получения бластоцист высокого качества после применения методики была выше, чем при центрифугировании в градиенте плотности [31]. Более амбициозной, но пока чисто гипотетической задачей является усиление подвижности сперматозоидов с использованием методов микрофлюидики. Debnath D. et al. доказали, что способные к направленному движению частицы Януса (частицы, одна полусфера которых покрыта каталитическим, фоточувствительным или парамагнитным материалом) микро- или нанокалибра увеличивают скорость движения других частиц, присутствующих с ними в одной среде [32].
В некоторых исследованиях сообщается, что отобранные с помощью микрофлюидных устройств сперматозоиды, обладают более высокой подвижностью и меньшим индексом фрагментации ДНК, по сравнению с субпопуляциями, выделенными другими способами [33–36]. В двух исследованиях оценивались реальные результаты ВРТ с использованием микрофлюидики. Yildiz K. и Yüksel S. не обнаружили разницы между центрифугированием в градиенте плотности и микрофлюидикой по частоте оплодотворения и наступления беременности у пар с необъяснимым бесплодием, хотя микрофлюидика продемонстрировала преимущества в парах с двумя и более неудачными попытками ВРТ в анамнезе [37]. В исследовании Yetkinel S. et al. при использовании микрофлюидного отбора сперматозоидов были получены эмбрионы более высокого качества, хотя это не отразилось на частоте наступления клинической беременности и частоте родов в парах с необъяснимым бесплодием [38].
Еще одной точкой приложения микрофлюидики в ВРТ является обработка тестикулярного материала. Выделение сперматозоидов из образца ткани яичка, полученного с помощью биопсии при необструктивной азооспермии, является довольно трудной задачей. Feng H. et al. разработали микрофлюидное устройство со спиральным каналом, которое делает возможной сепарацию сперматозоидов от других типов клеток и клеточного детрита [39].
Отбор по дзета-потенциалу мембраны сперматозоидов
Дзета-потенциал – электрокинетический потенциал на поверхности частиц в коллоидной суспензии. Мембрана зрелых сперматозоидов человека обладает дзета-потенциалом в пределах от -16 до -20 мВ. Это связано с появлением на них слоя сиаловых кислот в ходе сперматогенеза и последующего дозревания в придатке яичка [40, 41]. Отрицательный электрический потенциал можно использовать для отбора зрелых клеток, которые прошли все этапы созревания [13]. Согласно гипотезе, лежащей в основе этой методики, такие сперматозоиды будут связываться с положительно заряженными поверхностями [42]. Корреляции между подвижностью и дзета-потенциалом нет. В связи с этим, авторы методики рекомендуют применять ее вторым этапом после первичного центрифугирования в градиенте плотности. Делать это следует сразу после разжижения, так как при начале капацитации выраженность отрицательного мембранного заряда начинает уменьшаться [43].
Chan P.J. et al. предложили довольно простой метод создания положительного заряда на поверхности. Согласно их наблюдениям, достаточно поместить пробирку в латексную перчатку и прокрутить ее несколько раз, чтобы добиться положительного заряда 2-4 кВ на 1 дюйм [42]. После этого минутная экспозиция при комнатной температуре приводит к адгезии сперматозоидов с хорошим дзета-потенциалом к стенке пробирки. Таким образом, применение специального оборудования для электрофореза не требуется. Отбор по дзета-потенциалу является наиболее простым и экономически эффективным из всех современных способов селекции сперматозоидов. Он позволяет отобрать субпопуляцию гамет с меньшей фрагментацией ДНК, наилучшей морфологией и способностью к гиперактивации, если сравнивать его с обычным центрифугированием в градиенте плотности [44–46]. По наблюдениям клинических эмбриологов, использование для ВРТ сперматозоидов из субпопуляции, выделенной таким методом, повышает частоту фертилизации и качество эмбрионов, а также улучшает исходы беременности [45, 47]. Количество сперматозоидов, остающихся на стенке пробирки, как правило, невелико. В связи с этим, применение отбора по дзета-потенциалу ограничено при олигозооспермии и при использовании тестикулярных сперматозоидов.
Ishijima S.A. et al. обнаружили, что мембранный дзета-потенциал у сперматозоидов с X-хромосомой более сильный, чем у сперматозоидов, несущих с Y-хромосому [40]. Есть предположения, что отбор по дзета-потенциалу способен привести к преобладанию сперматозоидов с Х-хромосомой в субпопуляции клеток, используемых для ВРТ [48]. В исследовании Esfahani N. et al. при отборе по дзета-потенциалу доля сперматозоидов, несущих X-хромосому и Y-хромосому, была примерно одинаковой (1,00±0,01). Несмотря на это, частота рождения девочек в группе дзета-потенциала была значительно выше, чем в группе, где применялось только центрифугирование в градиенте плотности (63,6% против 38,5%) [47]. Необходимо проведение более крупных исследований, чтобы подтвердить влияние этого метода отбора на соотношение полов.
Сортировка магнитно-активированных клеток
Сортировка магнитно-активированных клеток (MACS) – еще один инновационный метод отбора сперматозоидов, для которого используются магнитные частицы, покрытые аннексином V. Аннексин V представляет собой фосфолипид-связывающий белок с высокой аффинностью к фосфатидилсерину. Последний, в свою очередь, является отрицательно заряженным фосфолипидом, присутствующим во внутреннем слое плазматической мембраны соматических и половых клеток [49]. На ранних этапах апоптоза фосфатидилсерин перемещается на наружный слой мембраны клетки [50]. Таким образом, он может быть использован как маркер апоптоза сперматозоидов. Методика MACS заключается в инкубации отмытых сперматозоидов с магнитными частицами, покрытыми аннексином V. Эти частицы связываются со сперматозоидами, подвергающимися апоптозу, на поверхности которых присутствует фосфатидилсерин. Суспензия клеток помещается в специальную колонку, где магнитное поле удерживает сперматозоиды, связавшиеся с аннексином. Остальные сперматозоиды свободно проходят через колонку и могут быть использованы для дальнейших эмбриологических манипуляций [51, 52]. В результате протокол MACS приводит к выделению двух фракций сперматозоидов – аннексин-позитивных (клетки с начавшимся апоптозом) и аннексин-негативных (клетки с интактной мембраной, без признаков апоптоза) [49, 51]. Другие компоненты семенной жидкости могут снижать эффективность методики, поэтому ее сочетают с другими техниками, такими как центрифугирование в градиенте плотности [13]. В качестве альтернативы MACS предлагалось использовать колонки со стекловатой, волокна которой покрыты аннексином V. Такая стекловата, как фильтр, удерживает сперматозоиды с инициированным апоптозом в соответствии с вышеописанным принципом. Эффективность этого альтернативного подхода в клинической практике пока не валидизирована [53].
Существует корреляция между повреждением ДНК, апоптозом сперматозоидов и мембранной экстернализацией фосфатидилсерина [54]. В нескольких исследованиях продемонстрировано, что аннексин-негативная фракция сперматозоидов характеризуется меньшим уровнем фрагментации ДНК [55–59]. Такие сперматозоиды более подвижны и характеризуются хорошей морфологией [55, 59–61]. MACS позволяет выделить более качественные сперматозоиды, но клинические данные по применению этой технологии в рамках протоколов ВРТ пока неоднозначны. В крупном проспективном рандомизированном исследовании Romany L. et al. было продемонстрировано, что частота оплодотворения и имплантации при применении MACS не возрастает [60]. Более того, Gil M. et al. провели систематический обзор и пришли к заключению, что MACS не влияет на частоту имплантации эмбриона (отношение рисков [ОР]: 1,03; 95%-ный доверительный интервал [ДИ]: 0,80–1,31) и риски невынашивания (ОР: 2,00; 95% ДИ: 0,19–20,90), хотя и отмечалась тенденция к более высокой частоте наступления беременности по сравнению со стандартными методами отбора сперматозоидов [62]. В отдельных работах отмечалась более высокая частота наступления беременности и имплантации при мужском факторе бесплодия без влияния на частоту оплодотворения ооцитов [63, 64]. Остается неясным, помогает ли MACS улучшить клинические результаты ВРТ, и какие пары могут получить пользу от применения этой технологии.
Отбор сперматозоидов с помощью кумулюсных клеток
Ооцит окружен комплексом, который состоит непосредственно из кумулюсных клеток и внеклеточного матрикса [65]. Перед оплодотворением яйцеклетки сперматозоид должен пройти через кумулюсный комплекс, хотя его физиологическая роль пока окончательно не ясна [66]. Franken D.R. и Bastiaan H.S. сопоставили характеристики сперматозоидов, прошедших через колонку кумулюсных клеток in vitro, с контрольными образцами. Они установили, что прошедшие через кумулюс сперматозоиды имели более благоприятные морфологические параметры, характеризовались качественной конденсацией хроматина, что оценивалось по окраске хромомицином A3, и хорошей способностью связываться с блестящей оболочкой ооцита [67]. Более новое исследование Naknam W. et al. продемонстрировало практически такие же результаты, но в нем также оценивался индекс фрагментации ДНК сперматозоидов с помощью теста дисперсии хроматина. Этот показатель был ниже у фракции сперматозоидов, прошедших через кумулюсные комплексы [68]. Yazdanpanah Z. et al. провели сравнительное исследование, в котором сопоставлялась лабораторная эффективность центрифугирования в градиенте плотности, кумулюсной колонки и инкубации с продуктами стволовых клеток, полученных из жировой ткани. Оба метода превосходили центрифугирование в градиенте плотности по выделению сперматозоидов с нормальной морфологией. Инкубация сперматозоидов с продуктами стволовых клеток была более эффективна по сравнению с кумулюсной селекцией в отношении фрагментации ДНК и подвижности отобранных гамет. Однако, как и в большинстве предыдущих исследований, клиническая эффективность метода в рамках реальных программ ВРТ не оценивалась [69].
Одним из немногих исследований, в котором отражены реальные результаты ИКСИ с отбором сперматозоида с помощью кумулюсного комплекса, является работа Wang C. et al. [70]. Частота оплодотворения была значительно выше по сравнению с обычным ИКСИ (85,31% против 74,77%). Кумулятивная частота имплантации также была выше, но разница не достигла статистической значимости.
Инкубация сперматозоидов человека с молекулярными продуктами стволовых клеток
Вышеупомянутый метод инкубации сперматозоидов с молекулярными продуктами стволовых клеток, полученных из жировой ткани, был предложен иранскими учеными. Строго говоря, это не метод селекции сперматозоидов, а способ улучшить результаты ВРТ путем получения субпопуляции более качественных гамет. Подвижность и целостность ДНК сперматозоидов, полученных с помощью такой обработки, более высоки [71]. Авторы метода выбрали в качестве источника стволовых клеток именно жировую ткань. Это связано с тем, что полученные из нее клетки более интенсивно по сравнению с мезенхимальными стволовыми клетками, полученными из костного мозга, вырабатывают такие важные для сперматогенеза белки, как основной фактор роста фибробластов, гамма-интерферон и инсулиноподобный фактор роста [72]. Другими преимуществами жировых стволовых клеток являются более высокая способность к пролиферации, иммуномодуляторные свойства и простота получения.
В рамках сравнительного исследования было продемонстрировано влияние этой технологии на результаты внутриматочной инсеминации. Частота наступления беременности при инсеминации сперматозоидами, отобранными по градиенту плотности, составила 5%, а при использовании сперматозоидов, инкубированных с продуктами стволовых клеток – 30% [73]. В исследовании Yazdanpanah Z. et al. этот метод по лабораторной эффективности превзошел отбор с применением кумулюсных клеток [69]. Инкубация сперматозоидов с супернатантом культуры стволовых клеток имеет значительный потенциал для применения в репродуктивной медицине, но пока никто, кроме авторов метода не продемонстрировал его клинические результаты.
Рамановская спектроскопия
Спектроскопия комбинационного рассеяния (рамановская спектроскопия) основана на взаимодействии видимого света с межатомными связями. В результате такого взаимодействия рассеивающиеся фотоны могут либо терять энергию, либо получать ее. Изучая свойства рассеянных фотонов можно судить о молекулярном составе вещества, в частности – о структуре ДНК и белков в живых клетках. Впервые с помощью рамановской спектроскопии удалось изучить структуру молекулы ДНК в сперматозоидах лосося [74]. Huser T. et al. доказали с помощью этого метода, что упаковка ДНК различается в человеческих сперматозоидах с нормальной и измененной морфологией [75]. Проводились спектроскопические исследования с целью оценки состояния митохондрий сперматозоидов и выраженности оксидативного стресса [76, 77]. Jahmani M.Y. et al. продемонстрировали, что результаты рамановской спектроскопии коррелируют с дефицитом протаминов (окраска хромомицином A3), ретенцией гистонов (окраска анилиновым синим) и фрагментацией ДНК сперматозоидов (окраска акридиновым оранжевым) [78]. Существуют варианты рамановской спектроскопии с излучением вне видимого спектра. Так, Pachetti M. et al. указывают на то, что спектроскопия в ультрафиолетовом диапазоне позволяет более точно оценивать состояние нуклеиновых кислот в клетке, игнорируя менее важные в контексте репродукции химические соединения [79]. Важно то, что в отличие от методов, подразумевающих окрашивание сперматозоидов, рамановская спектроскопия не приводит к их умерщвлению и позволяет отобрать отдельные клетки для ИКСИ. Данная технология является перспективной, но ее преимущества пока не доказаны в клинической практике [80].
Заключение
К настоящему времени предложено большое количество способов отбора сперматозоидов для ВРТ. В теории каждый из этих методов обладает набором определенных преимуществ. Однако, большинство исследований сосредоточены на описании характеристик сперматозоидов из выделенной субпопуляции, в то время как данных о влиянии этих методов на реальные клинические результаты ВРТ довольно мало. Наиболее изученными среди продвинутых методов отбора сперматозоидов являются селекция по дзета-потенциалу и MACS. Требуется проведение более масштабных исследований, ориентированных на результаты программ ВРТ, а также выделение показаний к определенным методам селекции сперматозоидов при различных нарушениях сперматогенеза.



