Патология соединительной ткани лежит в основе множества заболеваний человека, поскольку соединительная ткань обеспечивает нормальное функционирование тканей организма и вовлекается практически во все основные общие патологические процессы (повреждение, адаптация, регенерация, расстройства кровообращения и др.) [1].
У беременных женщин с дисплазиями соединительной ткани имеется предрасположенность к дезорганизации рубцовой ткани и патологии микроциркуляторного русла с манифестацией изменений и в более крупных сосудах. Механизмы дезорганизации соединительной ткани могут быть связаны с иммунопатологическими процессами, ишемическим фактором, а также гормональной перестройкой и ее дисрегуляцией [1–3].
Патология кровообращения при дисплазиях соединительной ткани может проявляться в виде диспластической мальформации артерий и вен, или артериовенозной аномалии матки, часто имеющей врожденный характер, однако, возможны случаи вторичных вариантов заболевания, формирующихся вследствие ранее перенесенных оперативных вмешательств на матке (удаления фибромиомы, кесарева сечения и др.) [4].
Патологическое прикрепление плаценты (ППП) характеризуется аномальным прикреплением плаценты к стенке матки и также может стать причиной разрыва матки. Главным угрожающим жизни симптомом ППП является кровотечение, возникающее в большинстве случаев в III периоде родов. Распространенность ППП составляет 1 случай на 2500 беременностей [5–8].
По данным современной литературы в 80% случаев ППП формируется после предыдущего кесарева сечения [5–8]. К остальным факторам риска относятся внутриматочные вмешательства в анамнезе, подслизистые лейомиомы, оперированная матка, синдром Ашермана, высокий паритет и патологическая имплантация [9–11].
В этиопатогенезе ППП можно выделить 2 группы факторов: состояние организма беременной, с одной стороны, и состояние ворсин хориона – с другой. При нормально развивающейся беременности децидуальная ткань препятствует инвазии хориона в миометрий, тогда как при аномалии прикрепления плаценты в децидуальной оболочке нарушается ферментативное равновесие в системе гиалуроновая кислота – гиалуронидаза и активность хориона резко возрастает. Таким образом, причинами ППП являются изменения в стенке матки, возникающие при воспалительных заболеваниях матки (эндометрите, генитальном туберкулезе), рубцах на матке (после операции кесарева сечения, миомэктомии и чрезмерно интенсивного кюретажа полости матки при аборте), опухолях матки (например, узле миомы, выступающем в полость матки и деформирующем ее), пороках развития матки (например, двурогой матки, сосудистых мальформацях) [12–14].
Данные о патогистологической характеристике дисплазии соединительной ткани матки крайне скудны. Вместе с тем известно, что морфологическая картина характеризуется изменением структуры стенки матки и ее сосудов с дезинтеграцией всех типичных слоев, присущих нормальным сосудам.
В судебно-медицинской практике не описаны случаи обнаружения мальформации сосудов беременной матки при недифференцированной дисплазии соединительной ткани с несостоятельностью рубца матки, осложнившихся разрывом стенки матки, геморрагическим шоком и гибелью плода до родов.
Приводим собственное наблюдение – мальформация сосудов матки у женщины 41 года с недифференцированной дисплазией соединительной ткани и дезинтеграцией рубца в матке (в 2002 и 2006 гг. операции – миомэктомии), ставших причиной гистопатического разрыва матки
Беременная Н., 41 год, повторнородящая высокой группы риска на сроке 38–39 недель поступила для родоразрешения по направлению врача женской консультации. Из акушерско-гинекологического анамнеза известно о двух медицинских абортах, одной беременности, закончившейся срочными родами. В связи с рождающимся субмукозным узлом миомы матки с геморрагическим синдромом была дважды выполнена чрезвлагалищная миомэктомия (2002 г., 2006 г.). По данным анамнеза жизни выявлены нарушения со стороны сердечно-сосудистой системы (сердечная недостаточность 0, добавочная хорда левого желудочка); эндокринопатия (эндемический зоб 1-й степени, эутиреоз); двусторонняя пиелокаликоэктазия; коагулопатия (вторичная коагулопатия, хронический ДВС-синдром); хроническая анемия. Настоящая беременность протекала на фоне впервые диагностированного хронического вирусного гепатита «С». Обследование на TORCH-инфекции выявило носительство герпетической инфекции и краснухи.
При поступлении в стационар в 9.00 пациентка предъявляла жалобы на отеки в области голеней в течение последних 2 недель. Объективно: общее состояние удовлетворительное; гиперстенического телосложения. Избыточного питания. Кожные покровы и видимые слизистые оболочки физиологической окраски. Периферические лимфатические узлы не увеличены. Отеки на голенях, стопах. Варикозное расширение вен нижних конечностей отсутствует. Симптом поколачивания отрицательный. Тоны сердца ритмичные. АД на правой руке – 118/85 мм рт. ст., на левой – 128/88 мм рт. ст., пульс 92 уд./мин., температура в норме. Дыхание везикулярное, хрипы не выслушиваются. Живот увеличен за счет беременной матки, безболезненный, не вздут. Матка в нормотонусе, соответствует сроку беременности, высота дна матки – 37 см, окружность живота – 102 см, без участков локальной болезненности. Положение плода – продольное. Предлежит головка плода, прижата к входу в малый таз. Сердцебиение плода ритмичное, ясное, 136 уд./мин.
Диагноз: Беременность 38–39 недель. Миомэктомия чрезвлагалищная в анамнезе (2002 г., 2006 г.). Перерыв в родах 15 лет. Гестоз легкой степени. Хронический вирусный гепатит С. Миома матки. Определен план обследования (ультразвуковое исследование, компьютерная томография) и ведения родов (кесарево сечение).
В 13.30 стала жаловаться на циркулярные боли внизу живота. Воды не отходили. Объективно: общее состояние удовлетворительное. Шевеление плода ощущает хорошо. АД=120/80 мм рт.ст. Пульс 82 уд./мин. Температура – 36,6. Зрение ясное. Матка возбудима, без участков локальной болезненности. Положение плода продольное. Предлежит головка над входом в малый таз. Сердцебиение плода ясное, ритмичное, частотой 144 уд./мин. Воды целы. Выделение из половых путей слизистые. Отеки голеней, стоп. Данные инструментальных исследований: признаков фетоплацентарной недостаточности нет. Не исключается однократное обвитие пуповиной вокруг шеи плода. Признаков антенатального дистресса плода не выявлено. Физиологический ритм.
В 16.00 на фоне нерегулярных ноющих болей внизу живота наступило резкое ухудшение состояния. Жалобы на слабость, тошноту. При осмотре – резкая бледность и акроцианоз кожных покровов. АД 70/40 мм рт. ст. Пульс 100 уд./мин. Матка напряжена. Сердцебиение плода не выслушивается. Выделений из половых путей нет.
Диагноз: Беременность 38–39 недель, Полная отслойка нормально расположенной плаценты? Геморрагический шок. Антенатальная гибель плода. Миомэктомия чрезвлагалищная в анамнезе (2002 г., 2006 г.). Перерыв в родах 15 лет. Гестоз легкой степени. Хронический вирусный гепатит «С». Эндемический зоб 1-й степени. Эутиреоз. Миома матки.
Учитывая сложившуюся акушерскую ситуацию, пациентка взята на экстренное абдоминальное родоразрешение по жизненным показаниям. Объективно: Кожные покровы влажные, холодные, резко выраженный диффузный цианоз кожных покровов. Дыхание самостоятельное, поверхностное. Дыхательная недостаточность II. Тоны сердца глухие ритмичные. АД 50/20 мм рт. ст. Пульс – 140 уд./мин., слабого наполнения.
В 16.10 начало операции – на фоне множественного фиброматоза матки обнаружен разрыв задней стенки матки до 15 см длиной, фиброзные изменения стенки в области разрыва. Объем операции – субтотальная гистерэктомия.
Послеоперационный диагноз: Срочные оперативные роды II в 38–39 недель. Гестоз легкой степени. Множественные фибромиомы матки. Эндемический зоб l-й степени, эутиреоз. Хронический вирусный гепатит С. Гистопатический разрыв задней стенки матки (до начала родов). Массивная кровопотеря (4500 мл), геморрагический шок III ст. Внутриутробная (антенатальная) гибель плода. Нижнесрединная лапаротомия. Надвлагалишная ампутация матки без придатков.
Морфологическое исследование: Матка с линейным разрывом в задней стенке тела матки, длиной 15 см, эндометрий губчатого вида с множественными кровоизлияниями, рубцовые изменения и аденомиоз матки.
Методы окраски гистопрепаратов матки: гематоксилин и эозин, Ван Гизон, Маллори, эластика орсеином. Кроме того, использованы иммуногистохимические методы с первичными антителами к коллагену I, III, IV (все Dako Cytomation, 1:100).
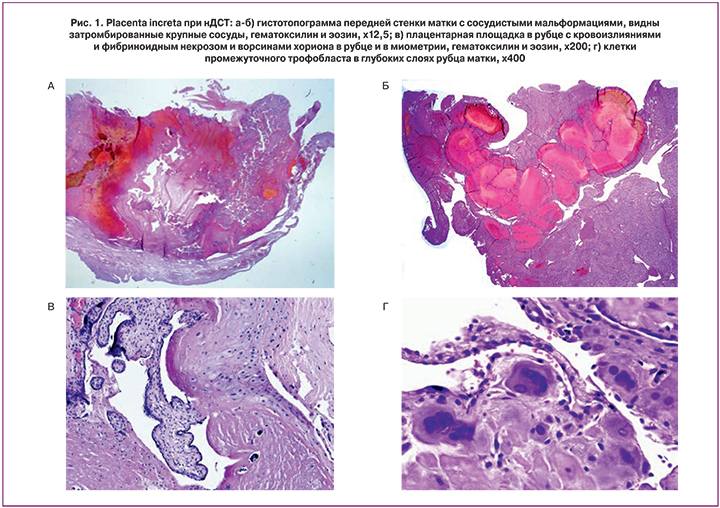
Гистологическое исследование. По краю разрыва стенки матки располагаются поля сосудов разной структуры и калибра (от мелкого до крупного). Стенки сосудов неравномерной толщины, местами резко утолщены с наличием мышечных включений разной толщины и вида, и неравномерным расположением коллагеновых структур. Последние в отдельных местах с большим количеством неравномерных пучков коллагеновых структур местами сливающихся с коллагеновыми структурами других сосудов, у которых не сформирован просвет, а стенка представлена только коллагеновыми структурами, мышечный слой и эластические волокна отсутствуют. Встречаются конгломераты сосудов, многие из которых плотно прилежат между собой, имеют общую адвентицию; просветы их часто сужены или отсутствуют. Другие извитые сосуды разных калибров разделены соединительнотканными перегородками, являющиеся общими для смежных сосудов. Отдельные конгломераты представлены пустыми извитыми сосудами, от мелких до крупных размеров, захватывающих ¼ поля зрения препарата при увеличении 400. Тонкая стенка этих сосудов представлена только мелкими островками коллагеновых структур, местами резко истонченными. В несколько утолщенной стенке единичных сосудов видны скопления мелкие сосудов типа капилляров. Вышеописанный конгломерат сосудов расположен в рыхлой соединительной ткани с явлениями мукоидного набухания, в которую врастают пласты хориона и децидуальная ткань. Они отечны с воспалительными инфильтратами, представленными круглоклеточными элементами с примесью полиморфноядерных лейкоцитов. В области разрыва матки видны резко истонченные разорванные мышечные волокна, пучки которых чередуются с гомогенизированными коллагеновыми прослойками (область рубца) разной величины. Часто видны очаги мукоидного набухания и фибриноидного некроза, воспалительные инфильтраты. В других отделах матка представлена малокровной и отечной мышечной тканью (рис. 1).
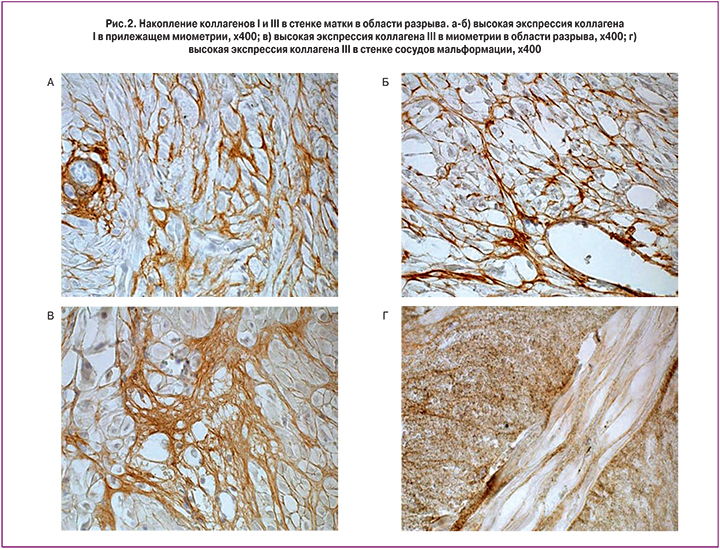
При иммуногистохимическом исследовании в стенке описанных сосудов обнаруживалась экспрессия в основном коллагена III типа, а также коллаген IV типа. Коллаген I типа накапливался преимущественно в прилежащем миометрии. В области разрыва определялась высокая экспрессия коллагена III типа (рис. 2).
Судебно-гистологический диагноз: Мальформация сосудов стенки матки и недифференцированная форма дисплазии соединительной ткани с дезинтеграцией рубца стенки матки с глубоким проникновением хориальной и децидуальной ткани в толщу стенки матки области порочно развитых сосудов с разрывом стенки матки. Геморрагический шок. Состояние после ранее (2002 г. и 2006 г.) перенесенных миомэктомий.
Кардиомиопатия; дополнительная хорда левого желудочка сердца.
Эутиреоз. Хронический вирусный гепатит С; носительство вирусов герпеса и краснухи.
Заключение
Мальформация сосудов матки в нашем наблюдении стала находкой при морфологическом исследовании оперативного материала от пациентки Н., 41 года. Гистопатический разрыв матки с гибелью плода и развитием геморрагического шока связан с мальформацией сосудов и дисплазией рубца стенки матки, в которые глубоко вросли хориальная и децидуальная ткань. При недифференцированной дисплазии соединительной ткани происходит накопление в рубцовой ткани коллагена III типа – эмбрионального коллагена, что приводит к облегчению инвазии ворсин хориона в стенку матки в область старого рубца. Кроме того, наличие сосудистых мальформаций привело к развитию ишемии стенки, что также усугубило процессы дезорганизации соединительной ткани и привело к разрыву матки.
Кроме того, ППП чаще развивается у пациенток с повреждением миометрия в анамнезе. Риск развития ППП увеличивается после кесарева сечения и миомэктомии. В исследовании Т.А. Демура установлено, что при недифференцированной дисплазии соединительной ткани риск развития ППП достаточно высокий, что связано, с одной стороны, с репарацией миометрия путем субституции с образованием в них очагов дезорганизации, а с другой, с плацентацией именно в области рубца на матке [3]. Образующаяся при недифференцированной дисплазии соединительной ткани рубцовая ткань является рыхлой структурой, богатой клеточными элементами и эмбриональным коллагеном III типа, что облегчает инвазию ворсин хориона в область старого рубца на матке. В области плацентарной площадки при недифференцированной дисплазии соединительной ткани отмечается увеличение экспрессии матриксных металлопротеиназ-1, 2 и снижение тканевых ингибиторов матриксных металлопротеиназ-1, что усиливает процессы дезорганизации соединительной ткани и способствует плацентации [3]. Совокупность описанных факторов объясняет причину развития плацентации именно в области рубца у пациенток с недифференцированной дисплазией соединительной ткани, а следовательно, и ППП в область рубца на матке, что может осложняться послеродовым кровотечением или послеродовым эндометритом.



