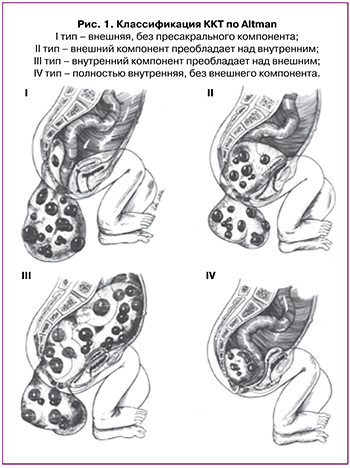
Крестцово-копчиковая тератома (ККТ) является наиболее распространенной герминогенной опухолью, частота составляет 1 случай на 10 000–35 000 живорождений с преобладанием среди женского пола (3:1) [1, 2]. В зависимости от локализации и степени распространения опухоли по классификации Altman выделяют 4 типа ККТ (рис. 1) [3]:
- I тип – внешняя, без пресакрального компонента;
- II тип – внешний компонент преобладает над внутренним;
- III тип – внутренний компонент преобладает над внешним;
- IV тип – полностью внутренняя, без внешнего компонента.
Наличие ККТ осложняет течение не только постнатального, но и антенатального периода. Так, согласно данным литературы, неонатальная смертность при ККТ составляет не более 5%, тогда как частота антенатальной гибели плода может достигать 50% [4]. Это связано с тем, что наличие у плода ККТ может приводить к развитию ряда неблагоприятных антенатальных осложнений, таких как анемия, компрессия смежных органов, разрыв опухоли, кровоизлияние в опухоль, повышение давления в правых отделах сердца с недостаточностью трикуспидального клапана и развитием сердечной недостаточности, неиммунной водянки плода (НИВП) [5–7].
Исходы и прогноз для плода зависят в основном от размера, степени васкуляризации и структуры опухоли. Так, например, ККТ с преимущественно солидным компонентом имеют обильное кровоснабжение и являются более неблагоприятными по сравнению с ККТ с преобладанием кистозного компонента [8, 9]. При опухолях солидного строения чаще развиваются сердечная недостаточность и НИВП. В основе патогенеза сердечно-сосудистой недостаточности и НИВП лежит обильная аномальная сосудистая сеть в солидном компоненте ККТ, которая приводит к увеличению объема циркулирующей крови плода и преднагрузки на сердце. В конечном итоге это приводит к срыву компенсаторных возможностей и прогрессированию сердечной недостаточности с присоединением отечного синдрома [8].
В ряде случаев наличие НИВП может приводить к развитию неблагоприятных материнских осложнений, таких как гипертензивные расстройства, зеркальный синдром; а часто встречающиеся при НИВП многоводие и плацентамегалия приводят к увеличению частоты угрожающих преждевременных родов за счет чрезмерного перерастяжения миометрия [7, 10–12].
Диагностика крестцово-копчиковых тератом
Своевременная диагностика ККТ определяет тактику ведения беременности, возможные антенатальные и постнатальные хирургические вмешательства, особенности подготовки к родоразрешению или необходимость прерывания беременности. Корректное ведение беременности при ККТ у плода требует точного определения ее локализации, наличия и степени внутритазового или внутрибрюшного распространения, определения структуры опухоли (преобладание солидного или кистозного компонента) и степени масс-эффекта на смежные органы малого таза или костные структуры.
Ультразвуковое исследование (УЗИ) является первичным методом диагностики ККТ, который позволяет с высокой точностью охарактеризовать ее и проводить динамическое наблюдение за темпами роста. В некоторых случаях, в особенности при наиболее краниальном расположении опухоли (IV тип), на фоне акустической тени от тазовых костей прецизионная диагностика по данным УЗИ может быть затруднительна [13]. Фетальная магнитно-резонансная томография (МРТ) используется для уточнения характера и протяженности изменений, определения сочетанных аномалий развития. МРТ позволяет более точно оценить внутритазовое или интраспинальное распространение опухоли, определить изменения смежных органов на фоне экспансивного роста опухоли [14].
Как правило, ККТ у плода выявляются на 14–16-й неделе беременности; однако заподозрить ККТ у плода можно даже при проведении 1-го скрининга [15]. Известно, что размеры опухоли, структура и темпы ее роста являются факторами, влияющими на исход заболевания [16–19]. Для количественной оценки роста опухоли в некоторых исследованиях использовалось соотношение размеров ККТ и фетометрических параметров, таких как окружность головы или живота, или предполагаемой массы плода [12, 20, 21].
Анализ данных литературы позволил выделить основные признаки ККТ, ассоциированные с неблагоприятным исходом, которые можно выявить при проведении УЗИ плода [12, 22]:
- размер более 10 см;
- объем солидного компонента более 90%;
- обильная васкуляризация по данным цветового допплеровского картирования;
- быстрый рост опухоли (более 150 см3 в неделю);
- III тип ККТ по классификации Altman;
- соотношение объема опухоли к массе плода (Vопухоли/mплода) до 24-й недели беременности – более 0,12. Расчет объема опухоли (Vопухоли) производится путем умножения наибольших размеров ККТ в сагиттальной, фронтальной и аксиальной плоскостях на 0,52 (постоянный коэффициент).
Согласно данным многоцентрового исследования, отношение объема опухоли к массе плода (Vопухоли/mплода) до 24-й недели беременности более 0,12 является одним из наиболее достоверных прогностических признаков неблагоприятного исхода (чувствительность 100%, специфичность 86,1%) [12]. Так, в исследовании Gebb J.S. et al. (2018) в 75% случаев плоды с Vопухоли/mплода>0,12 имели неблагоприятный исход по сравнению с 8% случаев неблагоприятного исхода у плодов с Vопухоли/mплода<0,12 [20]. При многофакторном анализе было продемонстрировано, что объем солидного компонента ККТ более 90% и показатель Vопухоли/mплода>0,12 являются признаками неблагоприятного перинатального исхода. Кроме того, в группе с Vопухоли/mплода>0,12 по сравнению с Vопухоли/mплода<0,12 были выявлены статистически значимые различия в следующих показателях: срок беременности при родоразрешении, частота внутриутробной гибели плода и частота оперативного родоразрешения. Наличие у плода ККТ с Vопухоли/mплода>0,12 влияет не только на перинатальные исходы, но и на течение беременности и способ родоразрешения.
Таким образом, важно как можно раньше диагностировать ККТ, проводить динамическое УЗИ, эхокардиографию плода каждые 1–2 недели с целью оценки темпов роста опухоли и определения признаков сердечной недостаточности, что, в свою очередь, позволит выделить группу наиболее высокого риска по неблагоприятному течению заболевания и своевременно предложить пациентке антенатальную коррекцию.
Возможности фетальной хирургии
Ввиду того, что ККТ у плода является редкой патологией, единого мнения по ведению беременности в настоящее время нет, а тактика ведения подбирается индивидуально. Публикации, касающиеся применения фетальных хирургических вмешательств, ограничены лишь отдельными случаями. Проведение внутриутробных хирургических вмешательств должно рассматриваться в случаях наиболее высокого риска неблагоприятного исхода при естественном течении беременности.
При выявлении неблагоприятных прогностических факторов ККТ у плода в мире применяется фетальная хирургия [6, 10, 22–24]:
1) открытая хирургия плода;
2) чрескожные минимально инвазивные процедуры, деваскуляризирующие ККТ: лазерная коагуляция сосудов, питающих ККТ; термокоагуляция сосудов, питающих ККТ; эмболизация (спирт) сосудов, питающих ККТ.
Целью внутриутробной хирургии является уменьшение/прекращение кровоснабжения опухоли, резекция опухоли или полное ее удаление для улучшения перинатальных исходов. Однако, как и при любом внутриутробном хирургическом вмешательстве, имеются риски прерывания беременности. Преимуществом чрескожных минимально инвазивных процедур является относительная простота хирургической техники, доступа и анестезиологического пособия. Согласно данным литературы, выживаемость при применении данных методов лечения составляет около 30–50% [25]. К основным недостаткам относятся более высокий риск антенатальной гибели плода из-за возможного ятрогенного кровоизлияния в опухоль, повреждение смежных органов и тканей, «нерадикальный» характер операции [25].
Перинатальная выживаемость при использовании открытой хирургии плода выше и составляет около 55% [22]. Однако применение данного метода лечения может быть ограничено, поскольку открытая операция на плоде является технически более сложной (требуется проведение общей анестезии, формируется корпоральный рубец на матке и возрастает частота акушерских осложнений, в особенности частота преждевременных родов) [26].
Sananes N. et al. также показали, что проведение фетальных хирургических вмешательств при ККТ высокого риска, по сравнению со случаями с естественным течением беременности, значительно улучшает частоту перинатальной выживаемости (40% против 12,5% в группе без лечения), способствует внутриутробному разрешению НИВП в 75% случаев, уменьшению объема опухоли и улучшению функции сердечно-сосудистой системы [25].
Перед проведением фетальных хирургических вмешательств рекомендуется проведение допплерометрической диагностики анемии у плода [7, 27, 28]. Для ее коррекции проводят внутриутробное переливание донорских эритроцитов. Кроме того, это позволяет снизить риски интра- и постоперационных кровотечений.
Фетальные хирургические вмешательства при ККТ высокого риска, безусловно, улучшают перинатальные исходы, однако единого мнения о показаниях к хирургическому вмешательству, методиках его выполнения на сегодняшний день не существует, что требует проведения дальнейших исследований.
Акушерская тактика при крестцово-копчиковых тератомах
Крайне важными являются вопросы тактики родоразрешения при ККТ у плода. Преобладание у плода внешнего компонента ККТ при родах может приводить к неправильному его положению, механическому препятствию при прохождении через родовые пути, кровоизлиянию в опухоль, ее разрыву. Некоторые исследователи рекомендуют при размере внешнего компонента ККТ более 5 см отдавать предпочтение кесареву сечению, что позволит снизить потенциальные риски [29].
Особый интерес вызывают данные американских исследователей (2019), которые поделились опытом «упреждающего» оперативного родоразрешения при выявлении признаков декомпенсации сердечной деятельности у плодов с ККТ на сроках от 27 до 32 недель гестации и экстренной резекции ККТ сразу после рождения [7]. Выживаемость составила 81,8% (8/11); при этом авторы отмечают, что не было ни одной неонатальной смерти, связанной с недоношенностью. Исследователи предлагают при наличии ККТ высокого риска до 27 недель гестации проводить фетальные хирургические вмешательства, а после 27 недель (когда «окно для проведения фетальных хирургических вмешательств закрывается») при наличии признаков сердечной недостаточности, кровоизлияния в опухоль проводить «упреждающее» родоразрешение и резекцию ККТ с целью улучшения перинатальных исходов. Схожего мнения придерживаются некоторые другие исследователи [30–33].
В ходе многоцентрового исследования Usui N. et al. авторы выяснили, что частота неонатальной смертности зависит от гестационного возраста при родоразрешении: так, при гестационном возрасте <28 недель, 28–31 неделя, 32–36 недель и ≥37 недель неонатальная смертность составила 60, 38, 11 и 0% соответственно. Однако в статье не анализируются причины родоразрешения, а также факт проведения фетальных хирургических вмешательств [16].
На рисунке 2 схематично представлен алгоритм ведения беременности при ККТ у плода, основанный на анализе публикаций, касающихся диагностики, наблюдения и акушерского менеджмента при данной патологии.
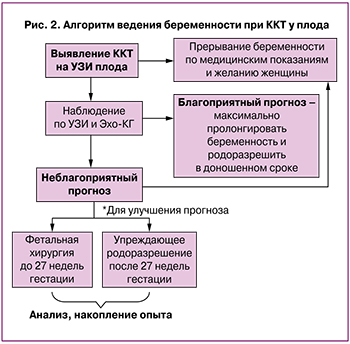
Таким образом, ККТ у плода высокого риска значительно повышает частоту антенатальных осложнений, ухудшает перинатальный прогноз, повышает частоту материнского травматизма.
Заключение
ККТ является сложным мультифакториальным заболеванием, прогнозирование исходов которого остается нерешенной проблемой. В случаях преобладания кистозного компонента с низкой васкуляризацией прогноз считается относительно благоприятным. Напротив, если ККТ имеет солидное строение с обильной васкуляризацией, имеются высокие риски развития сердечной недостаточности, НИВП и, как следствие, неблагоприятного исхода. Поэтому в таких случаях требуется активная тактика: динамическое наблюдение, проведение внутриутробных хирургических вмешательств по показаниям, а также своевременное родоразрешение.



