Ключевым элементом высокого качества помощи населению в сфере репродукции является возможность предложить пользователям самый широкий выбор методов и средств планирования семьи – это так называемый «метод-микс» – и обеспечить их использование гарантированными информационными услугами и консультированием [1].
Метод-микс и методика этапного консультирования [2] позволяет выбрать «свой метод» контрацепции, удовлетворяющий репродуктивным установкам потребителя в конкретный период жизни, повысить уровень удовлетворенности методом в настоящее время и перейти с одного метода на другой впоследствии при изменяющихся потребностях.
Цель: определить факторы, влияющие на распространенность контрацепции, дополнительные потребности женщин в неконтрацептивных эффектах и возможности их реализации на примере гиперандрогенной дермопатии.
Факторы, влияющие на распространенность контрацепции
Распространенность контрацепции находится под влиянием целого ряда факторов [3], к которым относятся: политика и программы; предпочтения медицинских работников; период времени с момента введения каждого метода в стране; особенности самих методов (простота использования, стоимость, побочные эффекты, эффективность); характеристики пользователей (информированность, религиозные убеждения, личные предпочтения, возраст и этап жизни).
Вероятность выбора одного из методов и приверженность к нему тем выше, чем шире спектр известных партнерам средств, чем большим объемом информации по правилам применения контрацептивных мер, нивелированию побочных эффектов и рисков использования обладают потребители.
В русскоязычной литературе нередко отмечается, что выбор контрацепции должен осуществляться врачом. Действительно, женщины должны получить консультацию профессионала в области репродуктивного здоровья. Однако важным является то, что врач дает информацию, а женщина выбирает метод, который отвечает ее потребностям и ожиданиям, потому что пациентки, довольные выбранным методом, используют его в течение более длительного времени [4]. Подчеркивается, что предпочтения врача не должны оказывать влияние на выбор женщины.
Но если выбор метода (между постоянными, обратимыми пролонгированными и обратимыми короткого действия, гормональными и негормональными) сделать довольно просто, то выбор средства, например, внутри группы комбинированных оральных контрацептивов (КОК) может вызвать затруднения – ведь они представлены более чем 40 наименованиями. Поэтому врачу важно выяснить дополнительные потребности каждой конкретной женщины и хорошо ориентироваться в тех препаратах, которые эти потребности могут удовлетворить.
Дополнительные потребности женщин в неконтрацептивных эффектах
Изучение общих потребностей и ожиданий пациенток при выборе КОК показало, что в первую пятерку вошли: высокая эффективность при минимальной дозе гормонов, незначительное количество побочных эффектов, простота использования, возможность воздействия на менструальный цикл, невысокая стоимость [5].
Для более детального изучения потребностей среди женщин, выбирающих КОК, исследовательская компания Ipsos [6] провела опрос, на основании которого было выделено 9 сегментов потребителей. Выяснилось, что женщины хотят, чтобы их контрацептив удовлетворял их потребности, то есть имел дополнительный эффект помимо защиты от нежелательной беременности. Наиболее многочисленными оказались четыре группы женщин, которым важно хорошо выглядеть (состояние кожи и волос), быть в хорошей форме (нормальная масса тела), те, у которых имеются проблемы со здоровьем (контроль над симптомами и восстановление репродуктивного здоровья) и кормящие матери (отсутствие влияния на лактацию и ребенка).
На основании данного исследования появилась идея объединить препараты c разными свойствами под единым «зонтичным» брендом, который получил название модэлль, а внутри него обозначить каждую из потребностей соответствующим названием: пьюр (pure – чистый), тренд (trend – модный), про (pro – профессионал) и мам (mam – мама). Таким образом, модэлль – это уникальная инновационная линейка контрацептивов с понятной навигацией, состоящая из 9 продуктов, которые отвечают всем основным потребностям женщин (четыре из них доступны с 2015 года, остальные находятся в разработке). Линейка препаратов помогает найти индивидуальное решение вопроса контрацепции и сделать выбор, основанный на объективных критериях.
Таким образом, препарат, отвечающий совокупности индивидуальных потребностей и ожиданий женщины, делает его приемлемым для нее, а именно приемлемость метода определяет его выбор, удовлетворенность, последовательность в применении и продолжительность использования. В свою очередь это имеет значение и для врача, так как позволяет достичь терапевтических целей и способствует повышению его профессионального авторитета.
Возможности реализации основных и дополнительных потребностей женщин на примере гиперандрогенной дермопатии
Рассмотрим, как отвечает заявленным целям, общим и дополнительным потребностям пользователей первый из указанных выше препаратов, модэлль пьюр, в состав которого входят этинилэстрадиол (ЕЕ) – наиболее известный и широко используемый в КОК эстроген, содержание которого в препарате в дозе 35 мкг позволяет отнести его к низкодозированным, и 2 мг ципротерона ацетат (ЦПА), который является первым и наиболее изученным гестагеном с антиандрогенным эффектом.
Надежность (эффективность) 35ЕЕ/ЦПА. Данная комбинация обеспечивает более чем 99% эффективность (индекс Перля – 0,1 на 100 женщин/лет) [7], что сопоставимо с КОК, содержащими 30 ЕЕ и левоноргестрел (30ЕЕ/ЛНГ) – 0,5 [8], дезогестрел (30ЕЕ/ДГС) – 0,6, дроспиренон (30ЕЕ/ДРСП) – 0,21 [9], и КОК, содержащими приближенные к натуральным эстрогены и гестагены последнего поколения – микронизированный эстрадиол и номегестрола ацетат (Е2/НМГА) – 0,31 [10], эстрадиола валерат и диеногест (Е2В/ДНГ) – 0,34 [11].
Побочные эффекты 35ЕЕ/ЦПА. В исследовании L. Falsetti и соавт. [12] о побочных эффектах, таких как увеличение веса, тошнота, головная боль и изменения либидо, не сообщалось. S. Aydinilik и соавт. [7] отмечали хлоазму (6,9%), напряжение молочных желез (5,6%) и головную боль (5,1%). Только 11,7% женщин прекратили прием из-за побочных реакций. В исследовании H. Gollnick и соавт. [13] таких больных оказалось всего 3,4%.
Не было зафиксировано изменения массы тела у 90,1% женщин после 3-го цикла приема препарата 35ЕЕ/ЦПА и у 81,8% – после 36-го [7]. При оценке весоростовых показателей Е.Л. Соболевой с соавт. [14] достоверного изменения ИМТ не было (до лечения – 31,2±4,4, через 6 месяцев – 30,8±4,7; p>0,1). Для сравнения: небольшое увеличение веса на 0,5 кг в среднем наблюдается во время лечения с использованием 30ЕЕ/ДНГ в исследовании R.T. Burkman и соавт. [15].
Установлено, что когда выбранный метод контрацепции отвечает ожиданиям женщины, и она получает значительное физическое и психологическое облегчение в связи с симптомами сопутствующих состояний, долгосрочная приверженность к препарату довольно высока, а побочные эффекты воспринимаются как незначительные [16].
Воздействие 35ЕЕ/ЦПА на менструальный цикл. У женщин с гиперандрогенизмом имеет место нарушение менструального цикла, и 35ЕЕ/ЦПА в состоянии его контролировать: аменорея наблюдается лишь в 0,5% циклов, и ее частота существенно ниже по сравнению с использованием, например, E2/НМГА (около 10%) [17]; межместруальные кровотечения встречаются в 4,4% циклов, причем их частота является высокой в начале (13%), а затем уменьшается до 0,5% к 36-му циклу; по сравнению с другими КОК доля женщин с внеплановыми кровотечениями в первые месяцы использования аналогична (15% – Е2/НМГА, 14% – 30ЕЕ/ДНГ и 12% – 30ЕЕ/ЛНГ) [18].
Простота использования. Нет ничего проще, чем прием таблеток внутрь один раз в день. Но именно это порой создает трудности – необходимость ежедневного контроля за использованием средства со стороны потребителя на протяжении длительного времени приводит к ошибкам и нарушениям режима приема, что среди россиянок составляет не менее 70% [19], и создает риск незапланированной беременности (12% в течение 12 месяцев после начала использования) [20].
Повышению комплаентности может способствовать высокая мотивация (за счет ожидаемых дополнительных неконтрацептивных эффектов) и хорошая информированность о необходимых действиях в случае пропуска таблетки [21].
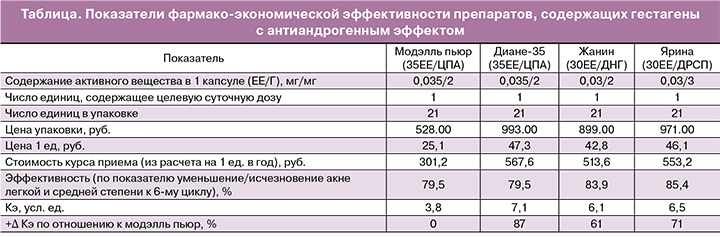
Невысокая стоимость контрацептива. Нами проведено определение прямых затрат на приобретение КОК с одинаковым составом (35ЕЕ/ЦПА) и КОК с другими гестагенами антиандрогенного действия (30ЕЕ/ДНГ и 30ЕЕ/ДРСП) на 1 год использования (таблица). Оценка эффективности выполнялась по критерию «улучшение/исчезновение акне легкой и средней степени» с учетом гестагена, содержащегося в препарате, по данным сравнительного клинического исследования [22]. В данной работе средняя эффективность препаратов вычислялась по разнице суммы элементов акне (закрытые и открытые камедоны, папулы, пустулы) до и после лечения и выражалась в процентах. Для оценки затрат на лекарства использованы данные о ценах Реестра лекарственных средств РФ. Косвенные медицинские затраты (обслуживание) пациентов были одинаковыми и не учитывались. Расчеты соотношения затраты/эффективность для каждого из вариантов проводили по формуле: Кэ=C/Эф, где Кэ – коэффициент затратной эффективности, C – стоимость всех затрат при пользовании конкретным препаратом; Эф – количественное выражение эффективности лекарств.
Как показывают результаты, коэффициент затратной эффективности оказался меньше у препарата модэлль пьюр по сравнению с оригинальным препаратом аналогичного состава на 87% и на 61–71% – по отношению к другим сравниваемым средствам антиандрогенного действия.
Неконтрацептивные эффекты 35ЕЕ/ЦПА. Как и для всех КОК, долгосрочные выгоды от использования 35ЕЕ/ЦПА связаны со снижением риска переломов костей у женщин и профилактики опухолей (доброкачественные опухоли и рак яичников, рак эндометрия и прямой кишки) [21]. Однако наиболее известный и часто используемый эффект 35ЕЕ/ЦПА связан с его антиандрогенным действием и способностью оказывать положительное действие на проявления гиперандрогенной дермопатии.
В этом отношении клиницисту важно учесть четыре грани проблемы: потребность в контрацепции у женщин, уже имеющих андроген-ассоциированные изменения кожи и ее придатков; появление андроген-ассоциированных изменений кожи на фоне применения гормональных препаратов; контрацепция у женщин, получающих терапию ретиноидами; КОК как метод системного лечения акне и/или гирсутизма [23].
Приоритет выбора из всего многообразия КОК и их использования у женщин с андроген-ассоциированными изменениями кожи и ее придатков обусловлен фармакологическими возможностями комбинации эстрогена и гестагена. Любые КОК более эффективны, чем плацебо [24], поскольку они снижают сывороточные уровни андрогенов за счет супрессии выработки лютеинизирующего гормона (ЛГ), прямого подавления ЛГ-зависимой секреции андрогенов в яичниках; стимуляции выработки в печени белка, связывающего половые стероиды; небольшого снижения секреции надпочечниковых андрогенов; умеренного подавления связывания андрогенов с их рецепторами в тканях-мишенях за счет снижения активности 5α-редуктазы и продукции 5α-дигидротестостерона. Первые три механизма характерны для всех КОК. Однако последний присущ лишь антагонистам андрогеновых рецепторов и блокаторам 5α-редуктазы: ЦПА, ДРСП, ДНГ, хлормадинона ацетату (ХМА). Наряду с гестагенами III поколения (дезогестрел и гестоден) они демонстрируют более высокую эффективность по сравнению с КОК, содержащими гестагены I и II поколений [25, 26], при этом «золотым стандартом» антиандрогенной терапии признан ЦПА. Вместе с тем сопоставимые с ЦПА клинические и биохимические эффекты демонстрируют ДНГ и ДРСП [27, 28].
В обзоре Cochrane представлена комплексная оценка эффективности КОК для лечения акне у женщин [25].
Было установлено, что все виды КОК были эффективны для лечения акне лишь с незначительными различиями. В течение 3–6 месяцев лечения КОК воспалительные акне снижаются на 30–60% с улучшением у 50–90% пациентов [29].
Результаты лечения комбинацией 35ЕЕ/ЦПА в наиболее ранних исследованиях были хорошими или очень хорошими у 90% больных с акне [30]. В отношении акне тяжелой степени уменьшение общего количества поражений менее 50% наблюдалась в 82,8% (95% ДИ 80,1–85,5) пациентов после шести циклов [12]. Весьма эффективным в улучшении акне 35ЕЕ/ЦПА оказался даже у женщин, которые были резистентны к другим видам лекарств [31].
Прогрессирующее снижение общей андрогенной активности объясняет клинические результаты, которые были получены после 36 циклов лечения – акне исчезли в 100% случаев. Эти результаты подчеркивают необходимость длительного использования препарата, в связи с чем были пересмотрены руководящие принципы в отношении ограничения продолжительности применения 35ЕЕ/ЦПА [32, 33].
Результаты лечения больных с гирсутизмом комбинацией 35ЕЕ/ЦПА в наиболее ранних исследованиях были хорошими или очень хорошими у 75% [30].
Значительное снижение гирсутизма по сравнению с исходным уровнем наблюдается через 9 месяцев при оценке по шкале Ферримана–Голлвея с 15,8±1,19 балла до 8,4±1,21, или на 51% [34]. Эффективность 35ЕЕ/ЦПА в отношении гирсутизма подтверждается также в работе A. Badawy и соавт. [35].
ДНГ и ДРСП демонстрируют схожее клиническое действие, однако систематические обзоры указывают на более выраженный эффект КОК, содержащий ЦПА [36]. Сравнительные исследования с другими антиандрогенами, например, с 5α-редуктазой финастеридом и спиронолактоном, подтверждают их эффект в отношении гирсутизма, однако уступающий эффекту 35ЕЕ/ЦПА [37–39]. Совместное использование этих препаратов усиливает их действие, а инсулиновые сенситайзеры (противодиабетические препараты) и изменение образа жизни не имеют никакой очевидной пользы с точки зрения тяжести гирсутизма. Как правило, требуется дополнительные косметические меры (эпиляция, эпиляция воском, обесцвечивание, электролиз, лазерная и фотоэпиляция), потому что необходимо по крайней мере от 6 до 12 месяцев, чтобы достичь оптимального эффекта [40, 41].
Проявления себореи при использовании 35ЕЕ/ЦПА значительно уменьшаются у 76,4% пациентов при использовании на протяжении 36 циклов [32]. В исследовании A.E. Schindler и соавт. отмечается, что клинические проявления себореи лучше других симптомов гиперандрогении (акне, гирсутизм) отвечают на терапию 35ЕЕ/ЦПА (улучшение достигнуто у 93,3% против 91,7 и 75,3% пациентов соответственно), включая полный или частичный терапевтический успех [42].
В отношении аллопеции публикаций недостаточно, но КОК и блокаторы андрогенов обычно используются. В ограниченных исследованиях 35ЕЕ/ЦПА имел эффект, сопоставимый с финастеридом [43] и спиронолактоном (при отсутствии повышенных уровней андрогенов в крови) [44]. В работе А.Л. Алейниковой [45] отмечается, что КОК, содержащие в своем составе ЦПА или ДНГ, оказывают сопоставимый антиандрогенный эффект: 12-месячный курс терапии приводит к клиническому выздоровлению у 15,3% больных, к значительному улучшению – у 23,1%, к улучшению – у 43,1% и оказывается неэффективным у 18,5% больных, большинство из которых имеют периферический генез гиперандрогении.
L. Brzezinska-Wcislo в течение 6–9 мес. удалось снизить интенсивность выпадения волос, истончение и выраженность себореи [46]. Однако по данным A. Lucky, несмотря на снижение выпадения волос, далеко не во всех случаях удается достичь стимуляции роста новых волос при монотерапии 35ЕЕ/ЦПА [47].
Заключение
Таким образом, расширение возможностей выбора среди современных методов контрацепции – основной фактор увеличения их использования.
КОК не только являются одним из наиболее эффективных методов контрацепции, они также обладают рядом преимуществ для сохранения и улучшения здоровья, повышения качества жизни, что отвечает индивидуальным потребностям пользователей и является фактором мотивации.
Антиандрогенное действие 35ЕЕ/ЦПА делает его особенно подходящим для лечения женщин с андроген-зависимыми заболеваниями кожи.



