Высокая распространенность непроизвольного мочеиспускания во время сна у детей (энурез) представляет актуальную проблему. По результатам эпидемиологических исследований установлено, что каждый 5-й ребенок имеет расстройства мочеиспускания, недержанием мочи страдает до 10% детей семилетнего возраста, а среди учеников начальной школы и более старшего возраста (начало пубертата) частота различных нарушений функций мочевого пузыря может достигать 17–26% [1–3].
Энурез, являясь одной из форм недержания мочи, хотя и не представляет прямой угрозы для жизни ребенка, способен снизить качество жизни, негативно влиять на нервно-психическое состояние, учебу, работоспособность, нарушить социальные связи с одноклассниками, адаптацию в школьной среде, представляя собой серьезную медико-социальную проблему [3, 4].
Рефлекторная деятельность мочевого пузыря регулируется корой головного мозга и подкорковыми структурами (таламус, гипоталамус). В норме контроль коры головного мозга над субкортикальными центрами формируется к 3–5 годам [1, 5], но под влиянием различных неблагоприятных факторов риска могут наблюдаться отклонения. В большинстве случаев дисфункция анального расстройства и мочеиспускания выявляется у детей в возрасте 6–7 лет, когда проводится их медицинский осмотр.
В соответствии с МКБ-10 на сегодня различают две формы ночного энуреза. Первичный, когда у ребенка еще не сформировался условный рефлекс, и «мокрые ночи» наблюдаются от рождения. Вторичный, когда условный рефлекс, заставляющий ребенка пробуждаться, утрачен или нарушен вследствие воздействия различных неблагоприятных факторов (стресс, хронические заболевания, нарушения психики, травмы, инфекции, интоксикации и др.).
Многообразие причин и сложность патогенеза дисфункций мочевого пузыря при энурезе определяют широкий спектр современных методов лечения. Повышение эффективности проводимой терапии направлено на формирование или восстановление утраченного контроля за накопительной способностью мочевого пузыря. Поскольку энурез относится к нейрогенным дисфункциям мочевого пузыря, вовлечение структур и проявления его различны: от центральных отделов коры головного мозга до интрамурального отдела шейки мочевого пузыря [2, 5, 6], что требует комплексного лечения. При этом необходимо учесть, что медикаментозная терапия в основном носит симптоматический характер, купирует и/или снижает симптомы заболевания, но не устраняет его причины [7].
Для воздействия на структуры центральной нервной системы (ЦНС) широко используются различные препараты: ноотропы, транквилизаторы, антидепрессанты, антихолинергические средства для расслабления гладкой мускулатуры детрузора и увеличения объема мочевого пузыря, в частности оксибутинин (дриптан), и для уменьшения образования мочи в ночное время адиуретин (миринин) [4].
При назначении медикаментозной терапии важна своевременность и адекватность терапии с учетом возраста, периода, когда у детей с дисфункцией мочевого пузыря формируются морфофункциональные изменения в тазовых органах. Симптомы поражения висцеральных органов, по данным литературы, в среднем возникают в возрасте от 2 до 15 лет. В этом возрасте существующие патофизиологические процессы переходят в патоморфологические с формированием стойких нарушений функции мышц тазового дна и появлением сочетанных расстройств функции тазовых органов – нарушений дефекации, мочеиспускания и воспалительных процессов наружных половых органов у девочек [3].
Проведение консервативной медикаментозной терапии и формирование условно-рефлекторных взаимодействий требует значительного времени и затрат. Так, например, курс лечения оксибутинином составляет 2–3 месяца и более при обычной дозе 5 мг в сутки часто сопровождается серьезными побочными эффектами: запоры, сухость во рту, сердцебиение, вероятность развития несахарного диабета. Для уменьшения побочных эффектов и снижения лекарственной нагрузки рекомендуется при сочетанных нарушениях функции тазовых органов использовать физиотерапевтическое воздействие на пояснично-крестцовую область и нижнюю часть передней брюшной стенки в качестве основных зон воздействия.
 По мнению большинства отечественных и зарубежных исследователей, консервативное лечение целесообразно начинать с наиболее доступного и менее инвазивного воздействия, к которым относится поведенческая терапия и физиотерапевтические процедуры [7–11]. Многочисленные исследования авторов свидетельствуют о высокой эффективности физиотерапевтических процедур на область тазового дна, в частности вибромагнитного воздействия (ВМВ), которое позволяет улучшить функцию и гемодинамику тазовых органов [6, 8, 11, 12]. Среди физических методов лечения первичного энуреза широко используется транскраниальная магнитотерапия, которая, воздействуя на ЦНС, ускоряет созревание корково-подкорковых взаимодействий [12].
По мнению большинства отечественных и зарубежных исследователей, консервативное лечение целесообразно начинать с наиболее доступного и менее инвазивного воздействия, к которым относится поведенческая терапия и физиотерапевтические процедуры [7–11]. Многочисленные исследования авторов свидетельствуют о высокой эффективности физиотерапевтических процедур на область тазового дна, в частности вибромагнитного воздействия (ВМВ), которое позволяет улучшить функцию и гемодинамику тазовых органов [6, 8, 11, 12]. Среди физических методов лечения первичного энуреза широко используется транскраниальная магнитотерапия, которая, воздействуя на ЦНС, ускоряет созревание корково-подкорковых взаимодействий [12].
Для снижения активности симпатического звена вегетативной нервной системы используется магнитное поле на шейные симпатические ганглии, но наиболее эффективной в лечении первичного энуреза оказалась транскраниальная электростимуляция (ТЭС), которая проводится по лобно-сосцевидной методике [12]. Использование ТЭС оказывает воздействие на активность детрузора, что приводит к снижению общего числа суточных мочеиспусканий и увеличивает объем мочевого пузыря.
В настоящее время в литературе отсутствуют сведения о применении физиотерапевтического воздействия непосредственно на область детрузора и мышцы тазового дна, что представляет собой интерес при лечении детей с вторичным энурезом, когда условный рефлекс был сформирован и/или утрачен вследствие различных факторов риска, заболеваний и отсутствии видимых причин.
Целью работы было изучить эффективность комплексной медикаментозной и физиотерапии в виде ВМВ на область тазового дна при лечении энуреза у девочек-подростков с утраченной функцией контроля над мочеиспусканием.
Материал и методы исследования
В исследование включено 36 девочек в возрасте от 10 до 15 лет с жалобами на ночное недержание мочи и учащенное мочеиспускание в дневное время. Средний возраст детей составил 13,6±1,2 года. Всем больным проводилось уронефрологическое исследование, ультразвуковое исследование почек и мочевого пузыря. Для объективизации влияния ВМВ осуществляли ультразвуковое исследование мышцы, поднимающей задний проход (m. levator ani). Плоскость сканирования мышц была поперечной, а длинная ось датчика была ориентирована перпендикулярно длинной оси тела пациента, что позволяло визуализировать мышцы, которые представляли собой широкие ленты-тяжи, веерообразно отходящие от анального сфинктера, при втягивании которых происходило их сокращение и утолщение.
Следующим этапом оценивали кровоток мышц. Мышца, поднимающая задний проход (m. levator ani), имеет форму раскрытого веера и делится на три части. Наиболее информативной для исследования является лобково-копчиковая часть (m. pubococcygeus), которая отходит от лонной кости и ориентирована несколько вниз кзади и к середине. По пути следования волокна m. pubococcygeus окружают мочеточник и заканчиваются на уровне запирательного канала. Сухожилие этой мышцы прикрепляется в области нижнего крестцового и верхнего копчикового позвонков. Оценка кровотока данной мышцы, находящейся в непосредственной близости от детрузора, позволяет выявить механизмы влияния физиотерапевтического воздействия при лечении вторичного энуреза.
В режиме допплеровского и дуплексного сканирования определяли ряд параметров, характеризующих:
- пиковую систолическую скорость, Vps, см/с (наибольшая линейная скорость движения частиц крови в систолу);
- конечную диастолическую скорость, Ved, см/с, которая используется для расчета индекса резистентности (ИР) и пульсаторного индекса (ПИ). Оба этих индекса участвуют в оценке периферического сосудистого сопротивления [13, 14].
Клинические признаки императивного мочеиспускания оценивали по опроснику Е.Л. Вишневского в баллах, где определялась степень позыва на мочеиспускание, недержание мочи, поллакиурия, ноктурия, уменьшение среднего эффективного объема мочевого пузыря. Бальная оценка императивного мочеиспускания была связана со степенью тяжести энуреза. При тяжелом течении (>21 балла) непроизвольное мочеиспускание происходило каждую ночь. При среднетяжелом течении оно наблюдалось 1 раз в неделю, при легком течении – 1 раз в месяц.
Исследование проводилось трехкратно: до начала лечения, спустя месяц и через 3 месяца после начала лечения. Исключением для проведения исследования послужили больные с инфравезикальной обструкцией, неврологическими заболеваниями и воспалительными процессами мочевыводящих путей, а также первичным энурезом. В группе исследования давность энуреза у детей составила от 3 месяцев до 2,5 года, патология мочевыводящей системы (пузырно-мочеточниковый рефлюкс, аномалии строения почек и нарушения обмена) выявлены у 16 (44,4 %) больных.
В результате уродинамического исследования гиперрефлекторный мочевой пузырь был диагностирован у 32 (88,8%), гипорефлекторный – у 4 (11,1%) детей.
Все пациенты с энурезом были разделены на 2 группы: основная (1-я группа) – 21 (58,3%) девочка, которым проводилось комплексное медикаментозное и физиотерапевтическое лечение. Медикаментозная терапия в данной группе проводилась препаратом дриптан в дозе 3–5 мг (два раза в сутки), физиотерапевтическое лечение – с помощью аппарата «АВИМ-1» на область тазового дна. Аппарат реализует ВМВ на ткани тазового дна (рег. удост. № ФСР 2008/02518, произв. ООО «ТРИМА», Саратов). Группа сравнения (2-я группа) включала 15 (41,7%) больных, где проводилась медикаментозное лечение препаратом дриптан в той же дозе, что и в основной группе в течение 1 месяца. Результаты исследования кровотока в сосудах мышц сравнивались с показателями, полученными у 5 здоровых девочек 12–14 лет с отсутствием энуреза.
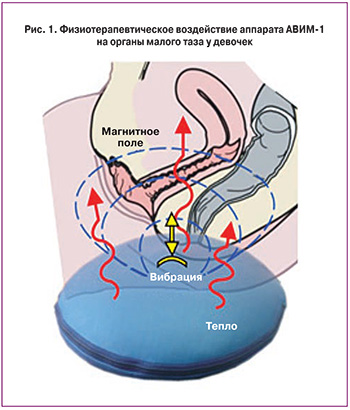
 Аппарат «АВИМ-1» представляет собой дискообразное устройство (рис. 1) со слегка выпуклой рабочей поверхностью, которое может располагаться на сиденье стула. Процедуры проводили в положении сидя на аппарате по 10–15 минут ежедневно в течение 15 дней. Расположение вибратора в центре устройства способствовало усилению ощущений и оказывало максимальное вибрирующее воздействие на область тазового дна.
Аппарат «АВИМ-1» представляет собой дискообразное устройство (рис. 1) со слегка выпуклой рабочей поверхностью, которое может располагаться на сиденье стула. Процедуры проводили в положении сидя на аппарате по 10–15 минут ежедневно в течение 15 дней. Расположение вибратора в центре устройства способствовало усилению ощущений и оказывало максимальное вибрирующее воздействие на область тазового дна.
Эффект воздействия усиливался при одновременном тепловом воздействии температурой 43–45°С на мягкие ткани промежности. Возможности аппарата позволяют изменять характер вибрации и температуры в ходе процедуры во избежание адаптации тканей. При этом на ткани осуществляется воздействие переменного и пульсирующего магнитного поля, индукция которого составляла на поверхности аппарата 50±10% мТл. Это соответствовало индукции в области детрузора 5–7 мТл. Минимальный курс лечения составлял 10 ежедневных амбулаторных процедур, стандартный – 15. Продолжительность процедуры постепенно нарастала от начала лечения к концу курса. Статистический анализ проведен с использованием программного пакета Statistics for Windows 10.0 (StatSoft). Для сравнения межгрупповых дисперсий использован дисперсионный анализ при 95% уровне значимости (р<0,05).
Результаты исследования и обсуждение
Основные жалобы пациенток при обращении в 29 (80,5%) случаях были связанны с расстройством мочеиспускания и болевым синдромом. Жалобы на болевые ощущения тянущего характера предъявляли 19 (52,7%) девочек, боли преимущественно локализовались в области лобка с иррадиацией в область промежности и крестца.
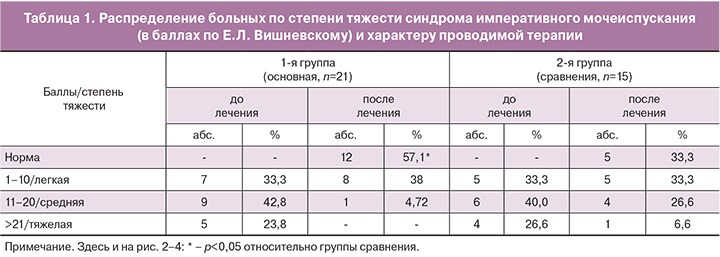
После проведенного стандартного курса лечения у большинства больных отмечалась положительная динамика клинической картины, снижение симптомов императивного мочеиспускания. Результаты лечения по степени тяжести энуреза и распределение больных в группах от характера проводимой терапии через месяц после начала лечения представлены в табл. 1.
Комплексное медикаментозное лечение – дриптан и ВМВ позволило устранить симптомы ночного энуреза у 57,1% больных, монотерапия – дриптан вызывала улучшение в 33,3 % случаях.
Легкая степень тяжести ночного энеуреза наблюдалась в 1-й группе у 38,0% детей, во 2-й – у 33,3%. Оценка результатов терапии энуреза спустя 3 месяца выявила снижение эффективности в основной группе на 4,3%, в группе сравнения – на 12,6%, что свидетельствовало об «отсроченном» воздействии магнитотерапии [12].
Бальная оценка симптомов императивного мочеиспускания коррелировала с результатами уродинамического исследования со среднеэффективным объемом мочевого пузыря (Vср) при его гиперактивности.
Благодаря ВМВ в 1-й группе Vср после лечения увеличился на 67,7% и спустя 3 месяца достиг 72,8% от исходного значения (рис. 2). В группе сравнения Vср увеличился после лечения на 47,6% и спустя 3 месяца снизился до 36,1%.
Число среднесуточных микций у детей с гиперфункцией мочевого пузыря снизилось в 1-й группе с 10,6 до 6,5 (36,6%), во 2-й группе – с 10,8 до 7,7 (28,7%) (р<0,05).

У девочек с гипофункциональным пузырем в 1-й группе число микций увеличилось в среднем до 5,4, при этом ночное непроизвольное мочеиспускание прекратилось у 2 детей из 1-й группы, и сохранилось у 1 ребенка из 2-й группы с переходом средней стадии в легкую. При этом у детей с гипофункциональным пузырем во 2-й группе число микций в сутки практически не изменилось (3–4), частота энуреза сохранялась в пределах 1 раза в неделю.
Наличие клинического эффекта при гипофункциональном мочевом пузыре свидетельствовало о регулирующем влиянии ВМВ в области тазового дна, которое реализовалось, по всей видимости, рефлекторно через ЦНС в качестве ответной реакции на раздражитель. Результаты исследования кровотока m. levator ani в обследованных группах представлены на рис. 3 и 4.
У обследованных девочек 2-й группы после проведенного лечения систолическая скорость кровотока снизилась в сосудах m. levator ani и лобково-копчиковых соответственно на 7,6 и 8,2% (р<0,05). Статистически неизменными остались индексы ПИ, ИР. Одновременно следует отметить, что после комплексной терапии диастолическая скорость в сосудах мышц тазового дна увеличилась на 9,3%, в группе сравнения – на 5,2% Таким образом, использованная нами доза м-холиноблокатора статистически значимо приводила к расслаблению мышц тазового дна и улучшению кровотока в мышцах.
У детей 1-й группы после лечения систолическая скорость кровотока в обеих мышцах снизилась на 47,5 и 39,7% соответственно. При этом ПИ и ИР приблизились к показателям здоровых детей. Значения Vps после лечения оказались ниже значений здоровых детей, что следует рассматривать как положительный фактор активного расширения сосудов и расслабления мышц вследствие ВМВ в сочетании с легким и неглубоким прогревом.
По результатам исследования, представленным на рис. 3 и 4, следует, что выявленные до начала лечения высокие скоростные показатели кровотока (по сравнению с группой здоровых) могут свидетельствовать о «вытягивании» сосудов вследствие спазма мышц на фоне хронического психоэмоционального стресса ребенка. Это подтверждается уменьшением или купированием болевых ощущений в области малого таза у 6 (40%) детей 2-й группы и 16 (76,1%) 1-й группы после лечения.
Сравнение показателей пиковой систолической скорости кровотока, полученной при проведении ультразвуковой допплерографии, выявило уменьшение спазма в сосудах мышц тазового дна у пациентов обеих групп, но терапия, дополненная ВМВ, была более эффективна, и улучшение состояния наступало значительно раньше, чем при проведении медикаментозной терапии дриптаном.
Снижение пиковой систолической скорости в сосудах m. levator ani при комплексном лечении составило 47,5% (против 8,2% на фоне только медикаментозной терапии), нормализация мочеиспускания наступила у 57,1% детей (против 33,3%), что свидетельствовало об эффективности комплексного лечения.
Заключение
Таким образом, полученные нами результаты демонстрируют эффективное и безопасное совместное применение медикаментозного и физиотерапевтического лечения в виде ВМВ на область тазового дна у девочек-подростков, страдающих энурезом. Комплексная терапия позволила в 1,72 раза повысить эффективность лечения по критерию «норма», снизив неблагоприятные побочные эффекты на организм ребенка.
Абсолютная эффективность лечения (норма) достигнута в 57,1% случаев (против 33,3% в группе сравнения) и обусловлена миорелаксирующим действием с улучшением кровоснабжения мышц тазового дна и области детрузора.



