Преэклампсия (ПЭ) осложняет 2–8% беременностей и продолжает оставаться одной из ведущих причин материнской и перинатальной смертности и заболеваемости [1]. В научных работах последних десятилетий, приводятся доказательства в поддержку гипотезы о существовании двух фенотипов ПЭ в зависимости от дебюта заболевания: с ранним началом (до 34 недель) и поздним началом (после 34 недель) [2–5]. Последние научные обзоры, основанные на убедительных исследованиях, доказывают необходимость разделения на раннюю и позднюю ПЭ и даже рассматривают возможность данного мультисистемного расстройства вне связи с гестационным процессом [6–8].
Ранняя ПЭ – наиболее тяжелый клинический вариант течения заболевания, встречается в 5–20% случаев всех ПЭ, ассоциируется с задержкой роста плода (ЗРП), патологическим плодово-маточным кровотоком по данным ультразвуковой (УЗ) допплерометрии, малым размером плаценты к моменту родов, более высокой частотой индуцированных преждевременных родов, неонатальной заболеваемости и смертности [9]. Развитие ранней ПЭ связано с нарушением инвазии трофобласта, незавершенной трансформацией спиральных маточных артерий, дезадаптацией иммунной системы, повышением уровня маркеров эндотелиальной дисфункции [10, 11].
Поздняя ПЭ составляет 75–80% всех случаев ПЭ, связана с материнской заболеваемостью (метаболическим синдромом, нарушением толерантности к глюкозе, ожирением, дислипидемией, хронической артериальной гипертензией) и ассоциирована с нормальным кровотоком при УЗ-допплерометрии маточных артерий, нормальной массой тела новорожденного при рождении, нормальным объемом плаценты [9, 12].
Плацентарная площадка (ПП) изучена в единичных работах, в которых не сопоставлялись ранняя и поздняя формы ПЭ [11, 13, 14]. Вместе с тем уровень современных знаний требует углубленных исследований в этом направлении.
Цель исследования: выявление клинико-патогенетических различий ранней и поздней ПЭ на основании комплексного обследования беременных с учетом морфологической и иммуногистохимической характеристики ПП.
Материал и методы исследования
Проведен анализ клинико-анамнестических данных 150 беременных, которые были разделены на 3 группы: I группу составили 50 пациенток с ранней ПЭ, II группа – 50 пациенток с поздней ПЭ, III группа (контрольная) состояла из 50 соматически здоровых пациенток с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением данной беременности. Гистологическое и иммуногистохимическое исследования проводилось у 15 пациенток в каждой группе.
Критериями включения в I и II группы были одноплодная, самопроизвольно наступившая беременность, осложнившаяся развитием тяжелой ПЭ, согласно критериям ВОЗ, согласие женщины на участие в исследовании и разрешение локального этического комитета. Критериями включения в III группу контроля были одноплодная спонтанная и физиологически протекавшая беременность, согласие женщины на участие в исследовании. Критериями исключения из исследования были другие гипертензивные расстройства во время беременности, многоплодная беременность, беременность, наступившая в результате вспомогательных репродуктивных технологий, наличие врожденных пороков развития плода, тяжелая соматическая патология у беременной. Все пациенты были родоразрешены путем операции кесарева сечения (критерий включения в исследование).
Получение образцов ткани ПП производилось во время операции кесарева сечения. Образцы ПП были взяты из участка имплантации после отхождения плаценты под непосредственным визуальным контролем. Гистологическое подтверждение того, что биопсийный материал взят из плацентарного ложа, основывалось на наличии вневорсинчатого трофобласта, приросших ворсинок хориона, измененных ремоделированных артерий. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 часов.
После обработки образцов по стандартной унифицированной методике их заливали в парафин. Срезы толщиной 4 мкм готовили на роторных микротомах и окрашивали гематоксилином и эозином. Подсчитывался процент ремоделированных и неремоделированных измененных склерозированных сосудов в эндометрии и миометриии. Иммуногистохимические реакции проводили на серийных депарафинированных срезах толщиной 3–4 мкм. Демаскировка антигенов ткани проводилась в ретривере PTLink фирмы DAKO (Дания) в цитратном буфере pH=6,0в течение 20 мин при температуре 96°C. Для визуализации реакций применяли систему выявления REALTMEnVisionTM («DAKO» Дания). Исследовались следующие маркеры: сосудисто-эндотелиальный фактор роста (VEGF) (мышиные моноклональные антитела,1:100, Abcam), его рецептор (VEGFR), CD34 (мышиные моноклональные антитела,1:100,Cell Marque), гладкомышечный актин (SMA) (мышиные моноклональные антитела,1:100,Dako), инсулиноподобный фактор роста (IGF), его рецептор (IGFR) (кроличьи поликлональные антитела,1:100,Santa Cruz Biotechnology), цитокератин (CKW) (WSS, поликлональные кроличьи антитела,1:500, Dako), Vimentin, фактор, индуцированный гипоксией (HIF-1) (кроличьи моноклональные,1:100,Gene Tex). Результаты оценивали по общепринятой методике подсчета положительных клеток в 300 клеток данного типа и баллах: 2 балла – до 20% положительно окрашенных клеток; 4 балла – от 20 до 40%; 6 баллов – более 40%. Подсчитывали также количество сосудов и количество клеток в 3 полях зрения при х400. Статистическую обработку данных проводили с помощью программы Statistica 8.0. Для оценки межгрупповых различий использовали непараметрические тесты: U-тест Манна–Уитни для двух независимых выборок и χ2. Различия между сравниваемыми величинами считали значимым при p<0,05 и p<0,01. Отношение шансов (OR) приведено с 95% доверительным интервалом.
Результаты исследования
Возраст обследованных в I группе составил 27,20±2,2, во II группе – 33,44±2,5, в III группе – 30,36±4,8 года. Обращает на себя внимание молодой возраст пациенток в I группе, кроме того, у 14 (28%) женщин из I группы беременность наступила в течение 4–6 месяцев; 10 пациенток (20%) в одном браке перенесли во время предыдущей беременности ПЭ, причем одна из них – дважды. Возможно, это связано с иммунологической составляющей патогенеза ПЭ. Известно, что иммунная восприимчивость к плоду возникает после имплантации. После зачатия Т-клетки, взаимодействуя с индоламин-2,3-диоксигеназой, вместе с NK-клетками децидуа, распознают HLA-C плода и способствуют полноценной инвазии трофобласта и нормальной плацентации. Провал этого механизма может стать причиной прерывания беременности на ранних сроках, в то время как частичные нарушения могут привести к неполноценной инвазии трофобласта и послужить причиной плацентарной ПЭ и ЗРП. Также известно, что уже в процессе коитуса происходит воздействие отцовской семенной жидкости и спермы, что способствует выработке толерантности к отцовским антигенам, которые могут экспрессироваться у плода, что тоже, возможно, объясняет развитие плацентарной ПЭ у пациенток с коротким интервалом между коитусом и зачатием в одном браке [15]. Количество первобеременных женщин с ПЭ в обследованных группах составило 38 (76%) и 24 (48%) соответственно.
Средний индекс массы тела (ИМТ) в I группе составил 26,7±1,3, во II – 34,11±1,11, в III – 30,1±1,2. Сравнительный анализ ИМТ в обследованных группах выявил достоверно значимые различия в группах I и II (p<0,05). Пациентки из I и II группы указали на наличие у родственников I линии родства (отец, мать) инфарктов миокарда, инсультов, тромбоэмболических осложнений и гипертонической болезни в возрасте до 50 лет; при этом кардиоваскулярные расстройства встречались достоверно чаще в I группе (р<0,05). При анализе собственных заболеваний сердечно-сосудистой и эндокринной системы, которые проявлялись в виде хронической артериальной гипертензии, сахарного диабета, ожирения, метаболического синдрома выявлена достоверно более высокая их частота во II группе (p<0,05). В структуре исходов предыдущих беременностей у обследованных женщин репродуктивные потери (неразвивающаяся беременность, поздний выкидыш, антенатальная гибель плода в анамнезе, преждевременные роды) достоверно чаще встречались у пациенток I группы (p<0,01). В первом триместре ранний токсикоз, угроза прерывания беременности, ретрохориальные гематомы, активация внутрисосудистого свертывания достоверно чаще имели место у пациенток I группы (p<0,01). Пациентки II группы при постановке на учет достоверно чаще имели повышенное артериальное давление (АД), повышенный ИМТ, кардиоваскулярные расстройства (р<0,05). Во втором триместре повышение АД отмечалось у 31 пациентки I группы (62%), отеки – у 6 беременных (12%), протеинурия – у 21 (42%) женщины, нарушение фето-плацентарного и маточно-плацентарного кровотока (по данным УЗ-допплерометрии), ЗРП – у 21 пациентки (42%) (p<0,01). Сроки повышения АД и появление значимой протеинурии в I группе составили 25,4±3,5 недели и 31,11±4,9 недели, во II группе – 34,1±3,3 недели и 35,7±2,2 недели соответственно. Значения протеинурии в разовой порции мочи составляли в I группе 2,07±0,77 г/л, во II группе – 1,55±0,97 г/л (р<0,05). 5 (10%) беременных из I группы были родоразрешены до 29 недель беременности. Анализ исходов родов в обследованных группах выявил достоверно более высокую частоту ранних преждевременных родов в I группе по сравнению с II и III группами (p<0,01). Сроки родоразрешения составили в I группе 33,1±2,3 недели, во II группе – 38,1±1,0 недели и в III группе – 38,8±1,3 недели (p<0,05).
При анализе антропометрических данных новорожденных средняя масса тела новорожденных в I группе составила 1251,3±172,2 г, во II группе – 3168±205,9 г (p<0,01). Оценка по шкале Апгар на 1-й минуте в I группе составила 6,9±0,8 балла, во II группе -7,8±0,37,в III группе – 7,8±0,38; на 5-й минуте: в I группе – 7,8±0,65 балла, во II группе – 8,8±0,38 балла, в III группе – 8,8±0,38 балла (p<0,01). Недоношенность, респираторный дистресс-синдром, ЗРП достоверно чаще отмечались у пациенток I группы (p<0,05). Неонатальная смертность составила в I группе 2 (4%) случая, во II и III группах зарегистрирована не была. Выписка родильниц из стационара производилась на 8–10-е сутки в I группе, и на 4–6-е сутки – во II группе. При тяжелой ПЭ возможность пролонгирования беременности во II группе составляла от 48 часов до 7 дней, в то время как в I группе – 4–48 часов и была обусловлена необходимостью проведения профилактики респираторного дистресс-синдрома у плода. Необходимость экстренного досрочного родоразрешения в группе с ранней ПЭ чаще была обусловлена выраженными нарушениями состояния плода, такими как реверсный или «нулевой» кровоток по данным допплерометрии и более тяжелыми клиническими проявлениями ПЭ, в то время как в группе с поздним началом ПЭ показаниями к родоразрешению служило нарастание тяжести ПЭ.
Вторым этапом данной работы было изучение морфологических и иммуногистохимических особенностей ПП при ранней и поздней ПЭ.
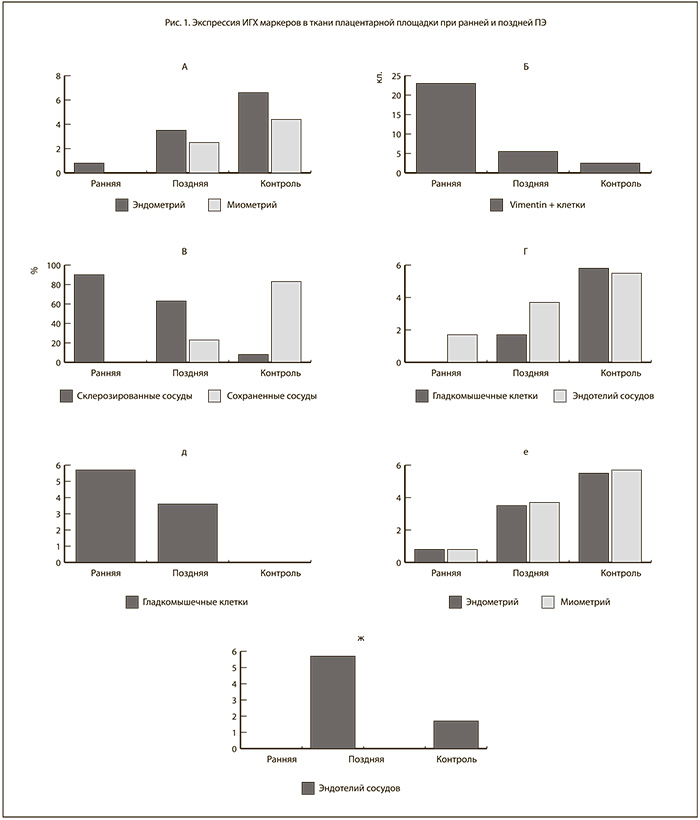
В биоптатах ПП обнаруживались клетки инвазивного цито- и синцитиотрофобласта, располагавшиеся в эндометрии и миометрии, как правило, периваскулярно. Клетки вневорсинчатого трофобласта экспрессировали CKW (рис. 1а, рис. 2в см. на вклейке), что позволяет провести их подсчет в эндометрии и миометрии зоны ПП. Установлено достоверное снижение глубины инвазии и количества клеток вневорсинчатого трофобласта в зоне ПП у пациенток с ПЭ по сравнению с контролем; при этом при ранней ПЭ инвазия трофобласта, как правило, ограничивалась эндометрием, а при поздней форме ПЭ отдельные клетки выявлялись и в миометрии.
Установлено также нарушение ремоделирования спиральных артерий в эндометрии, что совпадает с литературными данными [11]. Ремоделированные спиральные артерии имели широкий просвет и тонкие стенки, не содержащие гладкомышечные элементы. В периваскулярной ткани нами были обнаружены скопления фибробластических Vimentin+ клеток. Неремоделированные артерии характеризовались резким утолщением стенок, очагами атероза, гипертрофией, SMA+ гладкомышечных и фибробластических Vimentin+ клеток, стенозированием их просветов, наличием периваскулярных лимфогистиоцитарных инфильтратов, кровоизлияний и тромбозов сосудов. Обследованные группы характеризовались отличием в соотношении неремоделированных склерозированных, Vimentin+ фиброблатических элементов и сохранных ремоделированных сосудов (рис. 1б, 1в, рис. 2а, 2г см. на вклейке). Количество ремоделированных или сохранных сосудов в группе контроля достоверно выше, чем в группах женщин с ПЭ (р<0,05). При сравнении ранней и поздней ПЭ имелась тенденция к более высокому содержанию склерозированных сосудов: 100% – в I группе с ранней ПЭ, 70% – во II группе с поздней манифестацией ПЭ и 30% – в контрольной группе (рис. 1в, рис. 2а см. на вклейке). Выявлено снижение количества CD34+ в сосудах, экспрессии VEGF и VEGFR при ранней ПЭ, по сравнению с группой с поздним началом ПЭ и группой контроля (р<0,05) (рис. 1г, 1е, рис. 2д см. на вклейке).
В то же время количество SMA+ гладкомышечных клеток, Vimentin+ фибробластических элементов в эндометрии было достоверно выше у женщин с ПЭ (р<0,05), в большей степени – при ранней (р<0,05) (рис. 1б, 1д).
Изучение экспрессии HIF-1α показало низкие значения при ранней ПЭ и повышение показателей при поздней манифестации ПЭ по сравнению с контрольной группой (р<0,05). Возможно, это объясняется тем, что инвазия трофобласта и раннее развитие плаценты происходят в относительно гипоксической окружающей среде до 8–10 недель после оплодотворения, пока не сформируется стабильный плацентарно-эмбриональный кровоток. Гипоксический стимул увеличивает синтез эритропоэтина, факторов ангиогенеза, повышает экспрессию HIF-1α, запускающего цитотрофобластическую инвазию и имеющего решающее значение для развития плаценты. Полученные данные свидетельствуют об отсутствии указанного механизма. Исходя из этого, можно предположить, что ранняя и поздняя формы ПЭ отличаются патогенетическими механизмами компенсации гипоксии, которые отсутствуют при ранней ПЭ (рис. 1ж, рис. 2е см. на вклейке). При трехмерной ангиографии плаценты при ранней ПЭ отмечалось резкое снижение кровотока в маточно-плацентарном бассейне. К наиболее значимым эхографическим признакам следует отнести гипоэхогенность плаценты, отражающую нарушение формирование ворсинчатого дерева (рис. 3а см. на вклейке), при позднем дебюте ПЭ наблюдалось снижение васкуляризации за счет сосудов плодового кровотока (рис. 3б см. на вклейке).
Обсуждение
Проведенное исследование и анализ литературы, позволяют предположить, что развитие ранней и поздней ПЭ протекает по разным патогенетическим механизмам. Для ранней ПЭ характерна неполноценная инвазия трофобласта, нарушение плацентации, нарушение ремоделирования спиральных артерий, гипоксия тканей плаценты и плода, отсутствие компенсаторных механизмов, повышение маркеров эндотелиальной дисфункции. Ранняя ПЭ дебютирует до 34 недель, имеет наиболее тяжелые клинические проявления, ассоциирована с ЗРП, патологическим кровотоком, ранними индуцированными преждевременными родами, невозможностью длительного пролонгирования беременности, чаще возникает у молодых первобеременных женщин, что подтверждается данными литературы. Поздняя ПЭ, напротив, имеет материнскую этиологию и связана в большой степени с соматическим анамнезом, развивается после 34 недель, практически не ассоциирована с ЗРП, прогностически более благоприятна, имеется возможность более длительного пролонгирования беременности на фоне антигипертензивной терапии. Полученные данные гистологического и иммуногистохимического исследования плацентарного ложа от пациенток с ранней и поздней ПЭ позволяют предположить отличия патогенетических механизмом ПЭ: при ранней ПЭ более выражены нарушения ангиогенеза с сохранением гладкомышечных клеток с периваскулярным склерозом, за счет Vimentin+ и SMA+ клеток. Возникающий склероз, в свою очередь, блокирует инвазию цитотрофобласта, приводит к неполноценному ремоделированию и обструктивному повреждению спиральных артерий, снижению ангиогенеза. В свою очередь, склеротические изменения также вызывают хроническую гипоксию, причем при поздней ПЭ имеет место неполная компенсация гипоксии, а при ранней ПЭ компенсации гипоксии нет.
Заключение
Изучение ПЭ в целом, без разделения на раннюю и позднюю формы, может затруднить выяснение патофизиологии данного синдрома и достижение клинически значимых результатов. Клинико-анамнестические, гистологические и иммуногистохимические данные проведенного исследования подтверждают необходимость разделения этого грозного осложнения беременности на раннюю и позднюю формы, которое является обоснованным в плане различных патогенетических механизмов формирования и исходов беременности, а следовательно, и возможности лечебного воздействия, времени пролонгирования беременности, прогнозирования и поиска ранних диагностических маркеров заболевания.



