Проблема сохранения здоровья и профилактика заболеваний, обусловленных старением, приобрела в последние годы особое значение. Одной из актуальных проблем в гинекологии является вульвовагинальная атрофия (ВВА). ВВА в климактерическом периоде – это комплекс симптомов, связанных с развитием атрофических и дистрофических процессов в эстрогензависимых тканях вульвы и влагалища [1].
В отличие от вазомоторных симптомов, которые проходят со временем, симптомы ВВА, как правило, возникают в перименопаузе и прогрессируют в постменопаузальном периоде [2]. У 15% женщин в пременопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВВА [3], такие как сухость влагалища, жжение и зуд, диспареуния и патологические выделения из влагалища [2]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВВА [4]. Большинство из них не обращаются к гинекологу за помощью, считая изменения своего самочувствия частью нормального старения, и не получают необходимую терапию [4, 5]. Вульвовагинальные симптомы могут влиять на аспекты жизни женщин за пределами физического здоровья и субъективных ощущений. Ряд исследований показал, что ВВА снижает качество жизни (КЖ) и оказывает негативное влияние на сексуальное здоровье женщин [6–8]. Каждая третья опрошенная пациентка указала на негативные последствия возникших симптомов для супружеских отношений, каждая четвертая сообщила о снижении самооценки.
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Все клинические рекомендации по лечению ВВА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является локальная гормональная терапия эстрогенами, которая обладает выраженным кольпотропным эффектом. В настоящее время в европейских странах отмечается тенденция к использованию низкодозированных локальных эстрогенов. Известно, что у большинства пациенток в период постменопаузы наблюдается дефицит лактобактерий. В свою очередь степень выраженности атрофии и состояние рН среды согласно индексу Бохмана находятся во взаимосвязи [9]. В связи с этим формирование нормальной микрофлоры – это профилактика вторичного урогенитального инфицирования женщин старшего возраста. До настоящего времени для профилактики вторичной инфекции использовали добавление пробиотиков к препаратам эстриола. Появление препарата, сочетающего гормоны и лактобактерии, вызывает значимый интерес специалистов и исследователей.
Целью исследования стало изучение динамики атрофических изменений слизистой влагалища на фоне применения низкодозированных режимов локальной гормональной терапии у пациенток с ВВА в постменопаузе на основании субъективных и объективных критериев.
Материал и методы исследования
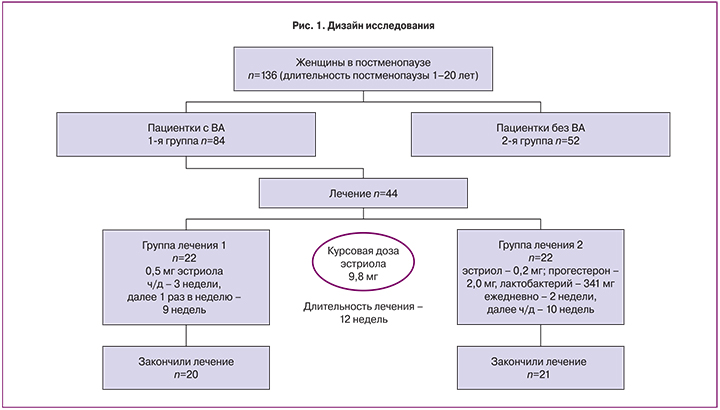
В исследование были включены 44 женщины в постменопаузе, подписавшие информированное согласие на участие, которые были разделены на 2 группы по 22 человека в каждой соответственно. Диагноз ВВА был верифицирован с помощью цитологического метода исследования. Цитологический соскоб стенки влагалища производили из верхней трети с помощью урогенитального зонда. В дальнейшем вагинальный мазок подвергали окрашиванию согласно технике по Папаниколау и подсчету индекса созревания эпителия влагалища (ИСЭВ). ИСЭВ рассчитывали на основе процентного соотношения эпителиальных клеток: поверхностных; промежуточных; базальных и парабазальных: ИСЗВ = 0,5 × кол-во промежуточных клеток(%)+ 1 × кол-во поверхностных клеток (%); (Норма – ≥ 65%; <65 – вагинальная атрофия).
Критериями исключения были гормонзависимые опухоли, патология эндометрия и шейки матки, инфекции, передающиеся половым путем, применение системной и/или местной МГТ в течение последних 6 месяцев, системная и местная антибактериальная терапия в течение 1 месяца до начала проведения исследования, склерозирующий лихен и сахарный диабет.
Пациенткам с ВВА проведено лечение и наблюдение в течение 3 месяцев. С помощью блочной рандомизации пациентки были разделены на 2 группы по 22 человека в каждой. Для лечения ВВА у первой группы применяли препарат, в состав которого входит эстриол в дозировке 0,5 мг. Второй группе был предложен препарат, содержащий лиофилизированную культуру лактобактерий L. casei rhamnosus Doderleini – 341 мг; эстриол – 0,2 мг; прогестерон – 2,0 мг. Для пациенток обеих групп были разработаны схемы лечения с одинаковой курсовой дозой эстриола, составившей 9,8 мг:
- 1-я группа: 0,5 мг эстриола через день – 3 недели, после по 0,5 мг 1 раз в неделю – 9 недель;
- 2-я группа: лиофилизированная культура лактобактерий L. casei rhamnosus Doderleini – 341 мг; эстриол – 0,2 мг; прогестерон – 2,0 мг ежедневно – 14 дней, далее через день – 10 недель.
Исходно и в конце лечения всем пациенткам проводили цитологическое исследование стенки влагалища, рН-метрию, ПЦР-диагностику количественного определения общей бактериальной массы и структуры микробиоценоза влагалища путем количественного определения Lactobacillus spp.; Enterobacteriaceae; Staphylococcus spp.; Enterococcus spp.; Prevotella bivia/Porphyromonas spp.; Eubacterium spp.; Sneathia spp./Leptotrichia spp./Fusobacterium spp.; Megasphaera spp./Veillonella spp./Dialister spp.; Lachnobacterium spp./Clostridium spp.; Mobiluncus spp./Corynebacterium spp.; Peptostreptococcus spp.; Atopobium vaginae; Mycoplasma hominis; Ureaplasma urealyticum; Streptococcus spp.; Streptococcus agalactiae; Gardnerella vaginalis; Mycoplasma genitalium; Ureaplasma parvum; Actinomycetes spp.; Bifidobacterium; Anaerococcus spp.; S. aureus; E. coli; Candida spp.; Candida albicans. Дополнительно оценивали структуру лактофлоры путем определения L. crispatus; L. acidophilus; L. iners; L. jensenii; L. gasseri; L. johnsonii; L. vaginalis.
 Для оценки выраженности атрофических процессов применяли «Индекс вагинального здоровья» (ИВЗ), имеющий балльную оценку (G. Bochman) и основанный на визуальной оценке состояния слизистой влагалища. Этот метод позволяет определить состояние вагинального здоровья с помощью оценки влажности, объема вагинальной жидкости, эластичности, целостности слизистой оболочки и рН влагалища по шкале от 1 (плохо) до 5 (хорошо).
Для оценки выраженности атрофических процессов применяли «Индекс вагинального здоровья» (ИВЗ), имеющий балльную оценку (G. Bochman) и основанный на визуальной оценке состояния слизистой влагалища. Этот метод позволяет определить состояние вагинального здоровья с помощью оценки влажности, объема вагинальной жидкости, эластичности, целостности слизистой оболочки и рН влагалища по шкале от 1 (плохо) до 5 (хорошо).
Статистическую обработку данных проводили с помощью IBM SPSS STATISTICS 22 for Windows с вычислением средней арифметической и ее стандартной ошибки (M±m). Для оценки межгрупповых различий использовали непарамерические тесты: U Манна–Уитни и Колмогорова–Смирнова для двух независимых выборок. Для зависимых выборок применялся критерий t Стьюдента. Различия между величинами считали статистически значимыми при уровне достоверности p<0,05.
Дизайн исследования представлен на рис. 1.
Результаты исследования
Из 44 пациенток трехмесячный курс лечения закончили 41 (93%). Две пациентки (9%) из первой группы и одна пациентка из второй группы (4,5%) прекратили прием препаратов в связи с побочными явлениями. Причиной отказа от приема терапии в первой группе послужили жалобы на зуд во влагалище (4,5%) и обострение цистита (4,5%). Во 2-й группе пациентка также прекратила прием препарата в связи с появлением зуда во влагалище (4,5%).
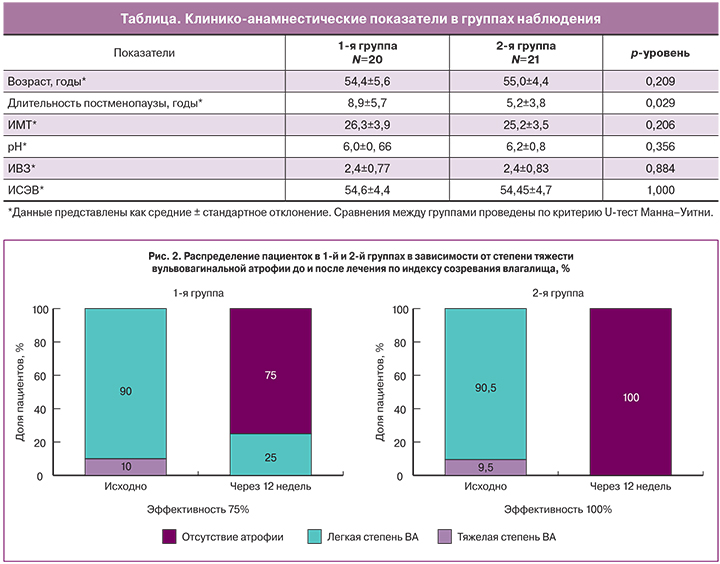
Согласно полученным данным, ИСЭВ и рН влагалища при включении составили 54,6±4,4 и 6,0±0,66 в первой группе и 54,45±4,7 и 6,2±0,8 во второй группе. Пациентки двух групп были сопоставимы по возрасту, ИМТ, однако отличались по длительности постменопаузы. Длительность постменопаузы в первой группе была больше (таблица).
На фоне проведенной терапии отмечены изменения как субъективных, так и объективных критериев степени тяжести атрофических процессов во влагалище.
На фоне применения препаратов в обеих группах отметили восстановление эпителия влагалища: уменьшение базальных, парабазальных, промежуточных клеток и статистически значимое увеличение поверхностных клеток (p<0,0001). После 3 месяцев терапии в группах наблюдения отмечена высокая эффективность препаратов по параметру ИСЭВ. В 1-й группе ИСЭВ в среднем составил 76,8±12,9 (p<0,0001), во 2-й группе – 79,4±19,6 (p<0,0001).
Однако в 1-й группе у 25% пациенток с легкой степенью атрофии наблюдался недостаточный эффект от проведенной терапии. У данных женщин отмечено увеличение ИСЭВ, который, однако, не достиг по окончании курса терапии референсных значений и продолжал находиться в диапазоне 49–64,9, что соответствовало легкой степени атрофии. Во 2-й группе после лечения отмечено отсутствие атрофии у 100% пациенток (рис. 2).
Повторный анализ рН влагалища показал статистически значимое снижение данного показателя по сравнению с исходными параметрами, в 1-й группе он составил 4,7±0,4, а во 2-й – 4,5±0,3 (p<0,0001), что свидетельствует о нормализации кислотно-щелочного баланса.
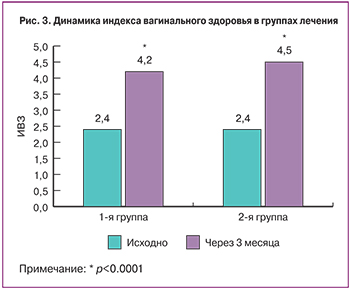
У пациенток с ВВА до начала лечения слизистая влагалища была истончена, легко травмировалась, кровоточила при контакте и/или соскабливании, отмечалось наличие петехиальных кровоизлияний, признаков воспаления, снижение эластичности вагинальной стенки и уменьшения транссудата. Исходно ИВЗ в 1-й группе в среднем составил 2,4±0,77, а во 2-й – 2,4±0,83. После проведенного лечения состояние слизистой влагалища улучшилось, ИВЗ в 1-й группе через 12 недель составил 4,2±0,72 (p<0,0001), а во 2-й – 4,5±0,51 (p<0,0001) (рис. 3).
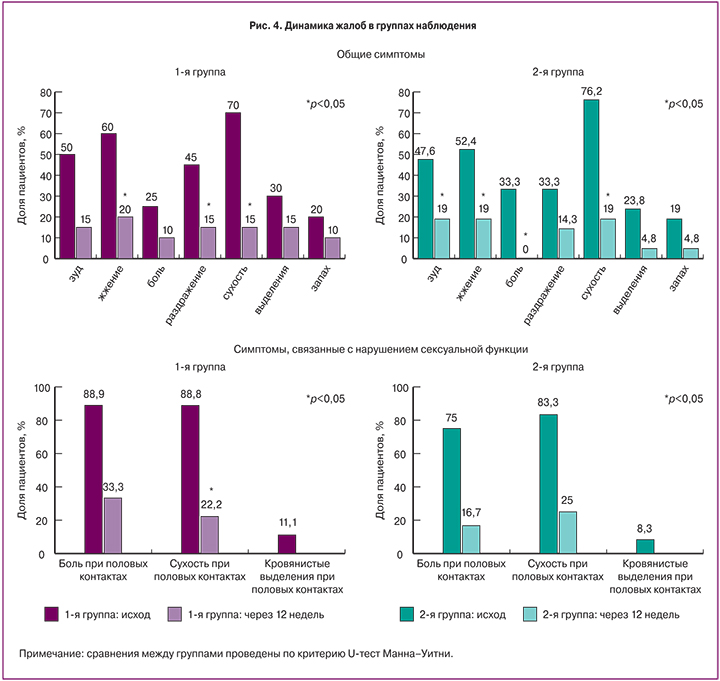
Динамика жалоб пациентов, принимающих эстриол-содержащие препараты, представлена на рис. 4.
Результаты исследования показывают, что наиболее частой жалобой в обеих группах была сухость влагалища. Важно отметить, что после лечебного курса все пациентки отметили улучшение своего состояния, облегчение или отсутствие жалоб симптомов атрофии влагалища. Как видно из представленных в таблице данных, в группах лечения пациентки были сопоставимы по частоте встречаемости жалоб как до, так и после лечения. Полученные данные свидетельствуют об эффективном снижении клинических симптомов ВВА на фоне использования низкодозированного режима локальной терапии эстриол-содержащим препаратами.
 При анализе жалоб по 5-балльной шкале D. Barlow мы отметили снижение интенсивности симптомов на фоне проведенной терапии в обеих группах. В 1-й группе исходно интенсивность симптомов составила 2,05±1,3, после лечения 1,57±1,3 (p=0,135). Во 2-й группе исходно интенсивность симптомов составила 2,04±1,43, после лечения – 0,95±1,32 (p=0,013).
При анализе жалоб по 5-балльной шкале D. Barlow мы отметили снижение интенсивности симптомов на фоне проведенной терапии в обеих группах. В 1-й группе исходно интенсивность симптомов составила 2,05±1,3, после лечения 1,57±1,3 (p=0,135). Во 2-й группе исходно интенсивность симптомов составила 2,04±1,43, после лечения – 0,95±1,32 (p=0,013).
Для оценки эффективности терапии и понимания особенностей воздействия эстриол-содержащих препаратов на микробиоценоз влагалища была проведена ПЦР-диагностика вагинальных мазков. Микрофлора влагалища у женщин в постменопаузе в основном была представлена факультативно-анаэробными (аэробными) микроорганизмами: семейство Enterobacteriaceae; Staphylococcus spp.; Streptococcus spp. и облигатно-анаэробными микроорганизмами: Prevotella bivia/Porphyromon as spp., Eubacterium spp., Megasphaera spp./Veillonella spp./Dialister spp., Lachnobacterium spp./Clostridium, Mobiluncus spp./Corynebacterium, Peptostreptococcus spp. ДНК Mycoplasma genitalium и Candida spp. не были обнаружена ни в одном из образцов. По данным ПЦР-диагностики, на фоне терапии увеличилась общая бактериальная масса (ОБМ) в группах лечения по сравнению с исходными данными (1-я группа: исходно – 5,3 (4–6,9), через 3 мес. – 6,9 (5,8–7,4), р=0,025; 2-я группа: исходно – 5,5 (4,7–6,7), через 3 мес. – 6,8 (6,4–7), р=0,004). В 1-й группе на фоне терапии уменьшилась доля УПМ: семейство Enterobacteriaceae (р=0,013), Prevotella bivia/Porphyromonas spp. (р=0,05), Megasphaera spp./Veillonella spp./Dialister spp. (р=0,042), Mobiluncus spp./Corynebacterium spp. (р=0,037). Во 2-й группе по мере элиминации анаэробов происходило заселение влагалища лактобациллами. Статистический анализ полученных во 2-й группе данных показал значимое уменьшение Eubacterium spp. (р=0,028), Megasphaera spp./Veillonella spp./Dialister spp. (р=0,046), Actinomycetes spp.
(р=0,046), увеличение L. gasseri (р=0,001), L. johnsonii (р=0,001), L. vaginalis (р=0,002). Согласно результатам нашего исследования, микробиоценоз слизистой оболочки влагалища исходно у женщин в группах лечения характеризовался резким снижением количества лактобактерий (1-я группа – 0,0% (0,0–89,9); 2-я группа – 0,0% (0,0–2,8)). После проведенного курса лечения произошло восстановление лактофлоры (1-я группа – 17,9% (0,0–99,9%), р=0,178; 2-я группа – 86% (8,0–99,2%), р=0,014). На фоне увеличение доли лактобактерий наблюдали снижение количества условно-патогенных микроорганизмов. Важно отметить, что к концу лечебного курса нами было принято ввести понятия «условного нормоценоза и дисбиоза» (нормоценоз – доля Lactobacillus spp. больше 80% от ОБМ и дисбиоз соответственно меньше 80% от ОБМ). Следует отметить, что увеличивалась частота выявления нормоценоза в исследуемых группах (рис. 5): в 1-й группе частота встречаемости нормоценоза увеличилась лишь на 10%, в то время как во 2-й группе лечения комбинированным препаратом – почти на 40%, однако не было статистически значимых различий, что, вероятно, связано с небольшой выборкой групп лечения.
Обсуждение
Известно, что у женщин слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базального; парабазального; промежуточного гликогенсодержащего; поверхностного слоя с пикнотическими ядрами [10]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [11]. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия влагалищной стенки, а следовательно, и пролиферацию влагалищного эпителия [12], что приводит к истончению эпителия влагалища, снижению ИСВЭ. По мере снижения пролиферативных процессов во влагалищном эпителии происходит исчезновение гликогена – питательной среды для лактобактерий, что приводит к изменению характера влагалищного секрета, повышению рН и элиминации лактофлоры.
Принимая во внимание патогенез ВВА, терапия локальными эстрогенами является золотым стандартом лечения, что позволяет избежать большинства системных побочных эффектов [3, 5, 13, 14]. Многочисленные исследования показали, что ежедневное применение локального эстриола в дозе 0,5 мг оказывает заметный пролиферативный эффект на эпителий влагалища. В России в качестве средств первой линии лечения ВВА рекомендуют препараты, содержащие 0,5 мг эстриола [15]. В нашей работе мы применили нестандартные схемы лечения с одинаковой курсовой дозой эстриола, составившей 9,8 мг, что в 2 раза ниже рекомендуемой курсовой дозы. Несмотря на низкодозированный режим локальной терапии в примененных схемах лечения, оба препарата продемонстрировали высокую эффективность. Также терапия эстриол-содержащими препаратами способствовала увеличению количества лактобактерий в составе микробиоценоза влагалища, но на фоне применения комбинированного препарата отмечено более выраженное повышение их количества. Таким образом, использование низкодозированного режима локальной терапии эстриолом показало высокую эффективность, сопоставимую с результатами, полученными при использовании стандартных схем лечения. Результаты данного исследования также показали улучшение субъективных симптомов ВВА.
Низкодозированная локальная гормональная терапия способствовала уменьшению/устранению вагинальных симптомов в двух группах, но значимое снижение интенсивности симптомов наблюдалось только во 2-й группе, что, на наш взгляд, можно объяснить комбинированным составом препарата.
В ряде случаев проведенное лечение было недостаточным для полного устранения симптомов в группах лечения, поэтому таким пациенткам может быть рекомендована более длительная поддерживающая терапия локальными гормональными препаратами.
Заключение
Локальная гормональная терапия эстрогенами является наиболее эффективным методом лечения ВВА. Использование низкодозированных режимов локальной терапии эстриолом достаточно для восстановления эпителия влагалища, что подтверждается статистически значимым повышением ИСЭВ и ИВЗ. Важно отметить, что в группе женщин, которые принимали комбинированное лекарственное средство, по окончанию лечения частота встречаемости нормоценоза была значимо выше по сравнению с группой, получившей монотерапию эстриолом. Возможно, это обусловлено благоприятным эффектом, оказанным лактобактериями, входящими в состав препарата, которые усиливали происходящие изменения. Применение низкодозированной локальной терапии эстриолом способствует снижению рН и постепенной редукции вагинальных симптомов. Быстрое восстановление микробиоценоза влагалища способствует более эффективному снижению интенсивности вагинальных симптомов, что оказывает положительное влияние на самочувствие женщин в постменопаузе.



