Преэклампсия (ПЭ) осложняет 2–8% беременностей и продолжает оставаться в центре внимания исследователей не только в связи с вызванной ею материнской и перинатальной смертностью и заболеваемостью, но и с тяжелыми последствиями для женщины и ребенка [1]. В настоящее время не вызывает сомнение факт наличия двух фенотипических вариантов данного гетерогенного мультисистемного заболевания: ранней (до 34 нед. беременности) и поздней (после 34 нед. беременности), что определяет ближайшие и отдаленные исходы беременности [2–6].
Плацента и плацентарная площадка (ПП) при ПЭ изучены в единичных работах, в которых не сопоставлялись ранняя и поздняя ПЭ [7, 8]. Вместе с тем уровень современных знаний требует углубленных исследований в этом направлении и сопоставления полученных результатов с клинико-анамнестическими особенностями при указанной патологии беременности.
Цель исследования: выявление клинико-патоморфологических параллелей при ранней и поздней ПЭ на основании комплексного обследования беременных с учетом морфологической и иммуногистохимической характеристик плаценты и ПП.
Материал и методы исследования
Проведен анализ клинико-анамнестических данных 150 беременных, которые были разделены на 3 группы: I группу составили 50 пациенток с ранней ПЭ, II группа – 50 пациенток с поздней ПЭ; III группа (контрольная) состояла из 50 соматически здоровых пациенток с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением данной беременности. Гистологическое и иммуногистохимическое исследования ПП проводились у 15 пациенток в каждой группе (n=45), плаценты – у 18 пациенток в каждой группе (n=54).
Критериями включения в I и II группы были одноплодная, самопроизвольно наступившая беременность, осложнившаяся развитием ПЭ, согласно критериям ВОЗ, согласие женщины на участие в исследовании и разрешение локального этического комитета. Критериями включения в III группу контроля были одноплодная спонтанная и физиологически протекавшая беременность, согласие женщины на участие в исследовании. Критериями исключения из исследования являлись другие гипертензивные расстройства во время беременности, многоплодная беременность, беременность, наступившая в результате вспомогательных репродуктивных технологий, наличие врожденных пороков развития плода, тяжелая соматическая патология у беременной. Все пациенты были родоразрешены путем операции кесарева сечения (критерий включения в исследование).
После макроскопического изучения последов из центральной зоны плаценты вырезали кусочки ткани, которые фиксировали в 10% нейтральном формалине. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином. Иммуногистохимические исследования проводили по стандартной методике с использованием готовых к употреблению кроличьих поликлональных антител к сосудисто-эндотелиальному фактору роста (VEGF), его рецептору (VEGFR-2) (Flk-1) и полимерной системы детекции производства Spring Bioscience. Предварительную демаскировку антигена проводили путем кипячения образцов в растворе цитратного буфера с pH=6,0. Блокирование эндогенной пероксидазы осуществляли путем обработки срезов 0,3% раствора перекиси водорода в течение 15 минут. В качестве фонового красителя использовали гематоксилин. Количественную оценку экспрессии изученных маркеров проводили по уровню оптической плотности иммуногистохимической реакции в синцитиотрофобласте, эндотелиоцитах капилляров и мезенхиме терминальных ворсин плаценты при помощи системы анализа изображения на базе микроскопа «Аxio Imager M1» с использованием программы «AxioVision» (Carl Zeiss). Получение образцов ткани ПП производилось во время операции кесарева сечения. Образцы ПП были взяты из участка имплантации после отхождения плаценты под непосредственным визуальным контролем. Гистологическое подтверждение того, что биопсийный материал взят из плацентарного ложа, основывалось на наличии вневорсинчатого трофобласта, приросших ворсинок хориона, измененных ремоделированных артерий. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 часов. После обработки образцов по стандартной унифицированной методике их заливали в парафин. Срезы толщиной 4 мкм готовили на роторных микротомах и окрашивали гематоксилином и эозином. Подсчитывался процент ремоделированных и неремоделированных измененных склерозированных сосудов в эндометрии и миометриии. Иммуногистохимические реакции проводили на серийных депарафинированных срезах толщиной 3–4 мкм. Демаскировка антигенов ткани проводилась в ретривире PTLink фирмы DAKO (Дания) в цитратном буфере pH=6,0в течение 20 мин при температуре 96C. Для визуализации реакций применяли систему выявления REALTMEnVisionTM («DAKO» Дания). Исследовались следующие маркеры: VEGF (мышиные моноклональные антитела,1:100, Abcam), VEGFR, CD34 (мышиные моноклональные антитела,1:100,Cell Marque), гладкомышечный актин (SMA) (мышиные моноклональные антитела,1:100,Dako), инсулиноподобный фактор роста (IGF), его рецептор (IGFR) (кроличьи поликлональные антитела,1:100,Santa Cruz Biotechnology), цитокератин (CKW) (WSS, поликлональные кроличьи антитела,1:500, Dako), Vimentin, фактор, индуцированный гипоксией (HIF-1) (кроличьи моноклональные, 1:100, Gene Tex). Результаты оценивались по общепринятой методике подсчета положительных клеток в 300 клеток данного типа и баллах: 2 балла до 20% положительно окрашенных клеток; 4 балла от 20 до 40%; 6 баллов более 40%. Подсчитывалось также количество сосудов и количество клеток в 3 полях зрения при х400. Статистическая обработка данных проводилась с помощью программы Statistica 8.0. Для оценки межгрупповых различий использовались непараметрические тесты: U-тест Манна–Уитни для двух независимых выборок и χ2. Различия между сравниваемыми величинами считали значимым при p<0,05 и p<0,01. Отношение шансов (OR) приведено с 95% доверительным интервалом.
Результаты исследования и обсуждение
Клинико-анамнестическая характеристика обследованных пациенток представлена в таблице.
Возраст обследованных в I группе составил 27,20±2,2 года, во II группе – 33,44±2,5 года, в III группе – 30,36±4,8 года. Обращает на себя внимание молодой возраст пациенток (18–20 лет) в I группе, который составил 10% (n=5), кроме того у 14 (28%) женщин из I группы беременность наступила в течение 4–6 месяцев; 10 пациенток (20%) в одном браке перенесли во время предыдущей беременности ПЭ, причем одна из них – дважды. Возможно, это связано с иммунологической составляющей патогенеза ПЭ. Количество первобеременных женщин с ПЭ в обследованных группах составило 38 (76%) и 24 (48%) соответственно.
Средний индекс массы тела (ИМТ) в I группе составил 26,7± 1,3, во II – 34,11±1,11, в III – 30,1±1,2; сравнительный анализ ИМТ в обследованных группах выявил достоверно значимые различия в группах II и I (p<0,05). Пациентки из I и II группы указали на наличие у родственников I линии родства (отец, мать) инфарктов миокарда, инсультов, тромбоэмболических осложнений и гипертонической болезни в возрасте до 50 лет, при этом кардиоваскулярные расстройства встречались достоверно чаще в I группе (р<0,05). При анализе собственных заболеваний сердечно-сосудистой и эндокринной системы, которые проявлялись в виде хронической артериальной гипертензии, сахарного диабета, ожирения, метаболического синдрома выявлена достоверно более высокая их частота во II группе (p<0,05). Пациенты II группы достоверно чаще имели при постановке на учет повышенное артериальное давление (АД), повышенный ИМТ, кардиоваскулярные расстройства (р<0,05). Во втором триместре повышение АД отмечалось у 31 пациентки I группы (62%), отеки – у 6 беременных (12%), протеинурия – у 21 (42%) женщины, нарушение фето-плацентарного и маточно-плацентарного кровотока (по данным допплерометрии), синдрома задержки роста плода – у 21 пациентки (42%) (p<0,01). Сроки значимого повышения АД и появление выраженной протеинурии в I группе составили 25,4±3,5 нед. и 31,11±4,9 нед., во II группе – 34,1±3,3 нед. и 35,7±2,2 нед., соответственно. Значения протеинурии в разовой порции мочи составляли в I группе 2,07±0,77 г/л, во II – 1,55±0,97 г/л (р<0,05). 5 (10%) беременных из I группы были родоразрешены до 29 недель беременности. Анализ исходов родов в обследованных группах выявил достоверно более высокую частоту ранних преждевременных родов в I группе, по сравнению с группами II и III (p<0,01). Сроки родоразрешения в обследованных группах составили: в I – 33,1±2,3 нед., во II – 38,1±1,0 нед., в III – 38,8±1,3 нед. (p<0,05).
При оценке длительности пролонгирования беременности и эффективности проводимой антигипертензивной терапии при тяжелой ПЭ в обследованных группах во II группе возможность пролонгирования беременности составляла от 48 часов до 7 дней, в то время как в I группе возможность пролонгирования беременности составляла 4–48 часов и была обусловлена необходимостью проведения профилактики респираторного дистресс-синдрома у плода. Необходимость экстренного досрочного родоразрешения в группе с ранней ПЭ чаще была обусловлена выраженными нарушениями состояния плода, такими как реверсный или «нулевой» кровоток по данным допплерометрии и более тяжелыми клиническими проявлениями ПЭ, в то время как в группе с поздней ПЭ показаниями к родоразрешению служило нарастание тяжести ПЭ. При анализе антропометрических данных новорожденных, средняя масса тела новорожденных в I группе составила 1251,3±172,2 г, во II – 3168±205,9 г, (p<0,01). Оценка по шкале Апгар на 1-й минуте в I группе составила 6,9±0,8, во II – 7,8±0,37, в III – 7,8±0,38 балла; на 5-й минуте в I группе – 7,8±0,65, во II – 8,8±0,38, в III – 8,8±0,38 балла (p<0,01).
Недоношенность, респираторный дистресс-синдром, задержка роста плода, достоверно чаще отмечались у пациенток I группы (p<0,05). Неонатальная смертность составила в I группе 2 (4%) случаев, в II и III группах зарегистрирована не была. Выписка родильниц из стационара производилась на 8–10-е сутки в I группе, и на 4–6-е сутки во II группе.
Вторым этапом данной работы было морфологическое и иммуногистохимическое изучение плаценты и ПП при ранней и поздней ПЭ.
В гистологических препаратах плаценты контрольной группы, окрашенных гематоксилином и эозином, ворсинчатое дерево в основном было представлено терминальными ворсинами, порядка 20–30% его площади составляли зрелые промежуточные ворсины. В целом строение ворсинчатого дерева соответствовало сроку беременности. Имелось небольшое количество синцитиальных узелков, отражающих компенсаторно-приспособительные процессы, а также отмечались умеренные отложения фибриноида, преимущественно вокруг стволовых ворсин, и мелкие фокусы кальциноза в области базальной пластинки.
Нами было установлено преобладание процессов разветвленного ангиогенеза в структуре ворсин: множество мелких терминальных ворсин с многочисленными синцитио-капиллярными мембранами и большим количеством синцитиальных почек. Кроме того, в большинстве изученных нами наблюдений установлены нарушения плацентарного кровообращения в виде мелких тромбов в сосудах хориальной пластинки и стволовых ворсин, а также многочисленных мелких инфарктов ворсинчатого дерева. Несколько чаще инфаркты в области плацентарных септ и периворсинчатые отложения фибриноида отмечались при ранней преэклампсии.
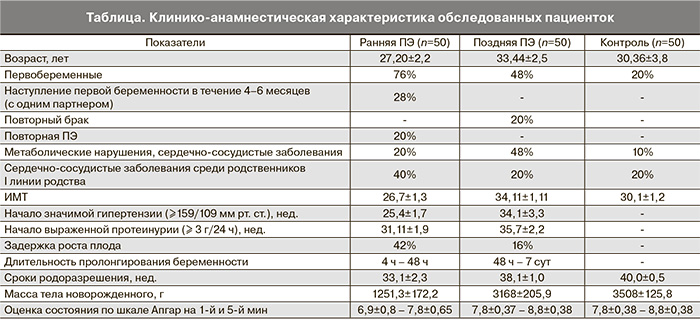
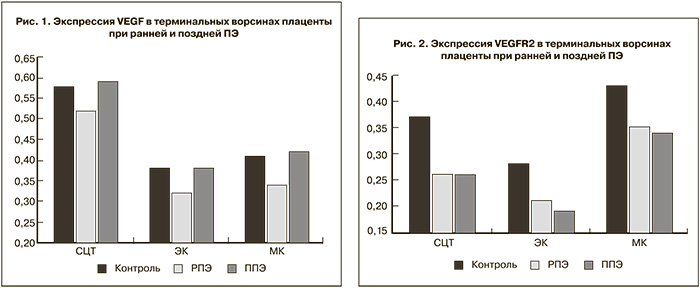
При иммуногистохимическом анализе препаратов плаценты контрольной группы выявлена цитоплазматическая локализация VEGF во всех клеточных элементах терминальных ворсин. В контрольной группе максимальный уровень экспрессии VEGF отмечался в синцитиотрофобласте терминальных ворсин и превышал показатели эндотелиальных и мезенхимальных клеток на 52,6 и 41,5% соответственно (рис. 1). Более выраженная интенсивность реакции с VEGFR-2 была зарегистрирована в мезенхимальных клетках (на 16,2 и 53,6% больше, чем в синцитиотрофобласте и эндотелиоцитах капилляров) (рис. 2). В плацентах у женщин, страдавших ранней ПЭ, установлены более низкие значения экспрессии VEGF и VEGFR-2, что может указывать на недостаточность процессов инвазии трофобласта. Наиболее выраженное снижение VEGF (на 17,1% по сравнению с контрольными показателями) наблюдается в мезенхимальных клетках, а VEGFR-2 в синцитиотрофобласте на 29,7%. При этом синцитиально-эндотелиальный коэффициент экспрессии VEGF на 6,5% превышал, а у VEGFR-2, наоборот, был на 6,1% ниже контрольных значений.
При поздней ПЭ показатели экспрессии VEGF в эндотелиальных клетках капилляров терминальных ворсин не отличались от значений контрольной группы, а в синцитиотрофобласте и мезенхимальных клетках терминальных ворсин даже несколько их превышали (на 1,7 и 2,4% соответственно). Отсутствие корреляции между уровнем экспрессии VEGF при поздней ПЭ и группой контроля указывает на отсутствие влияния данного фактора ангиогенеза на развитие поздней ПЭ
Одновременно с этим отмечается снижение уровня экспрессии VEGFR-2, причем более выраженное, чем в наблюдениях ранней ПЭ. Так, интенсивность реакции VEGFR-2 в эндотелиальных клетках меньше контрольного уровня на 32,1%, а в мезенхимальных – на 20,9%. При этом значения синцитиально-эндотелиального коэффициента экспрессии VEGF несколько превышают контрольные показатели, но ниже, чем у пациенток с ранней ПЭ. Соответствующий коэффициент экспрессии VEGFR-2 больше по сравнению с группами контроля и ранней ПЭ. Исходя из этого можно сделать вывод, что поздняя ПЭ, видимо, не связана с нарушением механизмов инвазии и плацентации, что согласуется с данными ряда авторов [2–6]. Напротив, ПЭ, развившаяся до 34 недель беременности, связана с недостаточной инвазией трофобласта, нарушениями ремоделирования маточно-плацентарных сосудов. При этом наблюдается более тяжелое течение заболевания, и единственным эффективным методом лечения является досрочное родоразрешение.
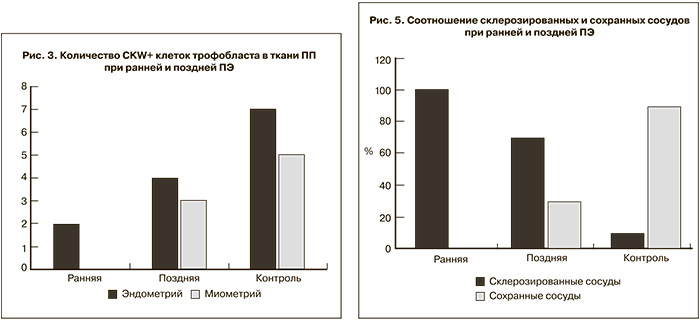
В биоптатах ПП обнаруживались клетки инвазивного цито- и синцитиотрофобласта, располагавшиеся в эндометрии и миометрии, как правило периваскулярно. Клетки вневорсинчатого трофобласта экспрессировали CKW (рис. 3), что позволяет провести их подсчет в эндометрии и миометрии зоны ПП. Установлено достоверное снижение глубины инвазии и количества клеток вневорсинчатого трофобласта в зоне ПП у пациенток с ПЭ по сравнению с контролем, при этом при ранней ПЭ инвазия трофобласта, как правило, ограничивалась эндометрием, а при поздней форме ПЭ отдельные клетки выявлялись и в миометрии.
Выявленное нарушение ремоделирования спиральных артерий в эндометрии совпадает с литературными данными [9–11]. Ремоделированные спиральные артерии имели широкий просвет и тонкие стенки, не содержащие гладкомышечные элементы. Количество ремоделированных или сохранных сосудов в группе контроля достоверно выше, чем в группах женщин с ПЭ (р<0,05).
Изучение экспрессии HIF-1α показало низкие значения при ранней ПЭ и повышение показателей при поздней манифестации ПЭ по сравнению с контрольной группой (р<0,05). Возможно, это объясняется тем, что инвазия трофобласта и раннее развитие плаценты происходят в относительно гипоксической окружающей среде до 8–10-й недели после оплодотворения, пока не сформируется стабильный плацентарно-эмбриональный кровоток [12]. Гипоксический стимул увеличивает синтез эритропоэтина, факторов ангиогенеза, повышает экспрессию HIF-1α, запускающего цитотрофобластическую инвазию и имеющего решающие значение для развития плаценты. Полученные данные свидетельствуют об отсутствии этого механизма. Исходя из этого, можно предположить, что ранняя и поздняя формы ПЭ отличаются патогенетическими механизмами компенсации гипоксии, которые отсутствуют при ранней ПЭ (рис. 4 см. на вклейке). При сравнении ранней и поздней ПЭ имелась тенденция к более высокому содержанию склерозированных сосудов: в 100% случаев в I группе с ранним началом заболевания; во II группе с поздней манифестацией ПЭ – в 70% и в группе контроля – в 30% соответственно (рис. 5). Выявлено снижение количества CD34+ в сосудах, экспрессии SMA, экспрессии VEGF и VEGFR при ранней ПЭ, по сравнению с группой с поздним началом ПЭ и группой контроля (р<0,05) (рис. 6 см. на вклейке).
Заключение
Представленные данные подтверждают гетерогенный генез ПЭ, различную степень участия одних и тех же путей патогенеза и, таким образом, обоснованность выделения двух фенотипических вариантов. Кроме того, иммуногистохимические исследования плаценты и ПП при ранней и поздней ПЭ в сопоставлении с клиническими данными позволяют определить сроки и тяжесть деструктивных процессов, определяющих не только дебют развития ПЭ, но и вовлеченность фето-плацентарного комплекса с последующим развитием задержки роста плода. Продолжающиеся исследования, вероятно, позволят определить диагностическую и прогностическую панель маркеров ранней ПЭ, разработать эффективные превентивные меры относительно трансформации умеренной ПЭ в тяжелую, таргетные лечебные мероприятия, что в целом позволит достичь клинически значимых результатов.



