Период беременности у каждой женщины сопровождается значимыми изменениями в нейроэндокринной регуляции, структурно-функциональной перестройкой сердечно-сосудистой
системы и метаболическими отклонениями. Физиологические сдвиги развиваются поэтапно в соответствии с гестационным периодом. При различных формах артериальной гипертензии (АГ) во время беременности закономерно ожидать, что динамика этих изменений может варьироваться.
В настоящее время патогенез АГ, в том числе гестационной АГ, представляется достаточно сложным, многоуровневым и до конца не изученным. Вместе с тем существуют данные, позволяющие утверждать, что развитию АГ у беременных способствует снижение уровня внутриклеточного магния [8, 21, 27]. Одним из наиболее обоснованных способов коррекции сосудистых нарушений на этапе «доклинических» признаков гипертензивных осложнений является терапия препаратами магния. В клинической практике такая комбинация используется редко, так как нет единого мнения о ее рациональности.
Данное исследование посвящено изучению состояния сердечно-сосудистой системы и метаболического статуса у беременных с АГ на протяжении всего гестационного периода с акцентом на «предклинические» признаки ассоциированных с гипертензией осложнений, а также оценке перспектив применения препаратов магния в группе женщин с высоким риском развития преэклампсии.
Материал и методы исследования
Работа проводилась в амбулаторных условиях с участием женщин на этапе «благополучного» течения беременности. В конце I, во II (20–22 нед) и III (30–32 нед) триместрах беременным проводили клинико-лабораторные исследования, суточное мониторирование АД (СМАД), эхокардиографию (ЭхоКГ). Ретроспективно анализировали исходы беременности и родов.
Беременные с различными формами АГ – 377 женщин в возрасте от 18 до 42 лет (Me 28 лет) – были распределены в четыре группы в соответствии с современной классификацией АГ у беременных [6]: 146 пациенток, у которых АГ была диагностирована до беременности, т.е. беременные с хронической АГ (ХАГ), или гипертонической болезнью (ГБ) ; беременные с исходно нормальным уровнем артериального давления (АД), у которых после 20-й нед развилась гестационная АГ (ГАГ) – 56 женщин или преэклампсия (ПЭ) – 61 женщина, а также 114 пациенток с ХАГ, у которых к концу беременности присоединились признаки преэклампсии (ХАГ+ПЭ). Группу сравнения составили 50 женщин с физиологическим течением беременности (ФБ) (табл. 1).
Таблица 1. Характеристика пациенток, включенных в исследование.
В группах ХАГ, ПЭ и ХАГ+ПЭ пациентки были старше по возрасту и исходно имели избыточную массу тела. Отягощенная наследственность по АГ в группах с гипертензивным синдромом различного происхождения была выявлена у 16–37% женщин, максимально часто встречалась при ГБ. В группах беременных с физиологическим течением гестационного периода наследственная предрасположенность по АГ отмечена только у 4% участниц исследования. Приблизительно три четверти женщин были первородящими. В группе ПЭ предстоящие роды были первыми у 84% женщин. Пациентки с ХАГ не получали на амбулаторном этапе наблюдения постоянной антигипертензивной терапии.
Артериальная гипертензия у беременных ассоциируется с развитием различных осложнений беременности и родов. Плацентарная недостаточность, синдром задержки развития плода, гипотрофия плода чаще выявллялась в группе пациенток с ПЭ. В этой группе было трое мертворожденных. Оперативные роды были выполнены в 22% случаев. В группе ГАГ кесарево сечение потребовалось в 20% случаев. Все дети были рождены живыми. Антропометрические показатели новорожденных не отличались от показателей в группе ФБ.
Результаты исследования и обсуждение
При ФБ в первой половине гестационного процесса мы наблюдали низкий уровень АД (табл. 2). К началу III триместра отмечено повышение среднесуточного АД, не превышающее его нормальные показатели. При неосложненном течении беременности у пациенток с ГБ регистрировали повышенный уровень АД по сравнению с данными при ФБ, однако не превышающий нормальных, характерных для периода вне беременности, величин. Динамика суточного профиля АД у пациенток с ГБ и при ФБ была
одинаковой, к концу беременности наблюдалось повышение АД приблизительно на 7–8/4–5 мм рт. ст., перепад АД день-ночь снижался на 4/4%. Клиническому развитию ГАГ предшествовали: с I триместра – повышение уровня диастолического АД, со II – увеличение перепада давления день-ночь и вариабельности АД.
Очевидно, что так же как и в общеклинической практике, уровень среднесуточного АД по сравнению с данными клинического, случайного АД обладает большей прогностической значимостью в развитии различных осложнений беременности. Безопасным признается АД <125/75 мм рт. ст. в дневные часы
и <105/65 мм рт. ст. ночью в I и II триместрах, а в III триместре – <130/80 мм рт. ст. и 110/70 мм рт. ст. соответственно [20]. При изучении суточных ритмов АД у женщин с высоким и низким риском развития ПЭ было обнаружено, что во II триместре наибольшей предикторной значимостью в группе с низким риском развития обладает систолическое АД среднее за сутки ≥115 мм рт. ст., а во время сна ≥106 мм рт. ст. [13]. В группе с высоким риском наибольшее значение имели показатели диастолического АД. Уровень последнего ≥62 мм рт. ст. служил предиктором развития ПЭ у женщин с исходными нормальными цифрами АД [13]. Другие исследователи отмечали прогностическую значимость в развитии гестационной АГ уровня суточного диастолического АД >68 мм рт. ст. во II триместре [31].
В нашем исследовании развитие ПЭ и у беременных с исходно нормальным уровнем АД, и у пациенток с ХАГ ассоциировалось со снижением перепада давления день-ночь и повышением вариабельности АД. Снижение перепада уровня дневного и ночного АД (СИ<10%) во II триместре у всех беременных (с исходно нормальными цифрами АД и с ХАГ) увеличивало риск развития ПЭ в 2,1 раза. Сочетание двух факторов в группе женщин-нормотоников: АД диастолическое суточное >60 мм рт. ст. + СИ<10% — увеличивало риск развития ПЭ в 7,4 раза. Относительный риск развития ПЭ у беременных с ХАГ при СИ<10% в I триместре повышался в 4 раза.
В опубликованных ранее работах отмечалось, что клиническому развитию ПЭ у беременных с исходно нормальным уровнем АД предшествуют изменения суточного профиля АД, а повышение ночного АД с развитием суточного ритма АД по типу «non-dipper» является наиболее патогномоничным [11, 13, 22]. В основе преимущественного повышения уровня ночного АД при ПЭ лежат эндотелиальные нарушения [12].
Выявленные отклонения суточного профиля АД у беременных с различными формами АГ, такие как повышенный уровень АД, недостаточность его ночного снижения и высокая изменчивость участвуют в формировании органных нарушений и определяют прогноз, что ранее было многократно доказано в общеклинической практике [16, 18, 19, 30, 33].
Таблица 2. Динамика показателей суточного профиля артериального давления в группах сравнения
(M±SD).
Во время беременности гормональные и гемодинамические изменения прямо или косвенно влияют на структурные и функциональные показатели сердца. У пациенток с ХАГ исходно отмечены повышенные показатели индекса массы миокарда левого желудочка (ИММЛЖ) и при неосложненном течении беременности, так же как и при ФБ, к началу III триместра они статистически значимо не менялись (табл. 3). Аналогичная динамика была характерна для ГАГ. В этих группах сохранялся гиперкинетический тип кровообращения. Показатели насосной функции миокарда были сохранены. В группах ПЭ и ХАГ+ПЭ отмечалось статистически значимое увеличение ИММЛЖ к началу III триместра
и эти изменения предшествовали клиническим проявлениям заболевания.
Таблица 3. Динамика показателей ЭхоКГ у пациенток в группах сравнения (M±m).
При неосложненном течении беременности у пациенток с ГБ показатели общего периферического сосудистого сопротивления (ОПСС) были аналогичны показателям при ФБ. При ГАГ не было отмечено достоверного повышения ОПСС. Развитию ПЭ и в группе женщин-нормотоников, и у пациенток с ХАГ предшествовало повышение ОПСС с I триместра беременности.
В работах B. Vassopolo и соавт. приводятся данные о прогностической значимости показателей ОПСС, равные или выше 1400 дин´с´см¯5 на 24 нед, в развитии ПЭ у беременных с исходно нормальным уровнем АД [32]. Признаки ремоделирования миокарда левого желудочка (ЛЖ) в начале III триместра были выявлены у 27% беременных с ПЭ, у 32% – при сочетанной патологии ХАГ и ПЭ. В группе ГАГ признаки ремоделирования миокарда отмечены у 7% беременных. В группе беременных с ГБ статистически значимого изменения структуры ЛЖ за период беременности не наблюдали, однако признаки нарушения нормальной геометрии сердца определяли исходно у 42%, что свидетельствует
о тяжести течения гипертензивного синдрома у данной категории пациенток. Ремоделирование
ЛЖ рассматривают как маркер осложненного течения беременности. В литературе приведены данные о распространенности концентрического ремоделирования сердца до 78% среди пациенток с ГАГ в случае развития у них ПЭ [25]. Более значимые изменения геометрии ЛЖ сердца происходят у беременных с АГ, развившейся вследствие нарушения гестационного процесса, нежели при ГБ [26].
Изучение метаболических изменений в гестационный период у беременных с различными формами АГ показало, что у пациенток с ХАГ при неосложненном течении гестационного периода динамика метаболического статуса аналогична таковой при ФБ. Прибавка массы тела у женщин с исходно нормальным уровнем АД и у пациенток с ГБ при неосложненном ее течении положительно коррелирует с повышением уровня АД к концу беременности. При развитии ГАГ и ПЭ эти взаимосвязи нарушаются. Избыточная масса тела и гиперхолестеринемия наиболее характерны для пациенток с ГБ. Развитию ПЭ предшествует гиперурикемия.
Таким образом, полученные результаты подтверждают значимость периферической вазоконстрикции в патогенезе развитии ПЭ и согласуются с опубликованными ранее данными отечественных и зарубежных исследователей [7, 10, 28, 29]. Как известно, у женщин с ПЭ с начала гестационного процесса не отмечается ассоциированного с беременностью снижения сосудистого тонуса. Повышение чувствительности сосудистой стенки к гормональным, метаболическим и эндотелийзависимым вазоконстрикторам развивается на этапе формирования гипертензивного синдрома. Предшествующие ПЭ структурные изменения миокарда ЛЖ формируются в достаточно короткое время, ограниченное гестационным периодом. Процесс быстрого ремоделирования миокарда ЛЖ при гипертензивных
состояниях у беременных целесообразно рассматривать не только с точки зрения риска развития ПЭ, но также как факт, подтверждающий необходимость фармакотерапии АГ в период гестации с целью предупреждения отдаленных сердечно-сосудистых осложнений. В соответствии с существующими рекомендациями, при нетяжелой АГ и отсутствии органных нарушений антигипертензивная терапия не проводится. Однако данные о высокой распространенности ремоделирования миокарда, признанного в настоящее время одним из наиболее важных маркеров развития сердечно-сосудистых осложнений и смертности, заставляют рассматривать беременных из групп риска развития гипертензивных осложнений в качестве потенциальных пациенток для активной терапии, направленной на коррекцию периферического повышения тонуса сосудов, снижения активности симпатического отдела вегетативной нервной системы.
Анализ основных пропорций макро- и микроэлементов подтвердил тот факт, что у женщин с ХАГ, а также у беременных на этапе, предшествующем развитию ПЭ, имеет место дефицит магния и калия по отношению к натрию и кальцию. Так, установлена обратная связь между уровнем магния в эритроцитах и величиной АД в III триместре беременности [17]. В работах И.Е. Мишиной и О.А. Громовой (2006) было продемонстрировано снижение уровня магния у женщин с ХАГ [3]. Абсолютное и относительное снижение уровня магния при ХАГ взаимосвязано с повышением тонуса симпатической
нервной системы, сопровождается снижением эластичности сосудистой стенки и повышением периферического сопротивления артериол головного мозга [1]. Беременные с развившейся в последующем ГАГ с ранних сроков гестации имели достоверно более низкие значения уровня магния в слюне по сравнению с нормотензивными женщинами. К концу беременности содержание магния в слюне снижается у всех беременных, однако при ГАГ более значимо (см. рисунок) [1].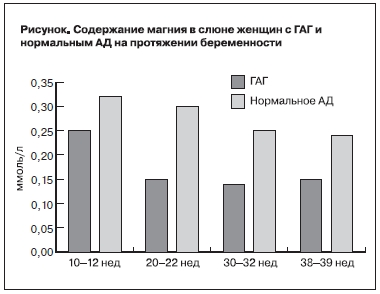
Хотя препараты магния не относятся к антигипертензивным препаратам, их гипотензивный эффект хорошо известен клиницистам. Парентеральное введение сульфата магния применяется во всех случаях преэклампсии, что значительно уменьшает риск развития эклампсии, материнской и перинатальной смертности [15, 23]. Было обнаружено, что сульфат магния способствует достоверному снижению уровня АД и повышает уровень оксида азота, дефициту продукции которого в настоящее время отводится ключевая роль в развитии ПЭ [24]. Введение сульфата магния снижает показатели интерлейкина-6, одного из основных провоспалительных медиаторов АГ и эндотелиальной дисфункции
при ПЭ [9].
Пероральные препараты магния для коррекции гипертензивных расстройств у беременных применялись редко. Собственный опыт использования магния (магнерота) у женщин с ГАГ во второй половине беременности позволил убедиться в его гипотензивной эффективности, способности уменьшать признаки вегетативной дистонии, уменьшать степень симпатикотонии, сосудистых нарушений и психопатологических расстройств [1]. Обоснованным может стать назначение магнерота на этапе формирования гипертензивных осложнений беременности, т.е. в период начальных изменений сосудистого тонуса, нарушений суточного ритма АД. Магнерот успешно применяется в кардиологии при лечении пациентов с пролапсом митрального клапана и вегетативными расстройствами [4], желудочковой экстрасистолией, синдромом удлиненного интервала QT [2], а также в качестве антигипертензивного препарата при АГ I степени [5]. Препарат обеспечивает высокую абсорбцию магния в желудочно-кишечном тракте, способствует накоплениюмагния в клетке, сочетает фармакологическую эффективность оротовой кислоты и магния [14]. При беременности магнерот безопасен и практически не имеет побочных проявлений [1].
Таким образом, развитию ГАГ и ПЭ у беременных с исходно нормальным уровнем АД и у пациенток с ХАГ предшествуют изменения в регуляции сосудистого тонуса, АД, его вариабельности и суточного ритма вследствие эндотелиальных нарушений, повышения активности симпатической нервной системы, метаболических сдвигов. На этапе формирования патологических изменений, до развития гипертензивного синдрома с профилактической целью могут быть назначены препараты магния, обладающие безопасным гипотензивным эффектом, позитивно влияющие на эндотелий сосудов, контролирующие вегетативные нарушения. Возможности препаратов магния препятствовать развитию гипертензивных осложнений у беременных должны быть дополнительно оценены в исследованиях.



