Ангиосаркома молочной железы является крайне редким заболеванием с частотой развития от 0,002 до 0,05% и делится на два подтипа: первичная, развивается в молочной железе спонтанно, и вторичная, развитие которой обусловлено предшествующей лучевой терапией, проведенной по поводу рака молочной железы (РМЖ) или лимфомы Ходжкина. Частота встречаемости радиоиндуцированных ангиосарком молочной железы не превышает 1% всех злокачественных опухолей молочной железы [1]. Впервые развитие лимфангиосаркомы после мастэктомии было описано в 1948 г. [2]. В начале 1980-х гг. опубликованы первые наблюдения о развитии ангиосарком грудной стенки после проведенной адъювантной лучевой терапии по поводу РМЖ [3, 4].
Органосохранные операции с последующей лучевой терапией являются современным стандартом лечения раннего РМЖ, вытесняя радикальную мастэктомию [5]. Данные о частоте развития вторичных ангиосарком спорны. По данным, опубликованным еще в 2002 г. Yap J. и соавт., связывают значимый рост числа ангиосарком, ассоциированных с лучевой терапией, до 0,9 на 1000 случаев РМЖ именно с изменившейся тактикой лечения [6]. Однако, по данным двух онкологических центров США (университетский медицинский центр Канзаса и университетский медицинский центр Огайо), опубликованным в 2009 г., заболеваемость вторичными ангиосаркомами составила 0,1–0,2%. За 10-летний период наблюдения более чем за 5000 больных РМЖ диагностировано лишь 11 случаев развития ангиосарком [7]. В объединенном анализе данных 11 онкологических клиник Франции, проведенном еще в 1999 г., отмечено, что частота развития вторичных радиоиндуцированных ангиосарком сопоставима с частотой первичных ангиосарком в здоровой молочной железе. Из 20 000 пациенток после проведенной органосохранной операции и адъювантной лучевой терапии вторичная ангиосаркома диагностирована у 9 больных (0,045%). Медиана времени до развития вторичной опухоли составила 74 месяца [8].
К факторам риска развития вторичных радиоиндуцированных ангиосарком относятся: высокие дозы лучевой терапии, сочетанное проведение лучевой и химиотерапии, проведение лучевой терапии в детстве и генетическая предрасположенность [9]. По данным Chesebro A.L. и соавт., медиана времени развития вторичных ангиосарком после проведенной лучевой терапии на область молочной железы составляет 5–7 лет [10]. Зачастую на постановку окончательного диагноза уходит много времени, так как визуальные и рентгенологические признаки неспецифичны и схожи с постлучевыми кожными реакциями. Еще в 1971 г. Cahan и соавт. и Arlen и соавт. описали основные критерии для диагностики постлучевых ангиосарком: 1) развиваются в зоне предшествовавшей лучевой терапии; 2) имеют различные морфологические характеристики с первичной ангиосаркомой; 3) время появления – не менее 3 лет с момента проведения лучевой терапии [11, 12].
Прогноз болезни неблагоприятный. Пятилетняя общая выживаемость, вне зависимости от объема проведенного лечения, не превышает 10–54%. Наилучшие показатели выживаемости отмечены в когорте больных, получивших хирургическое лечение, 5-летняя безрецидивная выживаемость (БРВ) составляет 41–47%, с медианой времени до развития рецидива – 6 месяцев (1–89 месяцев) [13–15].
Стандартными подходами лечения индуцированной ангиосаркомы молочной железы являются мастэктомия или широкое иссечение пораженной области. Ряд авторов отмечают, что наличие опухолевых клеток в краях резекции сопряжено со значимым снижением показателей БРВ [16, 17]. По данным исследования Seinen J. и соавт. [18], частота рецидивов возрастает при мультифокальном росте ангиосаркомы и наличии опухолевых клеток в краях резекции. Для достижения радикальности хирургического лечения поддерживается агрессивная тактика с резекцией подлежащих структур и последующей пластикой. Метод множественной кожной биопсии применяется для определения распространенности опухоли и может помочь определить зону хирургического вмешательства для обеспечения чистых краев резекции.
Дискутабельным остается вопрос проведения лучевой терапии в качестве адъювантного метода лечения вторичной ангиосаркомы. Так, Depla A.L. [19] полагает, что проведение адъювантной лучевой терапии позволяет добиться лучшего локального контроля. В то время как Torres K.A. [1] считает, что применение лучевой терапии на ранее облученные зоны может вызвать тяжелые постлучевые осложнения.
Также нет однозначных рекомендаций относительно системного лечения при ангиосаркомах. В 2016 г. Sinnamon A.J. [20] представил данные ретроспективного анализа и продемонстрировал отсутствие преимущества в показателях выживаемости при добавлении нео-/адъювантной химиотерапии. В то же время имеется ряд публикаций, демонстрирующих эффективность таксанов при ангиосаркоме [21, 22]. Ангиосаркомы характеризуются экспрессией сосудисто-эндотелиального фактора роста (VEGFR) [23]. Ряд исследований продемонстрировал эффективность использования анти-VEGF моноклональных тел при ангиосаркоме [23, 24]. С другой стороны, Ray-Coquard и соавт. [25] опубликовали результаты небольшого открытого рандомизированного исследования, в которое вошли 15 больных, часть из которых получали монотерапию паклитакселом, вторая часть – комбинацию паклитаксела и бевацизумаба. Авторы делают вывод, что добавление бевацизумаба не улучшает результатов лечения.
Однако более крупное исследование II фазы, включившее 30 пациенток с местно-распространенной ангиосаркомой и эпителиоидной гемангиоэндотелиомой, продемонстрировало эффективность лечения бевацизумабом: 17% больных имели частичный ответ, 50% – стабилизацию болезни с медианой длительности до прогрессирования 26 недель [26]. В настоящее время проводится ряд исследований по изучению роли VEGF-ингибиторов и других препаратов в лечении ангиосарком (NCT02979899, NCT01462630, NCT02048722).
В данной статье мы представляем результаты лечения трех больных с различной распространенностью ангиосаркомы молочной железы и прогнозом.
Клиническое наблюдение № 1
Пациентка Ф., 1960 г.р. В возрасте 45 лет, в 2005 г., у больной диагностирован рак левой молочной железы T1сN0M0, стадия IА. При гистологическом исследовании опухолевый узел представлен инфильтративным дольковым раком. При иммуногистохимическом (ИГХ) исследовании выявлена высокая экспрессия рецепторов эстрогенов и прогестерона, экспрессия Her2/neu не определялась. Выполнена радикальная резекция молочной железы. В адъювантном режиме проведено 4 курса химиотерапии в режиме CAF (доксорубицин 50 мг/м2 + циклофосфамид 500 мг/м2 + 5-фторурацил 500 мг/м2, каждые 3 недели), проведена лучевая гамма-терапия на область оставшейся части молочной железы, суммарная очаговая доза (СОД) 62 Гр. От дальнейшей адъювантной эндокринотерапии пациентка отказалась.
При плановом обследовании в августе 2009 г. выявлен рак правой молочной железы T2N0M0. В сентябре 2009 г. выполнена радикальная резекция правой молочной железы. При гистологическом исследовании – опухолевый узел 2,3 см, протоковый инфильтративный РМЖ криброзного, тубулярно-сосочкового строения, апокринный. При ИГХ-исследовании экспрессии рецепторов эстрогенов, прогестерона и Her2/neu не выявлено. Проведено 4 курса адъювантной химиотерапии в режиме CAF, лучевая терапия на оставшуюся часть правой молочной железы и зоны регионарного лимфоотока, СОД 46 Гр. Мутаций в генах BRCA1/2 не выявлено.
В декабре 2012 г., при контрольном обследовании, выявлено прогрессирование заболевания – метастаз в печени, метастазы по брюшине, в лимфатических узлах малого таза. Отмечен рост уровня онкомаркера СА-125 до 273 ЕД/мл. Биопсию очагов выполнить не удалось. С января по июль 2013 г. проведено 8 циклов химиотерапии в режиме: паклитаксел + карбоплатин. На фоне лечения отмечен полный регресс очагов по брюшине, в лимфоузлах малого таза, значительное уменьшение размеров очага в печени (до 0,6 см), снижение уровня онкомаркера CA-125 до 47 ЕД/мл. В дальнейшем проводили терапию тамоксифеном до декабря 2016 г.
В январе 2017 г., при контрольном обследовании, очаг в печени – без динамики, однако стали визуализироваться солидно измененные яичники. В феврале 2017 г. выполнена двусторонняя тубовариоэктомия. При гистологическом исследовании – в яичниках метастазы РМЖ солидно-альвеолярного трабекулярного скиррозного строения, с экспрессией маммоглобина. В послеоперационном периоде проведено 9 еженедельных введений винорельбина в дозе 30 мг/м2.
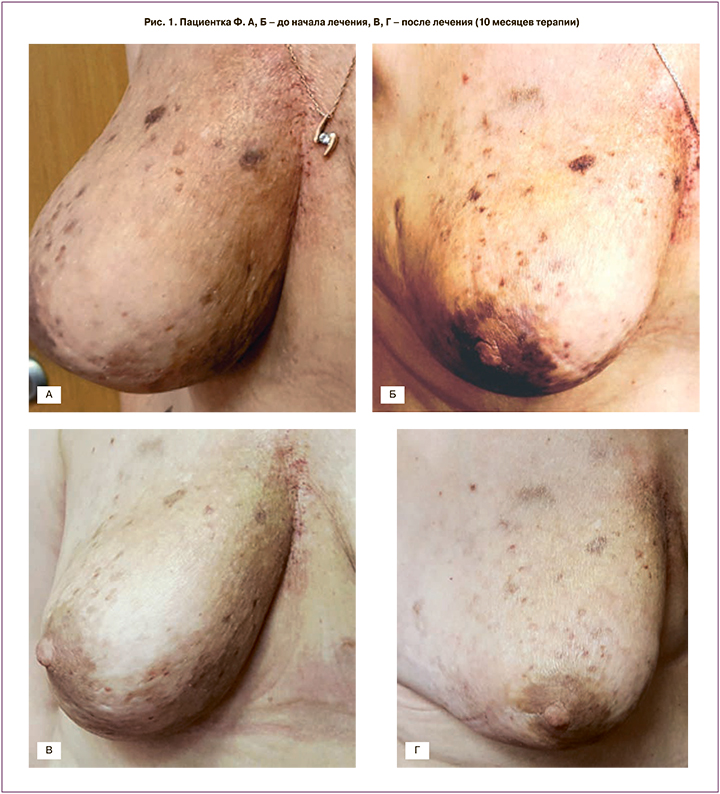
В июне 2018 г. появился и нарастал в динамике отек кожи правой молочной железы, появились множественные образования в виде плотных геморрагических узлов темно-фиолетового цвета, местами сливающихся между собой, с распространением на грудную стенку и кожу левой молочной железы, с участком изъязвления и наличием экзофитного компонента 2,0 см. По данным компьютерной томографии (КТ) органов грудной клетки, брюшной полости и малого таза – утолщение кожи правой молочной железы до 0,8 см, в печени определялись 3 метастатических очага до 1,2 см в диаметре. Для уточнения природы кожных изменений выполнена биопсия. При морфологическом исследовании в биоптате обнаружены веретенообразные клетки с щелевидными структурами, частью заполненными кровью. При ИГХ-исследовании экспрессии СК7 и маммоглобина в опухолевых клетках не обнаружено. Ядра некоторых клеток слабо окрашены с GATA3. При реакции с Ki67 выявлена на отдельных участках высокая, а на отдельных участках – низкая митотическая активность. В фиброзированной и гиалинизированной дерме – пучки из полиморфных веретеновидных и эпителиоидных клеток с низкой митотической активностью (3 MF/10HPF), обилие капиллярных сосудов разного калибра и кавернозно расширенные сосуды с нарушением целостности стенки и кровоизлияниями. Проводили дифференциальную диагностику между веретеноклеточной гемангиомой и ангиосаркомой. При повторном ИГХ-исследовании выявлена экспрессия опухолевыми клетками Vimentin, CD31, CD34, F VIII, фокально – SMA. Опухолевые клетки не экспрессируют Pan CK, S-100, ER, PR, HHV-8. Индекс пролиферации Ki67 равен 65%. Иммунофенотип опухоли соответствует иммунофенотипу ангиосаркомы. По совокупности имеющихся данных гистологического и ИГХ-исследований, данных анамнеза, установлен диагноз: радиоиндуцированная ангиосаркома G2. В связи с обширным поражением кожи хирургическое лечение признано невозможным.
С августа 2018 по март 2019 г. проведено 8 циклов химиотерапии в режиме: гемцитабин 900 мг/м2 д. 1, 8 + доцетаксел 75 мг/м2 д. 8, каждые 3 недели. После 2 циклов отмечен выраженный клинический эффект в виде рубцевания язвенного дефекта, уменьшения размеров экзофитного компонента, значительного регресса отечности ткани железы. При контрольном обследовании после 6 циклов химиотерапии отмечена частичная регрессия очагов на коже. По данным компьютерной томографии – очаги в печени без динамики.
При контрольном обследовании в апреле 2019 г. сохраняется достигнутый эффект по всем имеющимся проявлениям болезни. В дальнейшем проведено 4 курса гемцитабином в дозе 1000 мг/м2, д. 1, 8, 15, каждые 4 недели с добавлением бевацизумаба. Терапия доцетакселом завершена в связи с развившейся полинейропатией 2-й стадии. При осмотре в июле 2019 – без признаков прогрессирования. Химиотерапия отменена, продолжена терапия бевацизумабом.
При контрольном обследовании в сентябре 2019 г. эффект сохраняется. Однако площадь поражения кожи не позволяет выполнить радикальную операцию (рис. 1).
Клиническое наблюдение № 2
Пациентка К., 1942 г.р. В январе 2011 г. при обследовании верифицирован рак правой молочной железы T1N0M0. В апреле 2011 г. выполнена радикальная резекция правой молочной железы. При гистологическом исследовании: опухолевый узел размером 1,3 см, инфильтративный протоковый рак 2 степени злокачественности, альвеолярного и солидного строения. В 11 регионарных лимфоузлах — картина жирового перерождения. В лимфатических щелях – единичные опухолевые эмболы. По данным ИГХ-исследования – трижды негативный фенотип опухоли, Ki67 – 15%. В послеоперационном периоде проведено 4 цикла адъювантной химиотерапии в режиме FAC. В дальнейшем проведено 13 сеансов адъювантной дистанционной лучевой терапии двумя тангенциальными полями на гамма-аппарате Рокус 66, источник излучения Со-60, 2D-планирование в режиме гипофракционирования, разовая очаговая доза 3 Гр, СОД 39 Гр (48 иГр). Размер тангенциальных полей составил 8×20 см. Средняя энергия излучения 1,25 МэВ. Лечение перенесла удовлетворительно, без выраженных осложнений. В дальнейшем пациентка находилась под динамическим наблюдением.
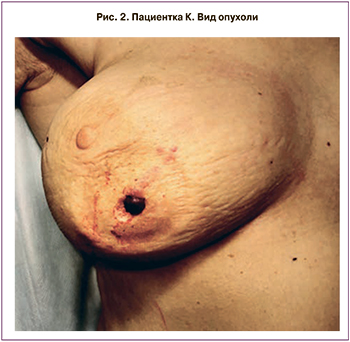
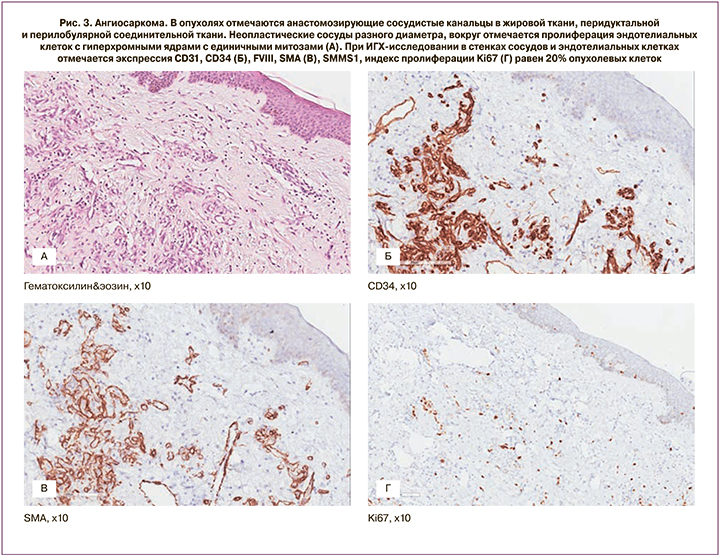
Через 7 лет, в сентябре 2018 г., при очередном осмотре в нижненаружном квадранте правой молочной железы выявлено гиперемированное изъязвленное образование на коже, размерами до 2 см, кровоточащее при контакте (рис. 2). По данным маммографии и УЗИ молочных желез, в проекции нижненаружного квадранта визуализируется внутрикожное образование 0,7×0,3 см, при цитологическом исследовании – дерматофибросаркома? В октябре 2018 г. выполнена секторальная резекция правой молочной железы. При гистологическом исследовании определяется опухолевый узел, по строению соответствующий ангиосаркоме G1. Для уточнения диагноза проведено ИГХ-исследование: опухолевые клетки экспрессируют CD31, CD34, FVIII, SMA, не экспрессируют HHV-8. Индекс Ki67 – 20% – соответствует иммунофенотипу ангиосаркомы G1 (рис. 3).
Учитывая возраст больной, гистологический тип опухоли, степень дифференцировки, принято решение о динамическом наблюдении. При контрольном осмотре в июле 2019 г. данных за прогрессирование болезни не получено.
Клиническое наблюдение № 3
Пациентка С., 1963 г.р. В ноябре 2014 г. диагностирован синхронный рак правой молочной железы T1N0M0 и рак сигмовидной кишки Т3N0M0. Пациентка значимо отягощена по сопутствующей сердечно-сосудистой патологии. В декабре 2014 г. выполнена операция в объеме: радикальная резекция правой молочной железы, резекция сигмовидной кишки. Гистологическое заключение: в опухолевом узле молочной железы, размерами 1,0×0,9×0,5 см определяется мелкий фокус инфильтративной протоковой карциномы G1. Стромальная лимфоидная инфильтрация очень скудная (1% – оценено согласно рекомендациям International TILs-working group 2014). В 12 лимфатических узлах – без признаков метастатического поражения. По данным ИГХ-исследования: рецепторы эстрогенов – 8 баллов, рецепторы прогестерона – 8 баллов, Ki67 – 4%, Her2/neu – 0. В сигмовидной кишке – патогистологическая картина умеренно дифференцированной колоректальной аденокарциномы G2 с прорастанием до субсерозного слоя на участках, покрытых брюшиной, по брыжеечному краю – без признаков прорастания в клетчатку брыжейки, лимфатические узлы – без признаков метастатического поражения. В послеоперационном периоде, в марте 2015 г., проведена адъювантная 3D-конформная лучевая терапия на оставшуюся часть правой молочной железы, правую аксиллярную, межпекторальную область c контролем визуализации на ускорителе электронов Varian Clinаc 2300iХ фотонами энергией 6 МэВ разовой дозой 2,66 Гр, 16 фракций до СОД 42,56 Гр (48 изоГр – с учетом фракционирования дозы, с расчетом по линейно-квадратичной модели). С апреля 2015 г. проводилась адъювантная эндокринотерапия тамоксифеном.
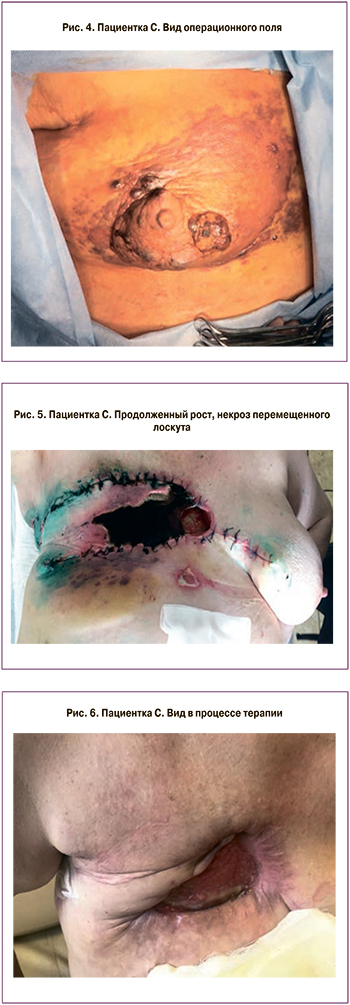 В сентябре 2018 г. пациентка самостоятельно обратилась с кровоточащим изъязвлением на коже нижненаружного квадранта правой молочной железы, выполнена биопсия образования. По данным гистологического исследования: разрастания инфильтративного рака неспецифического типа 2 степени злокачественности. В сентябре 2018 г. выполнена санационная мастэктомия с пластическим закрытием дефекта кожи передней грудной стенки свободным кожным лоскутом (рис. 4). При гистологическом исследовании: разрастания веретеноклеточной мезенхимальной опухоли с обширными участками некроза, более всего соответствующей ангиосаркоме. Для уточнения гистогенеза опухоли молочной железы дополнительно проведено ИГХ-исследование с использованием антител к CD31, CD34, D2-40, FLI1, панцитокератину АЕ1/3, p63, рецепторам эстрогенов и прогестерона, Her2/neu и Ki67. Выявлена экспрессия в большинстве опухолевых клеток – CD31, D2-40 и FLI1, что при отсутствии экспрессии опухолевыми клетками остальных ИГХ-маркеров, включая рецепторы эстрогенов (0%) и прогестерона (0%), Her2/neu «0», свидетельствует в пользу их эндотелиальной дифференцировки. Индекс пролиферации опухолевых клеток (Ki67) составил 80%. Принимая во внимание гистологическое строение опухоли и ее клеточный иммунофенотип, а также данные анамнеза (радикальная резекция правой молочной железы по поводу аденокарциномы, с последующей лучевой терапией), новообразование правой молочной железы классифицировано как эпителиоидная ангиосаркома G3, индуцированная лучевой терапией, с высокой пролиферативной активностью (Ki67 – 80%) и обширными зонами некроза.
В сентябре 2018 г. пациентка самостоятельно обратилась с кровоточащим изъязвлением на коже нижненаружного квадранта правой молочной железы, выполнена биопсия образования. По данным гистологического исследования: разрастания инфильтративного рака неспецифического типа 2 степени злокачественности. В сентябре 2018 г. выполнена санационная мастэктомия с пластическим закрытием дефекта кожи передней грудной стенки свободным кожным лоскутом (рис. 4). При гистологическом исследовании: разрастания веретеноклеточной мезенхимальной опухоли с обширными участками некроза, более всего соответствующей ангиосаркоме. Для уточнения гистогенеза опухоли молочной железы дополнительно проведено ИГХ-исследование с использованием антител к CD31, CD34, D2-40, FLI1, панцитокератину АЕ1/3, p63, рецепторам эстрогенов и прогестерона, Her2/neu и Ki67. Выявлена экспрессия в большинстве опухолевых клеток – CD31, D2-40 и FLI1, что при отсутствии экспрессии опухолевыми клетками остальных ИГХ-маркеров, включая рецепторы эстрогенов (0%) и прогестерона (0%), Her2/neu «0», свидетельствует в пользу их эндотелиальной дифференцировки. Индекс пролиферации опухолевых клеток (Ki67) составил 80%. Принимая во внимание гистологическое строение опухоли и ее клеточный иммунофенотип, а также данные анамнеза (радикальная резекция правой молочной железы по поводу аденокарциномы, с последующей лучевой терапией), новообразование правой молочной железы классифицировано как эпителиоидная ангиосаркома G3, индуцированная лучевой терапией, с высокой пролиферативной активностью (Ki67 – 80%) и обширными зонами некроза.
В раннем послеоперационном периоде диагностированы продолженный рост опухоли, появление новых внутрикожных очагов. Кроме того, послеоперационный период осложнился некрозом перемещенного лоскута (рис. 5). Консервативное лечение – без эффекта. Выполнено иссечение некротизированных краев послеоперационной раны. Сохраняется кожный дефект на передней грудной стенке, по поводу чего пациентка постоянно получает симптоматическое лечение.
Учитывая распространенность болезни, анамнез, наличие значимой сопутствующей патологии, начата химиотерапия паклитакселом. С октября 2018 по февраль 2019 г. проведено 5 курсов химиотерапии в режиме: паклитаксел 80 мг/м2, в/в, д. 1, 8, 15, каждые 4 недели. Лечение без значимой токсичности. Клинически отмечена выраженная положительная динамика в виде уменьшения размеров множественных очагов, снижение интенсивности гиперемии очагов, значительная часть из них перестала определяться. Планировалось продолжить проводимую химиотерапию в прежнем режиме, однако по социальным причинам пациентка не смогла продолжить лечение.
При осмотре в сентябре 2019 г. состояние больной стабильно, роста очагов не отмечено (рис. 6). Больная находится под динамическим наблюдением.
Обсуждение
Радиоиндуцированная ангиосаркома молочной железы – редкое заболевание, в связи с чем проведение крупных исследований крайне затруднительно. В литературе встречаются в основном описания единичных клинических наблюдений, и на сегодняшний день их насчитывается не более 200. В 2018 г. были опубликованы результаты лечения 51 больной саркомами молочной железы, получавших лечение в НМИЦ онкологии им. Н.Н. Блохина с 1999 по 2017 г. [26]; только у 6 из них были диагностированы ангиосаркомы. При многофакторном анализе независимыми факторами неблагоприятного прогноза, помимо размера опухоли, распространенности и степени злокачественности, оказались также и гистологические подтипы: ангиосаркома, липосаркома, фибросаркома и злокачественная листовидная опухоль.
В настоящей статье мы осветили результаты лечения 3 больных вторичными ангиосаркомами молочной железы, у 2 из них заболевание развилось через 7 лет после проведения лучевой терапии, у 1 – через 4 года, что характерно для классического течения заболевания. Во всех 3 случаях потребовалось проведение дополнительного расширенного ИГХ-исследования для уточнения диагноза. Лишь у 1 пациентки удалось достичь ремиссии, 10 месяцев на момент обследования, выполнив радикальную операцию. У 2 пациенток удалось достичь стабилизации болезни в течение 10 месяцев, благодаря использованию таксансодержащих режимов химиотерапии. Наиболее сложным в клиническом отношении и в плане прогноза представляется первое наблюдение, больная имеет диссеминированный рак молочной железы, по поводу которого уже успела получить 3 линии терапии. Проводимая химиотерапия в режиме доцетаксел + гемцитабин позволила достичь частичного регресса метастазов РМЖ и контролировать течение радиоиндуцированной ангиосаркомы. В настоящее время терапия доцетакселом приостановлена в связи с развившейся периферической нейропатией 2–3 степени. Одной из возможных опций лечения остаются комбинации с бевацизумабом.
Заключение
Диагностика и лечение радиоиндуцированных сарком остается сложным вопросом современной онкологии. Ввиду их редкой распространенности мы располагаем низкой настороженностью относительно диагностики и ограничены в эффективных опциях терапии. Включение таких больных в клинические исследования и даже описания отдельных клинических наблюдений представляется важным шагом к поиску эффективного лечения данной патологии.



