С 9 по 12 октября 2023 г. в Париже прошел XXI Всемирный конгресс Международной федерации гинекологии и акушерства (The International Federation of Gynecology and Obstetrics, FIGO). Конгресс собрал представителей более чем 130 стран, среди которых – члены организаций из 45 стран.
Одной из наиболее актуальных тем, обсуждавшихся на конгрессе, была инициатива FIGO под названием «red line», которая направлена на борьбу с насилием в отношении женщин во всем мире. В рамках этой инициативы были представлены новые нормы в области образования, принятия тела, политики, пропаганды сексуального образования и культуры и актуальные меры по профилактике инфекций, передающихся половым путем (ИППП).
Одним из основных направлений конгресса являлся разбор новых гайдлайнов, представленных FIGO, Европейским обществом по репродукции человека и эмбриологии (European Society of Human Reproduction and Embryology, ESHRE) и Международным обществом по изучению вульвовагинальных заболеваний (International Society for the Study of Vulvovaginal Disease, ISSVD) по ведению женщин с акушерско-гинекологическими заболеваниями (эндометриозом, синдромом поликистозных яичников, заболеваниями вульвы и влагалища, невынашиванием беременности и др.) [1].
Большой блок на конгрессе был посвящен секции по доброкачественным заболеваниям вульвы (председатель Dr. Tanja Bohl). В рамках обсуждения были представлены рекомендации по лечению склероатрофического лихена, красного плоского лишая, простого хронического лишая и вульводинии, которые актуальны и применяются на территории России.
В рамках конгресса значимый блок был посвящен влагалищному и кишечному микробиому и охватывал темы роли микробиома влагалища и эндометрия в бесплодии, изменения микробиома во время беременности, корреляции между микробиотой, эндометриозом и раком.
Как микробиом объясняет бесплодие? Упоминалось наличие корреляции между определенными бактериями и развитием эндометриоза. Эндометриоз может быть связан, в том числе, с состоянием микробиома кишечника и уровнем эстроболома. Основной участник взаимодействия микробиома с эндометрием – цервико-вагинальные бактерии. Во время оплодотворения они могут попадать в верхние отделы половых путей вместе со спермой. Уровень этих бактерий и их разнообразие во влагалищном микробиоме также играют важную роль в процессе беременности. Все больше данных свидетельствует о наличии микроорганизмов не только во влагалище, но и в матке, которая ранее считалась «стерильной нишей». По данным некоторых исследований, наиболее представленным родом в эндометрии являются лактобациллы; однако считается, что в верхних отделах репродуктивной системы обитают в 10 тыс. раз меньше бактерий, чем во влагалище. Предполагается, что микробиота матки способна модулировать функции клеток эндометрия, а также местной иммунной системы и предотвращать маточные инфекции.
Исследования показывают, что кишечная микробиота может оказывать значительное влияние на метаболизм эстрогенов (эстроболом) и, в свою очередь, на развитие рака эндометрия. С помощью так называемых деконъюгирующих бактерий происходит увеличение количества инактивированных эстрогенов, которые впоследствии реабсорбируются в кровоток. Следовательно, дисбактериоз кишечника повышает уровень биоактивных циркулирующих эстрогенов. Еще одним интересным аспектом исследований является связь между ожирением и уровнем эстрогенов. У пациентов с ожирением наблюдается увеличение периферической ароматизации тестостерона и андростендиона в эстрадиол и эстрон. Это связано с процессом перевода мужских половых гормонов в женские, который происходит, главным образом, в жировой ткани. Необходимо отметить, что состояние ожирения характеризуется дисбактериозом кишечной микробиоты. Нарушение баланса микроорганизмов может привести к более быстрому росту опухоли и более агрессивному фенотипу рака эндометрия.
Все вышеперечисленные факты подчеркивают важность баланса кишечной микробиоты для поддержания нормального метаболизма эстрогенов и профилактики гинекологического рака [1].
Детальное обсуждение проблемы микробиома вульвы и влагалища, а также связанных с этим вопросов интимной гигиены и терапии воспалительных процессов генитального тракта было приурочено и к научному ужину. Впервые широко были освещены результаты исследовательского проекта «Isala» под руководством профессора S. Leeber – революционной инициативы, направленной на изучение вагинальной микробиоты и ее влияния на здоровье женщин. Вагинальные лактобациллы у здоровых женщин крайне недостаточно изучены из-за острой нехватки культуральных коллекций, данных о микробиоме и подходящих животных моделей [2].
Целями проекта были как научные (составить карту женского микробиома и оценить значение лактобацилл в качестве ориентира для верификации заболеваний, фертильности, беременности, инфекций и т.д.; определить влияние образа жизни и окружающей среды на микробиом влагалища; создать большой биобанк с полезными вагинальными бактериями (лактобациллами) → LBPS, пробиотики или связанные с ними методы лечения), так и социальные цели – повысить осведомленность о важности микробиома, снять табу на женское здоровье и интимную гигиену и расширить возможности женщин, продвигать междисциплинарную науку: микробиологов, гинекологов, врачей общей практики, биоинформатиков, социологов, экспертов по коммуникациям.
Благодаря участию более 6000 женщин и анализу геномов были обнаружены ключевые таксоны микробиоты влагалища Lactobacillus crispatus, L. iners и Gardnerella и подтверждена связь ее динамического изменения с такими факторами, как возраст, менструальный цикл, особенности интимной гигиены и использование контрацепции; причем микробиота изменчива, в том числе, и у «здоровых» женщин. Только 10,4% нарушений микробиоты влагалища можно объяснить особенностями диеты, нарушением правил интимной гигиены, сексуальной активностью или ИППП! Интересным оказался тот факт, что у большинства преобладают лактобактерии, и это является показателем «здорового» микробиома влагалища; при этом здоровых в отношении такой микробиоты женщин было значительно больше ожидаемого результата. Было продемонстрировано, что L. сrispatus имеет отрицательную корреляцию с Gardnerella и Prevotella, в то время как Prevotella и Dialister положительно коррелируют с Gardnerella. То есть ранее считалось, что в здоровом влагалище доминируют лактобактерии, которые представляют собой неспорообразующие грамположительные палочки, продуцирующие молочную кислоту, что приводит к созданию кислой среды (рН 3–4). Лактобактерии предотвращают колонизацию других бактерий во влагалище (включая патогены) за счет конкуренции за рецепторы эпителиальных клеток и ингибирования их роста путем образования антимикробных соединений в сотрудничестве с врожденными защитными механизмами хозяина (например, циклические гормональные колебания, способствующие высвобождению гликогена и постоянному отшелушиванию эпителиальных клеток с бактериями), для поддержания здоровой вагинальной экосистемы. Однако состав здоровой вагинальной флоры более изменчив, чем первоначально предполагалось, и у некоторых здоровых женщин лактобактерии отсутствуют и заменяются другими бактериями, продуцирующими молочную кислоту, такими как Atopobium vaginae, Megasphaera spp. и/или виды Лептотрикса. В некоторых случаях влагалище у бессимптомных женщин репродуктивного возраста колонизировано потенциально патогенными видами (например, Gardnerella vaginalis, Staphylococcus aureus, Candida albicans), и, таким образом, определение здорового и нездорового вагинального микробиома является сложным. Например, в течение 1 года после родов изменяется микробиом влагалища за счет уменьшения количества видов Lactobacillus и увеличения количества различных анаэробов, а введение гормональной внутриматочной спирали временно приводит к бактериальному вагинозу (БВ) и со временем увеличивает количество Candida spp. во влагалище. Кроме того, обнаружен модуль Bacteroides, который связан с L. сrispatus. То есть микробиота влагалища представляет собой сообщество бактерий, которые активно взаимодействуют между собой, обеспечивая состояние здоровья и защиту от инфекций. Результаты проекта предоставляют базу для будущих исследований и разработки интервенционных мер по профилактике нарушений микробиоты влагалища. Данная инициатива повышает осведомленность общественности и вдохновляет другие исследовательские группы во всем мире. Команде проекта удалось собрать уникальные образцы и данные, расширяя наши знания о вагинальной микробиоте и ее значимости для женского здоровья. Проекты, такие как Леке в Камеруне, Дора в Нигерии, Лаура в Перу, Фатима в Марокко, Флоренция в Великобритании и Уганде, Мари в Швейцарии и многие другие, являются ярким примером дальнейшего развития и расширения исследования микробиома во всем мире.
В своем докладе профессор G. Donders [3] акцентировал внимание на нарушениях микробиоты влагалища, ассоциированных с БВ. Известны многочисленные акушерско-гинекологические последствия БВ: поздний выкидыш, преждевременные роды, преждевременный разрыв плодных оболочек, низкий вес плода при рождении, инфицирование околоплодных вод, хориоамнионит, послеродовой эндометрит, а также повышенный риск заражения ИППП и ВИЧ, герпесом, связь с вирусом папилломы человека (ВПЧ) и дисплазией шейки матки, сексуальные дисфункции. Сложности терапии БВ определяются наличием различных подтипов гарднерелл, формированием биопленок, частотой рецидивирования и отсутствием эффекта от лечения мужчин. В то же время часто имеются смешанные вагиниты, особенно с аэробным вагинитом (АВ), основанным на гиперреакции иммунной системы. Профессор сделал вывод, что не все вагинальные дисбактериозы являются БВ, а АВ ассоциируется со многими патологиями, ранее связанными только с БВ, и является фактором риска преждевременных родов. В то время как БВ является состоянием с ослабленным иммунитетом, АВ, скорее, является патологией с повышенной иммунной реакцией. Лечение должно быть индивидуальным и зависеть от микроскопических характеристик.
J.-M. Bohbot [4] продемонстрировал результаты Международного исследования микробиоты, проведенного Институтом микробиоты BIOCODEX и Ipsos, с привлечением 6500 человек в 7 странах (Франция, Португалия, Испания, США, Бразилия, Мексика и Китай). Это эксклюзивное исследование выявляет общее непонимание вклада вагинальной микробиоты в здоровье и подчеркивает важную роль медицинских работников в обучении пациентов, особенно пожилых пациентов, роли вагинальной микробиоты и поведению, которого они должны придерживаться, чтобы сохранить ее как можно лучше.
Знаний о микробиоте, особенно о вагинальной, как правило, недостаточно среди женщин. Показано, что только 47% женщин знают и понимают, что такое влагалищная микробиота. Почти половине всех женщин не совсем ясна точная природа вагинальной флоры. При этом только 1 из 3 женщин сообщили, что врач объяснил им концепцию вагинальной микробиоты и ее назначение. Удивительным был факт, что, помимо ношения хлопчатобумажного нижнего белья, лишь небольшое число женщин придерживаются определенных практик для сохранения здоровья своей вагинальной микробиоты. Респонденты понимают, что сбалансированное питание (84%), физическая активность (76%) и отказ от курения (72%) необходимы для здоровья, следовательно, для положительного влияния на их микрофлору. Однако 45% опрошенных применяют регулярно/иногда вагинальные души с целью гигиены. Медицинские работники недостаточно вовлечены в предоставление информации о микробиоте, важности правильной интимной гигиены и инфекций: 65% женщин сообщили, что никогда не получали информации о вагинальной микробиоте, а 86% хотели бы получить больше информации о важности вагинальной микробиоты и ее влиянии на здоровье.
Вульва является первой линией защиты половых путей от инфекции. Загрязнения и выделения часто собираются в складках вульвы, а повышенная влажность, потоотделение, менструации и гормональные колебания влияют на рост и размножение микробов вульвы и нарушают видовой баланс, что может привести к появлению неприятного запаха и вульвовагинальным инфекциям. Кожа вульвы отличается от других участков кожи гидратацией, проницаемостью и потоотделением, а также испытывает трение при ношении одежды, подвергается травматизации при бритье и иногда половой жизни, более восприимчива к местным химическим средствам (в том числе и для интимной гигиены), чем, к примеру, кожа предплечья. Кожа половых органов уникальна тем, что она покрыта тонким роговым слоем, содержащим крупные волосяные фолликулы, что облегчает проникновение микробов и других веществ в кожу, нарушая ее микробиоту [4].
В целом поддержание здоровья микробиома влагалища и правильная интимная гигиена являются ключевыми аспектами женского здоровья в любом возрасте. Регулярное наблюдение и соблюдение рекомендаций специалистов помогут поддержать баланс микрофлоры и предотвратить развитие дисбиозов.
Тема интимной женской гигиены не получила достаточного внимания в медицинской литературе, что делает такое образование и просвещение населения приоритетом. В 2011 г. Королевский колледж акушеров и гинекологов (RCOG) провел обширный поиск литературы с целью разработки научно обоснованных рекомендаций, предназначенных для гинекологов общего профиля с целью улучшения первоначальной оценки и лечения кожных заболеваний вульвы. Аналогичным образом, сотрудники комитета Ближнего Востока и Центральной Азии (MECA) провели обширный поиск литературы, чтобы сформировать рекомендации по гигиене женских половых органов. Оба руководства предлагают ежедневное очищение вульвы с помощью нежного гипоаллергенного жидкого средства для подмывания.
Именно поэтому так важна надлежащая женская интимная гигиена с использованием должным образом разработанных и протестированных продуктов с ключевыми характеристиками, учитывая анатомо-физиологические особенности вульвы и влагалища: гипоаллергенность, отсутствие мыла, раздражающих веществ и антисептиков, pH-безопасность (в диапазоне от 4,5 до 9). Щелочная среда предусмотрена как дополнение в комплексе наружного лечения микозов, защита от сухости и поддержание сбалансированной микрофлоры [5].
На выставке конгресса FIGO был представлен новый для России бренд средств для интимной гигиены «Сафорель» (BIOCODEX, Франция), основанный в 1989 г. практикующим врачом и двумя докторами фармацевтики, специалистами в области фитотерапии. Их целью было создание эффективных и деликатных косметических средств женской гигиены. В результате постоянного поиска идеальных природных ингредиентов были открыты малоизученные свойства репейника, являющегося основой средств данного бренда. Репейник (Arctium lappa) – травянистое растение, известное с древних времен своим успокаивающим, смягчающим, а также мочегонным, противовоспалительным действием; применяется для улучшения самочувствия, лечения лихорадки, головокружения, боли в горле, инфекций, диабета, зубной боли, отеков, фурункулов, порезов, ран и выпадения волос.
Благодаря многочисленным доклиническим исследованиям (in vitro и in vivo) было обнаружено, что репейник проявляет множество биологических активностей и фармакологических функций, включая противовоспалительное, противозапорное, противопролиферативное, ангиогенное, антиоксидантное действие. Эти эффекты в основном объясняются богатством арктигенина, пектина, фруктоолигосахаридов, инулина, дикаффеоиловых кислот и фруктофурана, хлорогеновой кислоты, цинарина и флавоноидов (рутин, мирицетин, кверцетин, апигенин и кемпферол) [6].
Интересно, что в проведенных рандомизированных клинических исследованиях для оценки потенциала репейника при терапии некоторых заболеваний, таких как грипп, вирусная пневмония, COVID-19, обыкновенные угри, остеоартрит коленного сустава и абдоминальное ожирение, был показан сравнимый с традиционными препаратами эффект. Также A. lappa оказал значительное влияние в области нанотехнологий, внеся вклад в противомикробную, противораковую и антидиабетическую наномедицину. Неполярные фракции экстракта корня A. lappa обладают антибактериальным эффектом в отношении Salmonella spp., S. aureus, Escherichia coli, Pseudomonas aeruginosa, Listeria monocytogenes, Bacillus cereus, Proteus vulgaris и Candida albicans. Экстракт корня репейника, кроме того, проявлял противогрибковую активность в отношении Aspergillus niger и Penicillium hirsutum, а водно-спиртовой экстракт корней A. lappa оказывает бактерицидное действие в отношении E. coli и Salmonella abony.
Щелочерастворимые полисахариды корней A. lappa проявляют противовоспалительную активность, облегчая нарушение регуляции воспалительных цитокинов и окислительное повреждение, поскольку полисахариды подавляют секрецию провоспалительных цитокинов (интерлейкина (IL)-6, IL-1β и фактора некроза опухоли α) и повышение секреции IL-10, что имеет важное терапевтическое значение при зудящих дерматозах и отеке (в том числе аллергическом) [7]. Именно благодаря изученным и проверенным временем свойствам репейника линейка средств для интимной гигиены Сафорель эффективна и безопасна не только в качестве поддержания здоровой интимной гигиены, но и в комплексной терапии вульвовагинальных инфекций и зудящих дерматозов вульвы.
Клиническое наблюдение
Пациентка В., 35 лет обратилась во ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России с жалобами на зуд, жжение в области наружных половых органов, творожистые выделения, а также чувство инородного тела во влагалище. За последние 12 месяцев отмечает ежемесячное обострение симптомов БВ и кандидозного вульвовагинита, проходила неоднократное обследование и лечение по месту жительства с кратковременным эффектом.
Из анамнеза: вышеперечисленные жалобы, а также панические атаки появились после перенесенного COVID-19 в 2020 г., получала антидепрессанты, после которых появилась сухость в области вульвы и влагалища. Беременностей – 4, родов – 4 через естественные родовые пути.
При осмотре отмечалось зияние вульварного кольца, низкое расположение уретры, а также опущение стенок влагалища I степени. Выделения обильные творожистые, рН влагалища – 4,5 (рис. 2).
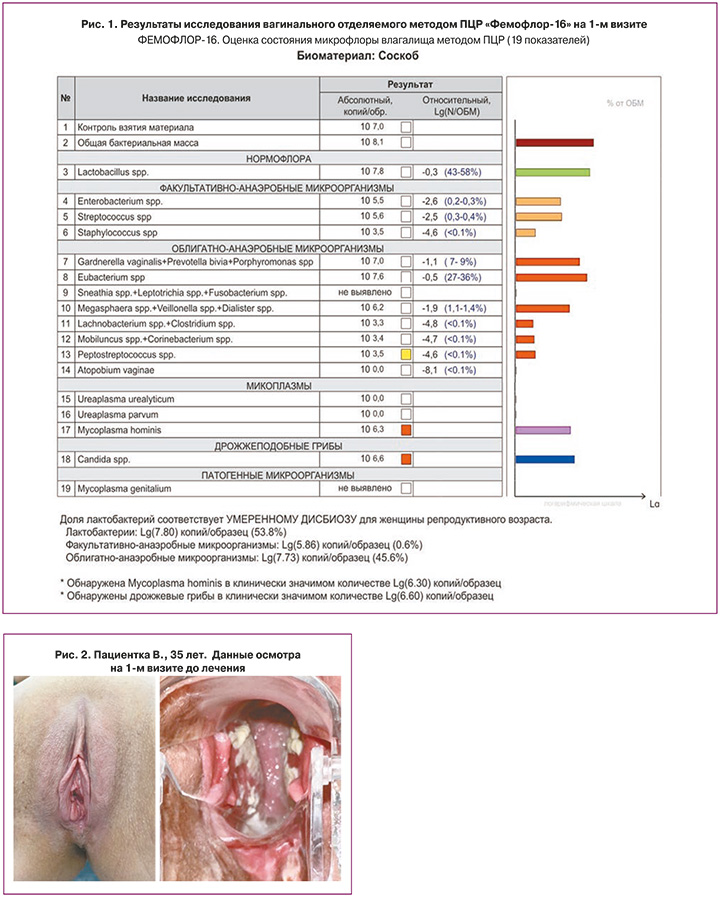
Данные проведенного на приеме обследования:
- «Фемофлор-16» – выраженный дисбиоз, снижение количества лактобактерий, преобладание анаэробной флоры, обнаружена Candida albicans (рис. 1);
- мазок из влагалища по Граму: лейкоциты до 7 в поле зрения. Микрофлора в большом количестве: морфотипы лактобацилл, единичные дрожжевые клетки, фрагменты псевдомицелия;
- бактериологический посев отделяемого из влагалища: рост Candida albicans – 104 КОЕ;
- в мазке из цервикального канала методом ПЦР обнаружен 18 тип ВПЧ, данные мазка на онкоцитологию – NILM.
Диагноз: Хронический кандидозный вульвовагинит, ремиссия. Рецидивирующий БВ. Опущение стенок влагалища I ст.
Проведены курс местной противовоспалительной терапии свечами с нифурателом, воздействие квадриполярной динамической радиоволной на область вульвы и влагалища на аппарате «ЕVА» № 4 – 1 раз в 2 недели, а также тренировка мышц тазового дна с помощью портативных приборов в домашних условиях с положительным эффектом.
Но через 2 недели пациентка снова вернулась на консультацию с рецидивом жалоб на зуд и сухость в области вульвы, обильные выделения с запахом, появившиеся после полового контакта. Пациентка призналась, что периодически практикует вагинальные спринцевания раствором мирамистина или водой из-под крана.
Проведено дообследование.
По данным анализа отделяемого влагалища на ПЦР «Фемофлор-16» – выраженный дисбиоз, снижение числа лактобактерий, БВ. В бактериологическом посеве отделяемого влагалища – рост факультативно-анаэробной флоры (рис. 3).
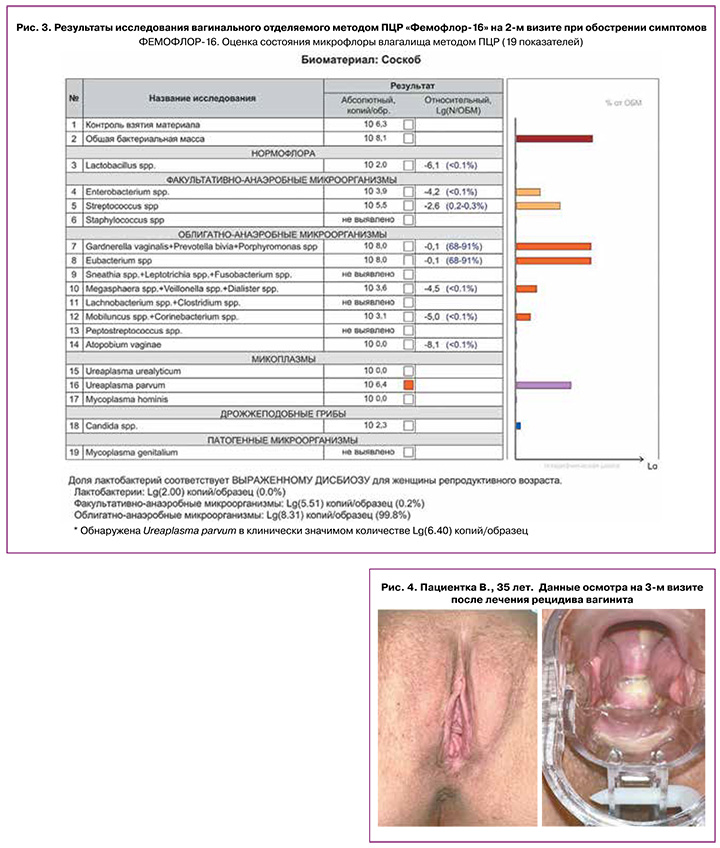
Пациентке подобран курс противорецидивной терапии: флуконазол 150 мг 1 раз в неделю на 6 месяцев, вагинально крем клиндамицин + бутоконазол на ночь 6 дней. Проведено информирование пациентки по основным принципам правильной интимной гигиены, подобрано средство Гель для интимной гигиены Бережное очищение «Сафорель» для устранения симптомов сухости и зуда в области вульвы.
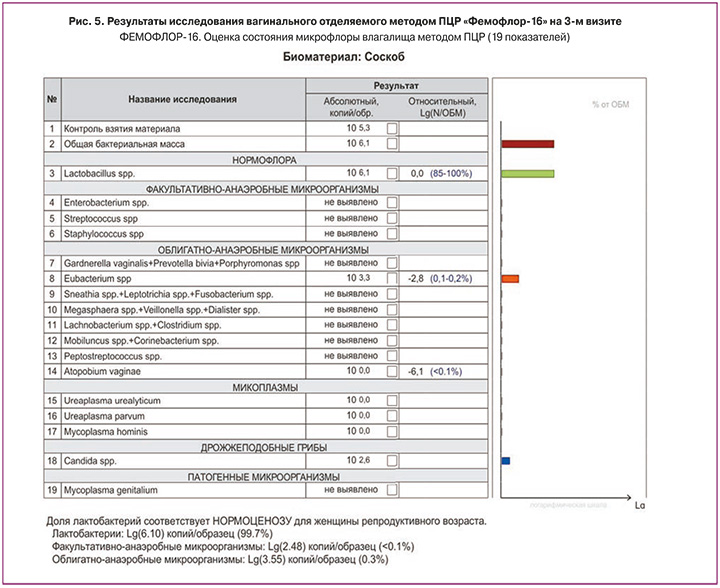
При повторном осмотре через 3 месяца пациентка жалоб активно не предъявляет (рис. 4), рецидивов за время наблюдения не отмечалось. Отмечался видимый клинический эффект со стороны кожи вульвы (рис. 4): устранение гиперемии, ощущения стянутости кожи, сухости. При контрольном исследовании отделяемого влагалища на ПЦР «Фемофлор-16» определяется нормоценоз (рис. 5). Рекомендовано продолжать противорецидивную терапию и интимную гигиену средством для интимной гигиены Бережное очищение «Сафорель» в сочетании с кремом-эмолентом увлажняющим для интимной зоны по принципу «намочить-намазать» («soak and seal»).
Большинству женщин с заболеваниями и симптомами дискомфорта в области вульвы (например, контактным дерматитом, вульвовагинитом) необходимы советы по уходу за кожей вульвы и тому, как избегать контактных раздражителей [8, 9].
В Руководстве RCOG [10] по уходу за кожей вульвы сформулированы принципиальные постулаты: подмывание водой может вызвать сухость кожи и усилить зуд. Рекомендовано использовать специальные средства для гигиены и воду, чтобы очистить вульву, а также лучше принимать душ, а не ванну. Необходимо использовать увлажняющие и смягчающие средства (эмоленты) как самостоятельно, так и после водных процедур по принципу «намочить-намазать» («soak and seal»).
В рекомендации МЕСА [11] по гигиене женских половых органов указано, что женщинам всех возрастов необходима ежедневная интимная гигиена, чтобы поддерживать чистоту области половых органов, при этом вульва может быть подвержена контактному дерматиту. Поэтому целесообразно использовать гипоаллергенное жидкое моющее средство с мягкими моющими свойствами.
Заключение
Важна роль врачей акушера-гинеколога и дерматовенеролога в предоставлении информации о принципах правильной интимной гигиены и основах сохранения и поддержания микробиоты вульвы и влагалища в равновесии.
Новая линейка средств «Сафорель» полностью соответствует современным требованиям к интимной гигиене женских половых органов и может также применяться при заболеваниях вульвы в комплексной терапии дерматозов и контактных дерматитов.



