Пробиотики – это живые микроорганизмы, которые благоприятно влияют на здоровье организма-хозяина [1]. Пробиотики в основном характеризуются своими особенностями in vitro [2]. Отбор пробиотиков основан на наличии у них генетической стабильности и на характеристиках фенотипа, способности к адгезии к слизистым оболочкам и к конкурентному вытеснению патогенных микроорганизмов, в том числе способности к выработке веществ с противомикробным действием [3–6].
L. Grzeskowiak и соавт. в 2010 г. показали, что отдельные штаммы Lactobacillus casei rhamnosus, выделенные из различных продуктов, обладают отличными от исходного штамма способностями к нарушению адгезии патогенных микроорганизмов к эпителиальным клеткам и к влиянию на патогенные микроорганизмы путем их вытеснения и ингибирования [7].
L. c. rhamnosus Lcr35 представляет собой широко известный пробиотический штамм, чьи характеристики in vitro и in vivo хорошо изучены [8–11]. Пробиотик Lcr35 используется с профилактическими и лечебными целями при показаниях.
Целью нашего исследования стало определение количества Lactobacillus casei rhamnosus, входящих в состав препарата лактожиналь (BESINS Healthcare, Бельгия), рН питательной среды при размножении этих лактобацилл, а также изучение антибиотикорезистентности и конкурентных взаимодействий с дрожжеподобными грибами рода Candida.
Материал и методы исследования
Использованные бактериальные штаммы
 В исследование включена лиофилизированная культура лактобацилл Lactobacillus casei вариант rhamnosus Döderlein (Lcr35), которая входит в состав препарата лактожиналь. Десятикратные разведения исследуемого штамма лактобацилл вносили в пробирки с жидкой питательной средой MRS (HiMedia, Индия), инкубировали при 37 °С в атмосфере, содержащей 10% CO2. При росте лактобацилл высевали исследуемый материал на чашки Петри с плотной питательной средой (Columbia agar Base, Oxoid, Великобритания) с 5% дефибринированной крови человека и сыворотки крупного рогатого скота (Биолот, Россия), инкубировали также при 37 °С в атмосфере, содержащей 10% CO2. Получали изолированные колонии лактобацилл, микроорганизмы идентифицировали микроскопическим методом с окраской препаратов по Граму и методом MALDI-TOF спектрометрии на приборе c программным обеспечением BioTyper (BRUKER Daltonics, Германия). В качестве контроля 1 использовали питательную среду MRS (HiMedia, Индия), в которую не вносили культуру лактобацилл; в качестве контроля 2 использовали физиологический раствор, в который вносили культуру L. c. rhamnosus.
В исследование включена лиофилизированная культура лактобацилл Lactobacillus casei вариант rhamnosus Döderlein (Lcr35), которая входит в состав препарата лактожиналь. Десятикратные разведения исследуемого штамма лактобацилл вносили в пробирки с жидкой питательной средой MRS (HiMedia, Индия), инкубировали при 37 °С в атмосфере, содержащей 10% CO2. При росте лактобацилл высевали исследуемый материал на чашки Петри с плотной питательной средой (Columbia agar Base, Oxoid, Великобритания) с 5% дефибринированной крови человека и сыворотки крупного рогатого скота (Биолот, Россия), инкубировали также при 37 °С в атмосфере, содержащей 10% CO2. Получали изолированные колонии лактобацилл, микроорганизмы идентифицировали микроскопическим методом с окраской препаратов по Граму и методом MALDI-TOF спектрометрии на приборе c программным обеспечением BioTyper (BRUKER Daltonics, Германия). В качестве контроля 1 использовали питательную среду MRS (HiMedia, Индия), в которую не вносили культуру лактобацилл; в качестве контроля 2 использовали физиологический раствор, в который вносили культуру L. c. rhamnosus.
Клинические штаммы дрожжеподобных грибов культивировали в жидкой питательной среде Сабуро (НИЦФ, Россия) при 37 °С до конечной концентрации 108 КОЕ/мл. В исследование были включены 10 штаммов Candida albicans, 2 штамма C. krusei, 3 штамма C. glabrata.
Определение уровня pH в процессе роста и накопления биомассы Lactobacillus casei вариант rhamnosus Döderlein (LCR35) in vitro
Исследовали рН жидкой питательной среды MRS в процессе роста Lactobacillus casei rhamnosus в первые пять часов и с 23 до 29 ч инкубации с помощью портативного лабораторного pH-метра (HANNA, Германия). В качестве контроля 1 и 2 использовали жидкую питательную среду MRS без лактобацилл и культуру Lactobacillus casei rhamnosus в физиологическом растворе.
Определение in vitro чувствительности штамма Lactobacillus casei rhamnosus, входящего в состав препарата лактожиналь, к антибактериальным препаратам
Суточную культуру Lactobacillus casei rhamnosus, выращенную на плотной питательной среде, помещали в физиологический раствор, доводили до 0,5 единиц мутности по McFarland. Полученную суспензию помещали на поверхность плотной питательной среды Мюллер–Хинтон (сухая основа BioRad, США) с добавлением 5% дефибринированной крови человека и сыворотки крупного рогатого скота (Биолот, Россия). Антибиотикорезистентность лактобацилл определяли диско-диффузионным методом [12]. Диски с антимикробными препаратами (Oxoid, Великобритания) помещали на поверхность плотной питательной среды с использованием диспенсера того же производителя.
В набор для определения антибиотикорезистентности лактобацилл входили диски, содержащие следующие концентрации антимикробных препаратов: пенициллин 6 мкг, ампициллин 10 мкг, амоксиллин 20 мкг + клавуланат 10 мкг, карбенициллин 100 мкг, гентамицин 10 мкг, нетилмицин 30 мкг, хлорамфеникол 30 мкг, офлоксацин 5 мкг, ципрофлоксацин 5 мкг, левофлоксацин 5 мкг, цефазолин 30 мкг, цефтазидим 30 мкг, цефотаксим 30 мкг, эритромицин 15 мкг, азитромицин 15 мкг, клиндамицин 2 мкг, метронидазол 5 мкг. Измерение и интерпретацию зон задержки роста проводили на микробиологическом анализаторе BioMic V3 (Giles Scientific, США) с использованием Таблиц EUCAST и CLSI [13, 14].
Определение ингибирующих свойств Lactobacillus casei rhamnosus по отношению к дрожжеподобным грибам рода Candida
Использована суточная культура Lactobacillus casei rhamnosus и суточная культура 10 клинических штаммов C. albicans, 2 штаммов C. krusei, 3 штаммов C. glabrata. Каждую культуру дрожжеподобных грибов соединяли с культурой лактобацилл в равных частях. Конечная концентрация бактерий – 108 КОЕ/мл. В качестве отрицательного контроля использовали жидкие питательные среды для культивирования лактобацилл и дрожжеподобных грибов. В качестве положительного контроля использовали жидкую питательную среду Сабуро (НИЦФ, Россия) с выращенными штаммами дрожжеподобных грибов, культивируемых без лактобацилл, и среду MRS с выращенными лактобациллами без дрожжеподобных грибов. Количество дрожжеподобных грибов определяли на плотной питательной среде Chromogenic Candida agar (Oxoid, Великобритания) после высева из жидких питательных сред количественным методом Gold через 24, 48 и 72 ч. Результаты учитывали до совместного культивирования лактобацилл и дрожжеподобных грибов, сразу после соединения культур лактобацилл и дрожжеподобных грибов и через 24, 48, 72 ч культивирования при 37 °С в атмосфере, содержащей 10% CO2. При этом определяли рН питательной среды и количество дрожжеподобных грибов.
Результаты исследования
Определение жизнеспособности, количества и чистоты культуры штамма лактобацилл, входящих в состав препарата лактожиналь (BESINS Healthcare, Бельгия)
 На среде MRS отмечали рост лактобацилл во всех пробах. На Columbia agar был отмечен однородный рост мелких полупрозрачных колоний 1–2 мм в диаметре с зоной гемолиза разной степени выраженности. Морфология выделенных микроорганизмов была типичной для лактобацилл: грамположительные палочки с ровными краями, не образующие спор, расположенные хаотично. По результатам MALDI-TOF масспектрометрии с дальнейшим сравнением с базой данных масспектров BioTyper бактерии идентифицированы как Lactobacillus rhamnosus. Количество жизнеспособных бактерий составило 1011 КОЕ/мл. Препарат лактожиналь содержит чистую культуру Lactobacillus casei rhamnosus в достаточно большом количестве.
На среде MRS отмечали рост лактобацилл во всех пробах. На Columbia agar был отмечен однородный рост мелких полупрозрачных колоний 1–2 мм в диаметре с зоной гемолиза разной степени выраженности. Морфология выделенных микроорганизмов была типичной для лактобацилл: грамположительные палочки с ровными краями, не образующие спор, расположенные хаотично. По результатам MALDI-TOF масспектрометрии с дальнейшим сравнением с базой данных масспектров BioTyper бактерии идентифицированы как Lactobacillus rhamnosus. Количество жизнеспособных бактерий составило 1011 КОЕ/мл. Препарат лактожиналь содержит чистую культуру Lactobacillus casei rhamnosus в достаточно большом количестве.
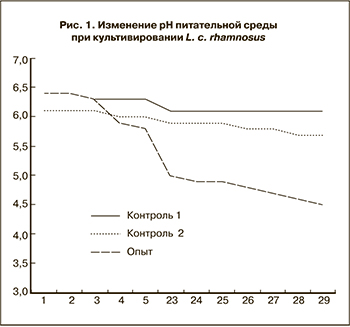
Определение in vitro уровня pH питательной среды в процессе роста и накопления биомассы лактобацилл, входящих в состав препарата лактожиналь
По мере накопления биомассы лактобацилл и продуктов их жизнедеятельности в питательной среде MRS происходило снижение pH с 6,5 до 4,5 при наблюдении в течение 29 ч культивирования. Уровень pH питательной среды MRS без лактобацилл (контроль 1) и рН физиологического раствора с культурой лактобацилл, в котором они не размножались (контроль 2), оставался на уровне 5,7–6,4. Результаты определения рН представлены на рис. 1.
Определение чувствительности штамма Lactobacillus c. rhamnosus к антибактериальным препаратам in vitro, наиболее часто назначаемым в гинекологической практике
Как видно из результатов исследования, представленных в таблице, L. c. rhamnosus оказались чувствительными к пенициллинам, аминогликозидам, хлорамфениколу, фторхинолонам. Резистентны эти лактобациллы к цефалоспоринам I и III поколения, макролидам, линкозамидам, метронидазолу.
Оценка ингибирующего действия L. c. rhamnosus на дрожжеподобные грибы рода Candida
При совместном культивировании L. c. rhamnosus и разных штаммов и видов дрожжеподобных грибов рода Candida уровень рН через 24, 48 и 72 ч был в пределах 3,5. При культивировании только лактобацилл рН питательной среды также был в этих пределах. При культивировании дрожжеподобных грибов рода Candida и в двух отрицательных контролях уровень рН колебался от 6,5 до 7,5 в течение 72 ч инкубации (рис. 2 см. на вклейке).
На рис. 3 (см. на вклейке) представлены данные совместного культивирования 10 штаммов C. albicans и L. c. rhamnosus в течение 72 ч. Из данных, представленных на этом рисунке, видно, что при начальной концентрации C. albicans 108 КОЕ/мл через 72 ч культивирования количество этих дрожжеподобных грибов значительно снижается – до 106 , 104 и 103 КОЕ/мл. Концентрация одного штамма C. albicans через 72 ч была сведена к нулю, этот штамм C. albicans в присутствии L. c.rhamnosus погиб.
На рис. 4 (см. на вклейке) представлены данные совместного культивирования в течение 72 ч 2 штаммов C. krusei, 3 штаммов C. glabrata и L. c. rhamnosus. Для разных штаммов этих видов дрожжеподобных грибов были получены разные результаты. Оба штамма C. krusei сохранили свою концентрацию 108 КОЕ/мл в течение 72 ч инкубации. Что касается C. glabrata, то под воздействием L. c. rhamnosus их концентрация была снижена через 72 ч совместного инкубирования с 108 КОЕ/мл до 106 КОЕ/мл для одного штамма и до нуля для двух штаммов.
Обсуждение
Лактобациллы составляют основу физиологического микробиоценоза влагалища. Они формируют колонизационную резистентность влагалища, участвуют в контроле вагинальной микрофлоры, конкурируя с другими микроорганизмами за адгезию к эпителиальным клеткам, разрушая, таким образом, биопленку, состоящую из патогенных микроорганизмов и/или ингибируя рост потенциальных патогенных микроорганизмов. Применение пробиотических препаратов, в состав которых входят штаммы лактобацилл, способных колонизировать влагалище при нарушенном микробиоценозе, особенно после или на фоне применения антибактериальных препаратов, представляет интерес как в отношении профилактики, так и в отношении лечения дисбиотических состояний влагалища [15, 16].
Исследование количества и качества лактобацилл, входящих в состав современных пробиотических препаратов, позволяет предлагать пробиотики, содержащие живые, ферментативно активные лактобациллы, способные к адгезии на эпителиальные клетки и к размножению в вагинальном биотопе. В состав препарата лактожиналь входит лиофилизированная культура лактобацилл Lactobacillus casei вариант rhamnosus Döderlein (Lсr35). В литературе описаны исследования по изучению адгезивных свойств этих лактобацилл. Нам было важно доказать наличие живых бактерий в достаточном количестве (более 1011 КОЕ/мл), способных колонизировать вагинальный эпителий. В 2008 г. S. Coudeyras, G. Jugie, M. Vermerie и C. Forestier показали, что именно эти штаммы лактобацилл способны in vitro к специфической и быстрой (в течение 1 ч) адгезии к клеткам влагалища, экзо- и эндоцервикса [8]. Авторы сделали вывод, что адгезия лактобацилл к клеткам эпителия влагалища может привести к колонизации слизистой оболочки влагалища и, таким образом, ограничить избыточный рост патогенных микроорганизмов.
Второй главной особенностью потенциальных пробиотиков является прямое подавление роста и размножения патогенных и условно патогенных микроорганизмов. В ходе исследования F. Atassi и соавт. (2006) было показано, что исследуемый штамм лактобацилл обладает бактерицидной активностью в отношении P. bivia и G. vaginalis. Авторы показали, что бактерицидная активность лактобацилл в отношении двух указанных видов микроорганизмов влагалища зависела от штамма и проявлялась в течение первых часов совместного культивирования [17]. Механизмы, лежащие в основе этой активности, не установлены, но, вероятно, они многофакторные и могут включать продукцию лактобациллами перекиси водорода, молочной кислоты и веществ с антибактериальным действием.
В нашем исследовании мы выявили явные конкурентные взаимоотношения дрожжеподобных грибов рода Candida и L. c. rhamnosus. Особенно это относится к C. albicans и C. glabrata. Ранее M. Strus и соавт. (2005) отметили, что у некоторых штаммов лактобацилл был выявлен ингибирующий эффект в отношении C. albicans [18]. Угнетая избыточный рост Candida во влагалище, лактобациллы могут обеспечивать колонизационную устойчивость и поддерживать низкий уровень концентрации дрожжевых клеток, что особенно актуально для профилактики развития кандидоза на фоне антибактериальной терапии.
Обнадеживающие результаты получены нами при определении антибиотикорезистентности L. c. rhamnosus. Неудивительно, что эти лактобациллы чувствительны к пенициллинам. Это грамположительные микроорганизмы, а как известно, пенициллины действуют на клеточную стенку всех грамположительных бактерий. Следует отметить и подчеркнуть, что L. c. rhamnosus устойчивы к клиндамицину и метронидазолу. Эти антибактериальные препараты применяются для лечения бактериального вагиноза. Для лечения ряда инфекций, передаваемых половым путем, таких как хламидиоз, инфекции, ассоциированные с Mycoplasma genitalium, часто применяются макролиды. Эти лактобациллы устойчивы к наиболее часто применяемым макролидам. Поэтому перспективно заключение о том, что лактожиналь, содержащий L. c. rhamnosus в высокой концентрации, может быть использован не только в качестве препарата для восстановления нарушенного микробиоценоза влагалища после назначения антибиотиков, но и сразу на фоне антибактериальной терапии.
В результате клинических исследований по применению интравагинальных лактобацилл рядом исследователей сделано заключение, что это может привести к увеличению количества лактобацилл во влагалище и к восстановлению вагинальной микрофлоры до нормального состояния. L. Petricevic и A. Witt (2008) в ходе клинического исследования показали, что интравагинальное применение лактобацилл улучшает восстановление микрофлоры влагалища после лечения бактериального вагиноза антибиотиками [19].
Заключение
Поддержание или восстановление физиологического состава микрофлоры влагалища с применением правильно выбранных штаммов лактобацилл может быть ценным в профилактике и лечении инфекций мочеполовой системы у женщин. Пробиотический препарат лактожиналь, содержащий в своем составе живые бактерии L. c. rhamnosus в достаточной концентрации, которые способны угнетать рост дрожжеподобных грибов и резистентны к группам антимикробных препаратов, наиболее часто используемым в акушерстве и гинекологии, является весьма перспективным для профилактики бактериального вагиноза и кандидозного вульвовагинита. Этот препарат может быть использован для восстановления нарушенного микробиоценоза влагалища как у небеременных, так и у беременных женщин в любые сроки беременности.



