Согласно последнему отчету РАРЧ за 2018 г. [1], частота наступления беременности на перенос эмбрионов даже в программах экстракорпорального оплодотворения (ЭКО) с использованием донорских (идеальных по качеству) эмбрионов составляет 46%, т.е. все еще очень далека от идеальных 100% на одну выполняемую попытку. Этот факт подтверждает мнение патриарха современной репродуктологии Роберта Эдвардса о том, что даже полное устранение эмбрионального фактора бесплодия отнюдь не гарантирует успеха программ вспомогательных репродуктивных технологий (ВРТ), поскольку остается еще эндометриальный фактор (ослабление рецептивности эндометрия), на долю которого приходится примерно 50% всех случаев женского бесплодия [2]. Именно эндометриальный фактор является сегодня главной помехой для реализации терапевтического потенциала любых программ ВРТ [3–5]. Поэтому представляется логичной целесообразность концентрации усилий исследователей на уточнении подходов к профилактике и лечению всего того многообразия гинекологической патологии, которая ассоциируется с эндометриальным фактором женской инфертильности.
Принимая во внимание негативное влияние эндометриального фактора на результаты лечения бесплодия с применением ВРТ, необходимо детальное изучение структуры внутриматочной патологии и выделение в ней наиболее значимых (по критерию частоты выявления) патологических проявлений, на которых следует акцентировать внимание в первую очередь, решая общую проблему повышения эффективности методов ВРТ. Гиперпластические процессы в эндометрии (ГПЭ), включающие в подавляющем большинстве случаев железистую гиперплазию без атипии (по терминологии упрощенной бинарной классификации гиперплазии эндометрия, принятой ВОЗ в 2014 г.) и полипы эндометрия, традиционно относят к числу достаточно часто выявляемой патологии у женщин с бесплодием. Однако сообщения о доле этих вариантов ГПЭ в общей структуре внутриматочной патологии существенно разнятся [6–8]. Остаются дискутабельными и вопросы, касающиеся факторов риска ГПЭ; но, тем не менее, наиболее значимыми из них признаются те, которые способствуют абсолютной или относительной гиперэстрогении, например, ожирение, длительный прием эстрогенсодержащих препаратов, эстрогенсекретирующие опухоли [9–11]. Гиперэстрогению, наблюдаемую в результате стимуляции суперовуляции при выполнении стандартного ЭКО или при применении препаратов эстрогенов для подготовки эндометрия в циклах с переносом донорских или собственных размороженных эмбрионов (ЭКО-ОД и ЭКО-крио), теоретически также можно было бы рассматривать как фактор риска ГПЭ. Однако представляется неясным, может ли такая гиперэстрогения, учитывая ее непродолжительность при выполнении указанных программ ЭКО, и в самом деле увеличивать инцидентность ГПЭ. Приходится констатировать, что до настоящего времени в литературе не было представлено данных о том, действительно ли существует разница в частоте выявления ГПЭ между инфертильными пациентками, которые использовали или не использовали в прошлом лечение, предусматривавшее применение ЭКО со стимуляцией суперовуляции, или эстрогенную подготовку эндометрия к переносу эмбрионов. Очевидно, что ответ на этот вопрос помог бы составить более четкое представление о том, нуждаются ли пациентки указанных программ ЭКО в профилактике ГПЭ в периодах между выполняемыми лечебными циклами, которые повторяют (нередко многократно) из-за неудач предыдущих попыток достижения беременности.
Цель работы: в неселективном контингенте пациенток программ ВРТ уточнить частоту и структуру внутриматочной патологии.
Материалы и методы
В соответствии с поставленной целью под наблюдение были взяты 973 инфертильные женщины с показанием к использованию ВРТ. Возраст обследованных варьировал от 22 до 44 лет. Все наблюдавшиеся больные были распределены в группы <35 лет (n=568) и ≥35 лет (n=405).
Исходное обследование проводилось согласно приказу Министерства здравоохранения РФ от 31 июля 2020 г. № 803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». На данном этапе предусматривалось выделение пациенток с подозрением на наличие маточного фактора бесплодия, о вероятном наличии которого могло свидетельствовать [12]:
- при сборе анамнеза: указание пациенткой на аномальные маточные кровотечения, менометроррагию, длительные мажущие выделения;
- при скрининговом ультразвуковом исследовании (УЗИ) – выявление эхографических признаков той или иной маточной патологии.
К группе пациенток с подозрением на наличие патологии матки мы также относили женщин, не имеющих ее очевидных признаков, но указывающих на неоднократное (>1 раза) безуспешное использование ЭКО с эмбрионами хорошего качества или привычное невынашивание беременности.
У выделенных женщин с предполагаемым маточным фактором бесплодия предусматривалась нозологическая идентификация внутриматочной патологии с помощью офисной или стандартной гистероскопии и гистоморфологического исследования.
Офисную гистероскопию назначали в неочевидных случаях наличия внутриматочной патологии, при которых исходно не предполагалось обязательное выполнение хирургических манипуляций.
Стандартную гистероскопию использовали у больных с явными признаками внутриматочной патологии, требующей ее обязательной хирургической коррекции.
Гистоморфологическому исследованию подвергали образцы тканей, полученных:
- при прицельной биопсии, проводимой под контролем офисной или стандартной гистероскопии;
- в результате хирургических манипуляций, осуществляемых при стандартной гистероскопии;
- при пайпель-биопсии или раздельном диагностическом выскабливании.
При изучении структуры морфологически верифицированной внутриматочной патологии предусматривалась оценка доли ГПЭ, включающей железистую гиперплазию без атипии и полипы эндометрия.
Инцидентность ГПЭ определяли с учетом возраста пациентки (< или ≥35 лет) и использования в прошлом программ ВРТ с применением стимуляции суперовуляции (стандартное ЭКО) или с назначением препаратов эстрогенов для подготовки эндометрия к переносу эмбрионов.
Мы не принимали во внимание и, соответственно, не анализировали влияние на инцидентность ГПЭ выполнявшихся в прошлом программ:
- с использованием внутриматочной инсеминации или ЭКО в естественных циклах;
- со стимуляцией яичников (с применением кломифена цитрата или низких доз гонадотропинов) для индукции монофолликулярного ответа в естественных циклах.
Результаты
Исследование распространенности внутриматочной патологии среди взятых под наблюдение 973 пациенток программ ВРТ показало (рис. 1), что у 327/973 (34%) женщин имелись подозрения или ее признаки по данным анамнеза (аномальные маточные кровотечения, менометроррагия и др.) и скринингового УЗИ матки. Еще у 218/973 (22%) больных, несмотря на отсутствие подтверждающей информации при исходном рутинном обследовании, можно было заподозрить наличие внутриматочной патологии на основании факта неоднократного (>1 раза) безуспешного использования в прошлом ЭКО с эмбрионами хорошего качества или при указании женщиной на привычное невынашивание беременности. Таким образом, при предварительном уточнении причины бесплодия, включавшем опрос, стандартное гинекологическое исследование и данные УЗИ, частота пациенток с предполагаемым наличием внутриматочной патологии в общем контингенте обследованных составила 545/973 (56%).
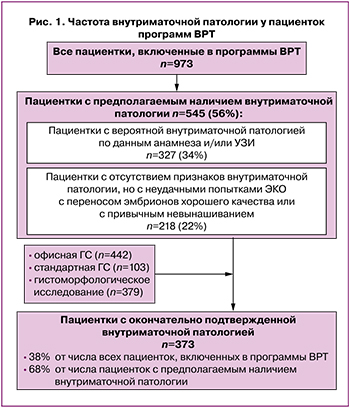
Последующее обследование выделенных 545 пациенток с предполагаемым наличием внутриматочной патологии с использованием офисной или стандартной гистероскопии и гистоморфологических методов позволило подтвердить и нозологически идентифицировать имеющиеся патологические изменения в матке у 373 больных. Из этих наблюдений следует, что доля женщин с верифицированной внутриматочной патологией достигает: 373/973 (38%) в общем контингенте пациенток программ ВРТ; 373/545 (68%) среди пациенток с предполагаемыми (на основе результатов опроса, объективного обследования и скринингового УЗИ) изменениями в матке.
В структуре внутриматочной патологии, морфологически верифицированной у 373 больных, наибольшую долю 164/373 (44%) составили ГПЭ, включавшие железистую гиперплазию без атипии и полипы эндометрия (рис. 2). Гипопластические процессы (синехии полости матки и цервикального канала, синдром Ашермана и гипоплазия эндометрия) были диагностированы у 157/373 (42%) пациенток с внутриматочной патологией.
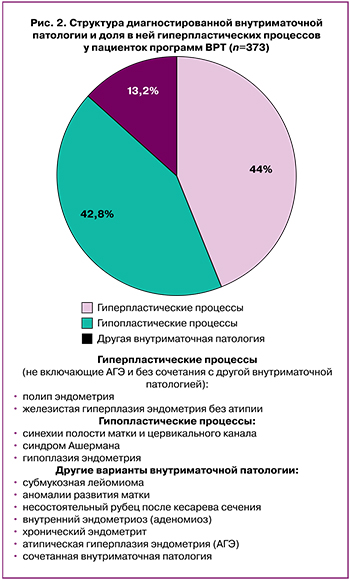
Другие варианты внутриматочной патологии характеризовались большим нозологическим разнообразием, но суммарно наблюдались лишь в 49/373 (13,2%) случаев. Так, у небольшого процента больных встречались: субмукозная лейомиома, аномалии развития матки, несостоятельный рубец после кесарева сечения, внутренний эндометриоз (аденомиоз), хронический эндометрит, атипическая гиперплазия эндометрия (АГЭ) (всего 1 случай), а также сочетанная внутриматочная патология.
К сочетанной внутриматочной патологии мы относили и случаи ГПЭ, если они сопутствовали другой внутриматочной патологии, например, лейомиоме. Поэтому следует подчеркнуть, что рассчитанная нами доля ГПЭ в общей структуре внутриматочной патологии отображает частоту ее встречаемости только в изолированном виде, т.е. без сочетания с какими-либо другими заболеваниями, поражающими внутреннюю поверхность матки.
Также нужно отметить, что случаи АГЭ, традиционно рассматриваемые как предраковый процесс, мы не включали в группу пациенток с ГПЭ, а относили к «другой» патологии. В нашем исследовании АГЭ была обнаружена только у 1 пациентки, из чего следует, что доля АГЭ составляет не более 1/373 (0,26%) в структуре верифицированной внутриматочной патологии и не более 1/973 (0,1%) от числа всех пациенток, включенных в программы ВРТ. Здесь, однако, необходимо указать, что для точного суждения об истинной инцидентности АГЭ, с учетом редкости ее обнаружения, требуется гораздо большее число наблюдений. Поэтому наши данные о частоте АГЭ, рассчитанные в относительно небольшой популяционной выборке, не являются действительно репрезентативными в отношении всей генеральной совокупности женщин, включаемых в программы ВРТ.
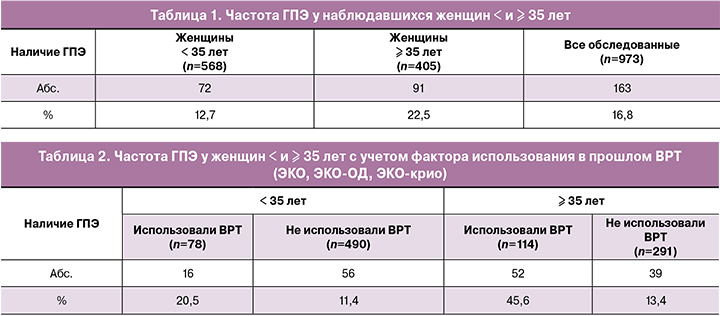
При изучении распределения 163 выявленных случаев ГПЭ среди всех наблюдавшихся пациенток программ ВРТ с учетом их возраста было установлено (табл. 1), что они чаще диагностировались у пациенток старше 35 лет – 91/405 (22,5%) против 72/568 (12,7%) у более молодых женщин. Анализ этих же данных позволяет отметить следующие закономерности (табл. 2):
- среди женщин, использовавших в прошлом перечисленные варианты ВРТ, в сравнении с пациентками того же возраста, отрицающими это обстоятельство, частота ГПЭ была выше, как в группе < 35 лет (16/78 (20,5%) против 56/490 (11,4%)), так и в группе ≥35 лет (52/114 (45,6%) против 39/291 (13,4%));
- у пациенток в возрасте < и ≥ 35 лет, использовавших в прошлом эти же программы ВРТ, частота ГПЭ оказалась более высокой среди пациенток старше 35 лет (52/114 (45,6%) против 16/78 (20,5%));
- среди пациенток разного возраста, не использовавших в прошлом ВРТ с применением стандартного ЭКО, ЭКО-ОД или ЭКО-крио, частота ГПЭ сохранялась практически на одном и том же уровне, составляя у пациенток младше и старше 35 лет, соответственно, 56/490 (11,4%) и 39/291 (13,4%).
Сопоставление данных, приведенных в таблицах 1 и 2, приводит к заключению, что увеличение частоты ГПЭ в группе женщин старше 35 лет обусловливается не самим возрастным фактором. Очевидно, что данная закономерность ассоциируется с резким возрастанием инцидентности ГПЭ среди тех пациенток >35 лет, которые перенесли в прошлом стимуляцию суперовуляции (в программе стандартного ЭКО) или эстрогенную подготовку эндометрия к переносу эмбрионов (ЭКО-ОД или ЭКО-крио). Необходимо подчеркнуть, что частота ГПЭ у женщин старше 35, не использовавших в прошлом данные варианты ВРТ, оказалась практически такой же, как у более молодых пациенток (39/291 (13,4%) против 56/490 (11,4%)). Именно это наблюдение указывает на решающее значение для риска увеличения инцидентности ГПЭ у пациенток старше 35 лет не только возраста, но и фактора использования в прошлом программ ВРТ, включающих стандартное ЭКО, ЭКО-ОД, или ЭКО-крио.
Обсуждение
Полученные результаты позволяют констатировать, что внутриматочная патология, верифицируемая при офисной или стандартной гистероскопии и гистоморфологическом исследовании, обнаруживается более чем у 1/3 всех пациенток программ ВРТ и у 2/3 женщин с подозрением на маточную форму бесплодия по данным опроса и исходного обследования, включающего УЗИ. Это наблюдение согласуется с сообщениями других специалистов [13], также указывающих на большую распространенность маточного фактора бесплодия. Здесь, однако, надо отметить, что приведенные нами цифровые данные о частоте верифицированной внутриматочной патологии распространяются именно на неселективную популяцию инфертильных женщин, нуждающихся в лечении с использованием ВРТ. Не приходится сомневаться, что случаи наличия поражений эндометрия могут встречаться чаще в группах, селективно отобранных с учетом известных факторов риска для развития патологических процессов в матке. Так, анализ данных многих публикаций отмечает связь частоты выявляемых случаев внутриматочной патологии с ожирением, хронической ановуляцией, эндокринными расстройствами (сахарным диабетом 2-го типа, метаболическим синдромом, гипотиреозом), отклонениями в становлении менструальной функции, частыми инвазивными внутриматочными вмешательствами, длительным приемом гормональных средств [9–11].
При установлении причин инфертильности важную роль следует отводить офисной гистероскопии. По нашему мнению, следует шире использовать этот метод вместо стандартной гистероскопии в ситуациях, когда отсутствуют явные признаки внутриматочной патологии, требующей хирургической коррекции. Данное заключение вытекает из собственных наблюдений, согласно которым при выполнении офисной гистеросокпии внутриматочная патология не обнаруживалась почти у половины пациенток, использовавших данную диагностическую процедуру. Следовательн, можно предположить, что если бы таким женщинам была назначена обычная гистеросокпия, то это не улучшило бы качества диагностики. При этом, учитывая значительно большую травматичность стандартной гистеросокпии в сравнении с ее офисной модификацией, можно было бы ожидать увеличения частоты разного рода осложнений, ассоциируемых с инвазивными внутиматочными вмешательствами. Очевидно, что офисную гистеросокпию, прежде всего, следует назначать больным с сомнительными результатами эхографического исследования, в особенности тем из них, кто перенес неудачные попытки ЭКО с переносом качественных эмбрионов хорошего качества или пациенткам с привычным невынашиванием беременности.
В структуре внутриматочной патологии, окончательно подтвержденной при гистоморфологическом исследовании, почти половина случаев приходилась на ГПЭ, проявлявшиеся в виде железистой гиперплазии и полипов, которые в Международной классификации болезней 10-го пересмотра имеют коды, соответственно, N85.0 и N84.0. Данное наблюдение указывает на особую значимость именно ГПЭ, как возможной причины инфертильности у пациенток с маточным фактором бесплодия. У женщин с ГПЭ нарушение репродуктивной функции, вероятно, связано с недостаточной секреторной трансформацией эндометрия, препятствующей нидации оплодотворенной яйцеклетки. Причиной этого может быть ослабление локальных эффектов прогестерона на фоне повышения чувствительности эндометрия к эстрогенам при нарушениях сигнальных взаимодействий в системе гормон-рецептор [9, 14]. При полипах эндометрия еще одной причиной, препятствующей успешной имплантации, являются возможные механические препятствия, создаваемые объемными анатомо-морфологическими изменениями внутреннего слоя матки, в особенности при их расположении вблизи трубных углов [15, 16].
Обнаруживаемая высокая частота ГПЭ у женщин с вероятным маточным фактором бесплодия диктует необходимость совершенствования мероприятий, оказывающих профилактический эффект в отношении риска индукции ГПЭ. Исходя из роли эстрогенов в регуляции митотической активности клеток эндометрия [14], нельзя исключить, что в программах ВРТ транзиторная гиперэстрогения при выполнении стимуляции суперовуляции или при эстрогенной подготовке эндометрия к переносу эмбрионов может создавать предпосылку для увеличения частоты ГПЭ. Исходя из наших наблюдений, позволяющих подтвердить данное предположение, неожиданным оказалось то, что данная закономерность значительно контрастнее проявляла себя у пациенток старше 35 лет. При этом можно предположить, что возрастание частоты ГПЭ связано не только с возрастным фактором, но и использованием значительного количества программ ВРТ. Наши наблюдения показали, что возрастание частоты ГПЭ отмечается только среди пациенток старше 35 лет, которым в прошлом назначали лечение с использованием ВРТ. То обстоятельство, что частота ГПЭ у пациенток, ранее использовавших ВРТ, оказалась значительно большей среди пациенток старше 35 лет мы объясняем следующими причинами:
- у женщин более старшего возраста из-за ослабленного ответа яичников в циклах ЭКО с переносом свежих эмбрионов нередко требуется более интенсивная и продолжительная гонадотропная стимуляция, сопровождаемая более высокой гиперэстрогенией;
- в циклах ЭКО-ОД и ЭКО-крио с эстрогенной подготовкой эндометрия к переносу донорских или собственных размороженных эмбрионов у женщин позднего репродуктивного возраста в сравнении с более молодыми пациентками чаще приходится увеличивать дозу и продолжительность использования препаратов эстрогенов, т.е. более длительно поддерживать гиперэстрогенное состояние;
- у пациенток более старшего возраста в среднем отмечается большее число использованных ранее попыток лечения бесплодия с применением программ ВРТ, включающим стандартное ЭКО, ЭКО-ОД или ЭКО-крио.
Принимая во внимание данные о выполнявшихся в прошлом программах стандартного ЭКО, ЭКО-ОД или ЭКО-крио и последующим возрастанием частоты ГПЭ, можно предположить пользу назначения антиэстрогенных средств в периодах между проводимыми лечебными циклами в случаях неудачи предыдущих попыток. Однако требуется уточнить показания к такому лечению на основе учета причинных факторов бесплодия и особенностей выявляемой внутриматочной патологии. Например, очевидно, что профилактическая в отношении ГПЭ антиэстрогенная терапия между выполняемыми попытками преодоления бесплодия не имеет никакого теоретического обоснования для назначения больным с внутриматочной патологией, ассоциируемой с гипопластическими процессами в эндометрии, пороками развития матки, хроническим эндометритом или несостоятельным рубцом после кесарева сечения. Вероятно, наибольшую пользу назначение антиэстрогенов между циклами с применением указанных программ ВРТ может принести женщинам, перенесшим выскабливание эндометрия по поводу исходно существовавшей ГПЭ, с целью профилактики ее рецидива, а также пациенткам с гиперэстрогенным статусом (сопутствующим, например, ожирению). Также следует уточнить вопрос о предпочтительности выбора конкретного препарата для профилактики ГПЭ. Пока можно лишь предполагать, что для такой цели будет особенно полезно назначать Дюфастон, который в сравнении с другими препаратами лучше переносится, но при этом обладает достаточно выраженным антипролиферативным эффектом, ослабляющим ГПЭ [17, 18].
Заключение
В неселективной популяции пациенток программ ВРТ у женщин с внутриматочной патологией в ее структуре доминируют ГПЭ, проявляемые в виде железистой гиперплазии без атипии и полипов эндометрия.



