В настоящее время врожденная дисфункция коры надпочечников неклассической формы (ВДКН НФ) стала распространенным заболеванием. Она занимает третью позицию среди эндокринопатий после сахарного диабета и заболеваний щитовидной железы [1]. Это одна из самых частых причин вирильного синдрома, ановуляторного бесплодия и невынашивания беременности, что обусловлено не только улучшением возможностей выявления заболевания. С применением глюкокортикоидов (ГК) улучшилась фертильность женщин с ВДКН, то есть мутация гена CYP 21В передается потомству. Частота этого заболевания будет и в дальнейшем расти [2, 3].
Важно подчеркнуть, что пока нет Консенсуса по лечению ВДКН НФ, в том числе по лечению бесплодия и ведению беременности и родов у женщин с ВДКН НФ [4]. В последние годы появились сообщения о том, что применение ГК беременным женщинам с ВДКН уменьшает частоту выкидышей [2, 5]. Однако опасения пагубного влияния ГК и на организм матери, и на плод появились давно и прочно укоренились в медицинской практике [6, 7].
Высказано мнение, что ГК терапия при беременности вызывает гестационный сахарный диабет [8], причем углеводный обмен нарушается не только у матери, но и у плода. Поэтому при ВДКН НФ у беременных нередко полностью избегают назначения ГК или применяют эпизодически, например, только в I триместре, а затем отменяют [9].
В отечественной и зарубежной литературе имеются публикации о рождении совершенно здоровых детей на фоне применения ГК женщинам с ВДКН в течение всей беременности [2, 10]. Тем не менее, пока не было изучения этого вопроса, основанного на доказательной медицине, не разработаны правила мониторинга ГК терапии этого заболевания [11].
Нет указаний о подготовке женщин с ВДКН к беременности при планировании. Общепризнано, что терапия ГК должна быть индивидуальной, то есть подразумевается выборочное лечение женщин с ВДКН, особенно с ВДКН НФ [12]. ГК-терапию ВДКН именуют супрессивной. Высказано мнение, что супрессивная терапия при любой форме ВДКН у девочек должна начинаться с детства [3, 13]. Однако большинство авторов придерживается принципа назначать детям и подросткам ГК только в случаях угрозы низкорослости или значительных проблем с кожей. В остальных случаях надо проводить выжидательную тактику [11]. Поможет ли ГК терапия, начатая с детства, сохранить или улучшить фертильность при достижении половой зрелости, это требует изучения.
Цель работы – проанализировать влияние ГК-терапии на состояние пациенток с ВДКН НФ, течение беременности и родов, развитие плода у таких женщин.
Материал и методы исследования
Под наблюдением находились 46 пациенток фертильного возраста (18–43 года) с ВДКН НФ. Больным проводили углубленное общеклиническое обследование. Методом анкетирования изучали анамнез. Учитывали данные медицинских документов (детской амбулаторной карты, амбулаторных карт поликлиники и женской консультации, выписки из стационаров). Изучали становление менструальной функции, проведенное лечение нарушений менструальной функции (НМФ), проявления и динамику гиперандрогении по анамнезу, клиническую симптоматику гиперандрогении при осмотре. Анализировали репродуктивную функцию. Иммуноферментным методом исследовали уровень гормонов гипофиза в крови (ЛГ, ФСГ, пролактина, АКТГ), эстрадиола, дигидроэпиандростерона (ДГЭА), 17α ОН-прогестерона (17 ОН-п), тестостерона общего и свободного, кортизола, выборочно – С-пептида. Также выборочно исследована суточная экскреция кортизола. Проверяли функцию щитовидной железы (ТТГ, свободный тироксин и трийодтиронин), углеводный обмен (гликемию натощак и постпрандиальную, гликированный гемоглобин), липидограмму. Больные проконсультированы генетиком и прошли молекулярно-генетическое обследование. Всем пациенткам неоднократно проведено ультразвуковое исследование (УЗИ) органов малого таза и молочных желез. Группу сравнения составили 15 практически здоровых женщин в возрасте 19–40 лет без НМФ, с сохраненной фертильностью. Контроль при вынашивании беременности пациентками осуществляли совместно с акушерами-гинекологами. При беременности женщинам в динамике проводилось УЗИ органов малого таза.
Статистическую обработку полученных данных осуществляли с помощью прикладных компьютерных программ Statistica 10.0 методом вариационного анализа. Рассчитывали среднее арифметическое значение (М), стандартное отклонение (σ) и стандартная ошибка среднего значения (m). Достоверность различий определяли по t-критерию Стьюдента. Критический уровень значимости при проверке статистических гипотез принимали равным ≤0,05.
Результаты и их обсуждение
Только у 7 (15%) пациенток ВДКН НФ диагностирована в 14–19 лет в связи с тяжелой угревой болезнью; у 14 (30,4%) – в 20–29 лет; у 23 (50%) – в 30–39 лет; у двух женщин впервые поставлен диагноз в 40 и 43 года. Пациентки, у которых ВДКН НФ выявлена после 20 лет, имели стертые внешние признаки гиперандрогении. Маскулинизация фенотипа у всех больных была незначительной, характеризовалась диспропорцией плечевого и тазового пояса: плечевой несколько шире тазового. Как правило, пациентки считали это нормой и находили объяснения («занятия плаванием, фитнесом» и др.). Однако в двух случаях сформировался узкий таз, что в дальнейшем явилось показанием для планового оперативного родоразрешения. Молочные железы у всех пациенток имели правильное строение, но в их структуре превалировала железистая ткань при гипоплазии жировой. Незначительный гирсутизм был в единичных случаях (n=3). Однако усиленный рост волос на лобке с переходом на бедра и переднюю брюшную стенку был у всех наблюдаемых женщин. Угревая болезнь начиналась в пубертатный период (n=30) и без лечения ГК протекала упорно даже у пациенток зрелого возраста. Физическое развитие (рост, вес) у всех больных было нормальное.
К эндокринологу пациентки направлены гинекологом после неэффективного лечения по поводу НМФ (n=37) и/или бесплодия первичного (n=12) или, что чаще, вторичного (n=27), или невынашивания неясного генеза. Возраст менархе у наблюдаемых женщин составил 13,5±0,8 года, то есть не отличался от подростков-девочек региона проживания. В 1/3 случаев (n=16) менструации сначала были цикличными, но в дальнейшем у 7 человек проявилось НМФ. У 30 пациенток после менархе сразу возникло НМФ в основном по типу олигоопсоменореи. Попытки нормализовать менструальный цикл комбинированными гормональными контрацептивами (КГК) оказались у всех больных безуспешными, несмотря на непрерывный прием КГК в течение 6 месяцев – 3 лет. НМФ на фоне применения КГК у этих пациенток не только не исчезали, а, наоборот, усугублялись.
Бесплодие у наблюдаемых больных было ановуляторным. Его длительно лечили КГК, кроме того, применяли аналоги прогестерона (наиболее часто дюфастон), проводили стимуляцию клостильбегитом. Сроки неэффективного лечения бесплодия составляли от 3 до 20 лет. Из 27 женщин с вторичным бесплодием до постановки диагноза ВДКН НФ и применения ГК первая беременность закончилась родами в 6 случаях, однако при этом у всех была угроза невынашивания, особенно в 1-м триместре. У наблюдаемых женщин с вторичным бесплодием было от 1 до 6 беременностей, которые заканчивалась выкидышем (чаще в 6–8 недель, в одном случае в 16 недель), или беременность оказывалась замершей. После неудачных попыток выносить беременность у наблюдаемых женщин возникало бесплодие, продолжительность которого, несмотря на лечение, достигала 3–9 лет. Некоторым пациенткам (n=6; возраст всех ≥35 лет) применяли ЭКО; одной из них 4 раза. Все попытки ЭКО оказались неудачными.
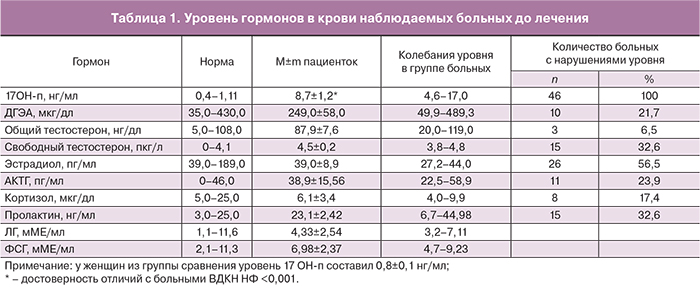
В табл. 1 представлены гормональные показатели наблюдаемых больных до начала ГК терапии. Из таблицы видно, что основной гормональной дисфункцией при ВДКН НФ является гиперсекреция надпочечникового андрогена – 17 ОН-п у 100% больных. Гормональную диагностику заболевания и его дифференциальную диагностику начинали именно с определения в крови уровня надпочечникового андрогена – 17 ОН-п в фолликулярную фазу менструального цикла (при аменорее – в любой день). Прежде чем начать лечение ГК у всех без исключения пациенток уровень 17 ОН-п перепроверяли неоднократно – не менее двух раз. У больных его повышение, хотя и было стойким, показатели могли значительно варьировать. Следует отметить, что показатели другого надпочечникового андрогена – ДГЭА – не коррелировали с уровнем 17 ОН-п и в большинстве случаев был в пределах нормы. Общий тестостерон только у 3 больных превысил норму. Эти пациентки имели сочетание ВДКН НФ и СПКЯ. По данным литературы подобное сочетание встречается в ≈10% случаев [14].
Повышение АКТГ удалось зарегистрировать менее чем у ¼ пациенток (кортикотропин – гормон нестойкий, циркулирует после секреции в кровь ≈4 минуты). Тем не менее, ясно, что необходимо подавлять его секрецию ГК [15, 16]. Изучение анамнеза показало, что у больных периодически, как правило, в стрессовых ситуациях наблюдались симптомы, свидетельствующие о гипокортицизме (резкая слабость, внезапное снижение АД, ортостатическая гипотензия и др.). Утренняя кортизолемия оказалась нормальной или субнормальной у большинства пациенток. Из 9 исследований суточной экскреции кортизола у 6 пациенток она составила нижнюю границу нормы; в 3 случаях была незначительно снижена, то есть латентный гипокортицизм из-за дефицита фермента 21-гидроксилазы у больных ВДКН НФ исключить нельзя.
Функциональная гиперпролактинемия у наблюдаемых пациенток отличалась умеренным повышением его уровня. Агонисты дофамина не требовались: пролактин спонтанно снижался до нормы у всех больных, особенно на фоне нормализации уровня 17 ОН-п. Важно отметить, что показатели гонадотропинов ЛГ и ФСГ у всех без исключения пациенток были в норме. Однако, соотношение ЛГ/ФСГ было <1 1="" 0="" 2="" 0="" p="">
Эхографическая картина органов малого таза характеризовалась гипоплазией матки у ½ больных (n=22) и эндометрия в 100% случаев М-эхо не соответствовало дню менструального цикла, было меньше должного. Не всегда удавалось определить доминантный фолликул или желтое тело: гиперандрогения вызывает преждевременную лютеинизацию и ускорение апоптоза в гранулозе фолликулов, нарушает образование желтого тела и выработку гонадотропных гормонов. Кроме того, для ВДКН НФ характерно повышение уровня прогестерона в крови и в фолликулярную, и в лютеиновую фазы менструального цикла [5]. Это вызывает гибель примордиальных фолликулов, создает эффект мини-пили, т.е. подавляет овуляцию. У большинства обследованных женщин не все менструальные циклы были овуляторными. Стойкая ановуляция приводит, как известно, к формированию мультифолликулярных яичников. У пациенток старше 30 лет (n=17) обнаружены мультифолликулярные яичники, еще у 15 женщин были признаки формирования мультифолликулярных яичников.
ГК терапия дексаметазоном или преднизолоном применена всем обследованным больным (ранее они не получали лечение ГК). Известно, что дексаметазон обладает длительным действием, угнетает АКТГ-функцию гипофиза, снижает способность надпочечников отвечать на воздействие АКТГ, замедляет метаболизм ГК, не повышает АД, не вызывает отеки. Однако, дексаметазон свободно преодолевает плацентарный барьер, не разрушается ферментами плаценты и накапливается в тканях плода. Именно поэтому целесообразно женщин, планирующих или вынашивающих беременность, переводить на преднизолон, который не проникает через плаценту. Супрессивная (и заместительная) терапия ГК сразу начиналась всем наблюдаемым больным после установления диагноза – ВДКН НФ.
В табл. 2 сформулированы принципы ГК терапии при ВДКН НФ, которые соблюдали при лечении больных. Только 7 из них начали получать ГК с подросткового возраста. Физическое, половое развитие, менструальная функция у них была без патологии, все родили здоровых детей (у двух пациенток по двое детей). Все вынашивали беременность под прикрытием преднизолона в адекватных дозах, удерживающих на нормальном уровне 17 ОН-п. В настоящее время они практически здоровы. Чем старше возраст больных к моменту выявления ВДКН НФ и началу ГК терапии, тем патология репродуктивной системы у них выражена значительнее. Так, у 3 пациенток 39–43 года произошло полное истощение фолликулярного резерва яичников, развилась аменорея, появились симптомы некомпенсированной менопаузы. Им назначены ГК (уровень 17 ОН-п до ГК терапии высокий, достигал 17,0 нг/мл). Кроме того, постоянно проводится заместительная гормонотерапия яичников. Еще у 36 наблюдаемых больных (все планировали беременность) диагноз ВДКН НФ был поставлен при обследовании по поводу бесплодия. Из них беременность при лечении ГК возникла у 33 женщин и у всех только после достижения нормальных показателей 17 ОН-п. У женщин моложе 30 лет зачатие происходило в первые 2–6 месяцев терапии ГК. Чем старше возраст пациенток к началу подавления гиперандрогении ГК, тем длительнее восстанавливалась овуляция. У 3 больных с истощением фолликулярного резерва яичников не удалось добиться зачатия даже на фоне ГК терапии. Еще в 3 случаях при сочетании с СПКЯ пока не удалось устранить НМФ.

При планировании беременности пациенток переводили с дексаметазона на преднизолон (0,5 мг дексаметазона эквивалентен 3,5 мг преднизолона) и во время вынашивания беременности применяли только преднизолон. Проводили мониторинг 17 ОН-п и корректировали дозу преднизолона, постоянно удерживая нормальные для соответствующего срока беременности показатели 17 ОН-п. Потребность в препарате в разные сроки беременности и у разных женщин колебалась значительно: от 0 до 17,5 мг преднизолона в сутки (на ночь). Такое лечение позволило избежать невынашивания. Клинический опыт показал, что традиционное гормональное лечение угрозы невынашивания прогестероном или его аналогами существенно повышает продукцию 17 ОН-п и оказывает парадоксальное действие, поскольку 17 ОН-п – это продукт метаболизма прогестерона. Кроме того, при ВДКН НФ часто уже имеется эндогенная повышенная концентрация прогестерона в крови [5]. Наблюдаемым беременным женщинам с ВДКН НФ сразу отменяли препараты прогестерона, если они уже их получали.
В качестве примера приводим следующее наблюдение:
Больная Н., 32 года, направлена на консультацию к эндокринологу из гинекологического отделения, куда была госпитализирована с угрозой невынашивания 4-й беременности в сроке 5 недель. Первая беременность была в возрасте 17 лет, закончилась медикаментозным абортом. Последующие две беременности были замершими в ранних сроках, после чего в течение 5 лет проводилось лечение по поводу ановуляторного бесплодия. При госпитализации пациентке сразу назначен утрожестан 300 мг/сутки. Тогда же впервые был проверен уровень 17 ОН-п, который на фоне лечения утрожестаном оказался 18,4 нг/мл при норме для этого срока беременности до 4,36 нг/мл. К лечению был добавлен преднизолон 5 мг/сутки. Через 10 дней такой терапии снова проверен уровень 17 ОН-п: 9,7 нг/мл. Сохранялся гипертонус матки, периодические мажущие кровянистые выделения. С 9 недель гестации стала получать только преднизолон, сначала в дозе 12,5 мг на ночь, постепенно дозу снизили до 5 мг в сутки. Угроза невынашивания была устранена. В дальнейшем дозу преднизолона корректировали, постоянно поддерживая нормальный уровень 17 ОН-п в крови. Беременность закончилась родами. Ребенок здоров.
Анализ анамнестических данных наблюдаемых женщин с вторичным бесплодием показал, что применение препаратов прогестерона не позволило сохранить беременность в 100% случаев (n=29). Прогестины – предшественники синтеза андрогенов – назначались гинекологами, но всегда создавали угрозу выкидыша, поэтому нами сразу же отменялись и не применялись. При лечении преднизолоном не было ни одного случая невынашивания (n=33). При ВДКН НФ, как известно, из-за избытка надпочечниковых андрогенов беременность нередко осложняется истмико-цервикальной недостаточностью. У наблюдаемых женщин отметили истмико-цервикальную недостаточность в двух случаях (6,1%). Были наложены швы на шейку матки: одной женщине в 23 недели, другой – в 27 недель.
Дискоординация родовых сил – характерная особенность родового акта при ВДКН НФ. Для профилактики слабости родовых сил и для предупреждения надпочечниковой недостаточности наблюдаемым пациенткам применяли общепринятую методику – при появлении схваток переводили беременных пациенток с преднизолона на гидрокортизон в дозе 50 мг внутримышечно. У всех пациенток, кроме одной, эффект хороший. Больной П-й, 29 лет, на 3-и сутки пришлось произвести оперативное родоразрешение. Инъекции гидрокортизона повторяли до родов. После родов продолжали вводить гидрокортизон еще 3–5 суток, затем возобновляли терапию преднизолоном.
Все дети (n=44) родились без отклонений в развитии, из них у двух детей (мальчика и девочки, рожденных от многоплодной беременности) выявлена мутация гена CYP 21В. Мать этих детей проходила молекулярно-генетическое обследование, которое подтвердило диагноз ВДКН НФ. Важно отметить, что отец (и отцы всех других детей) генетическое обследование по этому заболеванию не проходили. Грудное вскармливание детей на фоне лечения преднизолоном не запрещали, поскольку преднизолон не проникает или в ничтожных количествах проникает в грудное молоко.
Выводы
- Даже незначительная, но длительная или постоянная гиперсекреция надпочечниковых андрогенов у пациенток с ВДКН НФ приводит к репродуктивным нарушениям и потере фертильности, нередко неизлечимым.
- Необходимо своевременно, не позднее подросткового возраста, начинать супрессивную (и заместительную) терапию ГК пациенток с ВДКН НФ, добиваться нормализации уровня в крови 17 ОН-п и проводить его постоянный мониторинг.
- Терапия преднизолоном должна быть обязательной у беременных женщин с ВДКН НФ для предупреждения невынашивания, замершей беременности и ее других осложнений. Преднизолон при этом не вызывает нарушений у плода.
- При НМФ (в том числе у девочек-подростков), бесплодии, невынашивании или замершей беременности необходимо у женщин проводить контроль уровня 17 ОН-п. При планировании беременности женщинами с ВДКН НФ отцы будущих детей должны проходить медико-генетическое обследование для исключения у них мутации гена CYP 21В.
- Применение прогестинов у беременных с ВДКН НФ не целесообразно, а напротив, создает угрозу выкидыша, что требует их отмены.



