Инфекционно-воспалительные заболевания матери и нарушения в ее иммунной системе являются факторами риска возникновения патологических состояний и изменения реактивности иммунной системы у плода, развивающихся в условиях тесного взаимоотношения с материнским организмом. При физиологическом течении беременности происходит изменение баланса между врожденным и адаптивным иммунитетом матери, при этом факторы естественного иммунитета начинают играть большую роль в иммунологической адаптации беременной. С ранних сроков беременности происходит увеличение числа фагоцитов (гранулоцитов и моноцитов), усиление фагоцитоза, генерации активных форм кислорода (АФК). Важную роль в защите от инфекции играют полиморфноядерные фагоциты, которые используют сходные с макрофагами механизмы бактерицидного действия с увеличением связывания и поглощения микроорганизмов в присутствии опсонизирующих факторов (антител и фрагментов комплемента).
Беременность нередко осложняется воспалительными заболеваниями инфекционного или неинфекционного генеза, которые могут протекать не только на локальном, но и на системном уровне, причем на фоне неадекватного иммунного ответа. Активация нейтрофилов, являющаяся одним из ключевых моментов в развитии воспалительного процесса, приводит к продукции цитокинов, множества цитотоксических молекул и угнетению процесса апоптоза. Цитотоксический потенциал нейтрофилов, которые наиболее быстро мобилизуются при развитии воспалительного ответа, в значительной степени обеспечивается АФК [1].
Процесс уничтожения микроорганизмов фагоцитами сопровождает серия сложных метаболических событий, включающих активацию гликолитических путей, генерацию АФК и увеличение потребления кислорода — «дыхательный взрыв». Повреждение многих органов, особенно легких, сетчатки, центральной нервной системы у новорожденного может быть следствием не только влияния инфекционного агента, но и/или продолжительного воздействия АФК и протеаз. Подобные процессы могут иметь место и без непосредственного участия инфекции при выраженных воспалительных состояниях, при асфиксии или продолжительной гипоксии в процессе родов. При исследовании влияния родов на оксидативный стресс в фетальном кровообращении и возможности предотвращения его с помощью кесарева сечения получены неоднозначные результаты [2, 3, 4].
Ранняя диагностика и адекватное лечение могут снижать риск развития тяжелых заболеваний у новоpожденных. Ранний диагноз внутриутробной инфекции (ВУИ) не всегда возможен, так как симптомы инфекций часто не являются специфичными, а лабораторные тесты занимают немало времени. Поэтому постоянно ведутся поиски биомаркеров для ранней диагностики инфекции у новорожденного. В качестве приемлемых методов обнаружения инфекции предлагаются такие, как оценка активации лимфоцитов, проведенная быстро, до выделения инфекционного агента, повышенные уровни интерлейкина (ИЛ)-1β, ИЛ-6 и ИЛ-8 в крови, высокий уровень ИЛ-6 в амниотической жидкости [5, 6, 7]. Имеются только единичные работы по оценке значимости функциональных особенностей клеток врожденной иммунной системы при риске ВУИ новорожденных [8, 9, 10].
Представляется актуальным выяснение вопроса о том, в какой степени инфекционно-воспалительные заболевания матери оказывают влияние на состояние реактивности фагоцитов их новорожденных детей. Важным является выявление особенностей функциональной активности фагоцитов у матерей группы высокого инфекционного риска, родивших детей с реализацией ВУИ, для обоснования прогностических критериев состояния здоровья у ребенка на основе данных клинического обследования и оценки кислород-зависимой бактерицидной активности лейкоцитов в периферической крови матери и в пуповинной крови новорожденного.
Целью исследования явилась характеристика особенностей функционирования фагоцитов периферической крови беременных и их новорожденных при реализации ВУИ.
Материал и методы исследования
До настоящего времени среди беременных принято выделять группу высокого риска по реализации ВУИ у новорожденных, в связи с чем нами была сформирована группа исследуемых пациенток на основе общепринятых в последние годы факторов риска.
В исследование были включены 118 беременных, находившихся под наблюдением и родоразрешенных в ФГБУ НЦ АГиП им. академика В.И. Кулакова Минздравсоцразвития России в 2009–2011 гг. в возрасте от 20 до 46 лет, путем операции кесарева сечения при сроке гестации 37,7 нед (были включены 2 случая при сроке беременности 26 нед).
Критерии включения в исследование: в I группу (n=30) – наличие плацентарной недостаточности
(ПН), установленной по данным клинического обследования, результатам функциональных методов исследования (нарушение маточно- и/ или фетоплацентарного кровотоков и/или усиление кровотока в среднемозговой артерии, по данным допплерометрии, синдром задержки роста плода, по данным ультразвукового исследования), отсутствие клинических и лабораторных проявлений бактериально-вирусной инфекции во время беременности; во II группу (n=30) – наличие во время данной беременности острой и/или рецидива бактериально-вирусной инфекции, подтвержденной данными микробиологических, вирусологических и иммунологических методов обследования, при отсутствии ПН;
в III группу (n=30) – наличие ПН, а также острой и/или рецидива бактериально-вирусной инфекции во время данной беременности; в IV группу (n=28) – условно здоровые беременные. Дополнительными критериями включения служили: одноплодная беременность, родоразрешение путем операции кесарева сечения до начала родовой деятельности. Показаниями к операции кесарева сечения у пациенток с ПН явилось ухудшение состояния и нарастание тяжести хронической гипоксии плода, развившиеся в I группе на фоне преэклампсии умеренной и тяжелой степеней, а в III группе – острой
или рецидивирующей бактериально-вирусной инфекции. Пациентки II и IV групп были родоразрешены путем операции кесарева сечения по сочетанным показаниям (анатомические особенности таза, миопия высокой степени и др.). Критерии исключения: тяжелая экстрагенитальная патология, многоплодная беременность, пороки развития плода.
В зависимости от исхода беременности и состояния новорожденных все пациентки были разделены на следующие группы. 1-ю группу, (n=15) составили женщины высокого инфекционного риска, родившие новорожденных с явлениями гипотрофии; 2-ю (n=18) – женщины высокого инфекционного риска, с реализацией ВУИ у новорожденных; 3-ю (n=25) –женщины высокого инфекционного риска, чьи новорожденные имели ряд осложнений раннего неонатального периода неинфекционной природы; 4-ю (n=32) – женщины высокого инфекционного риска, родившие условно здоровых новорожденных;
5-ю группу контроля (n=28) –, условно здоровые женщины и их новорожденные дети.
Фагоцитарную активность нейтрофильных гранулоцитов определяли с помощью метода проточной цитометрии с использованием набора PHAGOTEST фирмы Biotechnology (Germany).
Генерацию АФК оценивали по люминол-зависимой хемилюминесценции. Определяли уровень спонтанной и индуцированной опсонизированным зимозаном (0,5 мг/мл) продукции АФК в образцах нефракционированной венозной крови матери и пуповинной крови новорожденного.
Для фенотипической характеристики лейкоцитарных клеток использовали метод проточной цитометрии и моноклональные антитела фирмы Beckman Coulter (USA) – CD45/CD14, CD3/CD16,
CD11b, CD95. Изучали экспрессию активационных маркеров гранулоцитами венозной крови беременных женщин перед родами и пуповинной крови новорожденных: CD16 – Fc-рецептор III типа, CD11b – рецептор комплемента (CR3), CD95(Fas/APO1) – проапоптотический маркер (Fas-рецептор).
Статистическая обработка данных, построение графиков, анализ результатов выполнен на персональном компьютере при помощи прикладных программ «MicrosoftOffice» 2007 – русская версия, StatSoft «Statistica 8» 2007/ENG. Полученные результаты приведены как среднее значение параметра и стандартное отклонение между группами по критерию Стьюдента с помощью программы «SigmaPlot».
Результаты исследования и обсуждение
Все пациентки, включенные в исследование, были сопоставимы по возрасту и соматическому здоровью. Изучение исхода родов для плода и течения раннего неонатального периода у новорожденных показало, что у матерей в группе с высоким инфекционным риском родились новорожденные как с реализацией ВУИ или неинфекционными заболеваниями, так и практически здоровые дети. Структура заболеваемости новорожденных в исследуемых группах в основном была представлена конъюгационной желтухой (6,7%, 27,8, 48,0% соответственно в 1-й, 2-й и 3-й группах), асфиксией (26,7%, 61,1 и 36,0% – в 1-й, 2-й и 3-й группах). Наиболее частым проявленим ВУИ была пневмония – у 13 (72,2%) и конъюнктивит – у 5 (27,8%) .
В связи с этим возникают вопросы о том, каковы особенности течения беременности, родов, послеродового периода, а также состояние системы врожденного иммунитета у пациенток высокого инфекционного риска, у которых родились дети с реализацией ВУИ и без таковой.
Анализ данных анамнеза, клинического и лабораторного обследования женщин показал, что матери, родившие детей с реализацией ВУИ (2-я группа), имели отягощенный гинекологический и акушерский анамнезы и течение настоящей беременности. Для них было характерным наличие в анамнезе заболеваний ЛОР-органов (50,0%), хронического пиелонефрита (27,8%), цервицита (44,4%), хронического эндометрита (33,3%), искусственных абортов (50%); во время настоящей беременности активации вируса простого герпеса (44,4%), бактериального вагиноза (11,1%), угрозы прерывания беременности (100,0%), ПН и гипоксии плода (44,4% и 38,9% соответственно), истмико-цервикальной недостаточности (22,2%); осложнений течения послеродового периода в виде эндометрита (8,0%) и
субинволюции матки (22,2 %).
Для матерей, у которых родились дети с гипотрофией без проявления инфекционных заболеваний (1-я группа), характерным было наличие в анамнезе заболеваний ЛОР-органов (60,0%), хронического эндометрита (33,3), неразвивающейся беременности (20,0%), антенатальной гибели плода (13,3%); во время настоящей беременности – раннего токсикоза (46,7%), угрозы прерывания беременности (86,7%), ПН и гипоксии плода (66,7 и 53,3%), вируса простого герпеса (20%), анемии (53,3%).
У матерей, родивших детей с неинфекционными отклонениями в состоянии здоровья (группа 3), в анамнезе отмечено бесплодие, эндометриоз (40,0 и 20,0% соответственно), наступление беременности в результате экстракорпорального оплодотворения (32%); в течение настоящей
беременности – ПН и гипоксии плода (по 32,0%), преэклампсии (12%).
В группе матерей с высоким инфекционным риском, родивших практически здоровых детей (4-я группа), в анамнезе отмечались хронический пиелонефрит (31,3%), цервицит (40,6%); при настоящей беременности – кандидозный (46,9%) и неспецифический вагинит (43,8%); в послеродовом периоде – эндометрит (3,1%) и субинволюция матки (12,5%).
Таким образом, в группе матерей, у которых родились дети с реализацией ВУИ, наблюдались наиболее отягощенные акушерский и гинекологический анамнезы, однако не было выявлено факторов, которые указывали бы на статистически значимую вероятность реализации ВУИ у новорожденного (р>0,05). Можно предположить, что применяемые критерии выделения групп высокого инфекционного риска не могут в полной мере иметь прогностический характер дальнейшей реализации ВУИ у новорожденного.
С учетом того, что одну из ведущих ролей в реализации патологии неонатального периода может играть нарушение баланса между материнскими и плодовыми факторами врожденного иммунитета, нами были предприняты попытки поиска предикторов реализации ВУИ в этом направлении.
По содержанию лейкоцитов в венозной крови беременных женщин непосредственно перед родами и в пуповинной крови их детей статистически значимых различий между группами выявлено не было. Подавляющее большинство гранулоцитов экспрессировали CD16-рецептор для Fc-фрагмента IgG (gammaRIII), который опосредует фагоцитоз и антитело-зависимую клеточно-опосредованную цитотоксичность (у матерей в основной группе доля CD16+-клеток в крови – 83,4±20,7%; в контрольной – 94,1±10,77%; в пуповинной крови у новорожденных – 73,0±18,7% и – 89,4±4,3% соответственно). Значимых отличий между группами не выявлено, отмечена только тенденция к снижению в основной группе числа клеток, способных связывать IgG, по сравнению с контрольной группой (р>0,05).
CD11b – рецептор комплемента (CR3), который является маркером активации и адгезии нейтрофилов к эндотелию, у матерей в основной группе экспрессировали 95,9±5,4% гранулоцитов; в контрольной – 97,5±4,5%; у новорожденных – 91,7±11,2 и 97,1±2,0% соответственно. Значимых различий между числом клеток с рецептором для CR3-фрагмента комплемента не наблюдалось ни между группами матерей, ни новорожденных (р>0,05). Согласно литературным данным, нейтрофилы имеют сходные уровни экспрессии CD11b в группах матерей или их новорожденных с антенатальными факторами инфекционного риска [11].
При оценке экспрессии проапоптотического Fas-рецептора – CD95(Fas/APO1), ассоциированной с терминальной миелоидной дифференцировкой, были получены следующие результаты: в венозной крови матерей в основной группе CD95-рецептор экспрессировали 81,6±19,6% гранулоцитов, в контрольной – 97,3±3,1%; в пуповинной крови новорожденных – 72,5±27,6 и 93,0±10,8% соответственно. Можно сделать вывод о том, что у матерей и их новорожденных большинство нейтрофилов в крови представлены зрелыми активированными фенотипами с высокой готовностью к апоптозу. Нейтрофилы являются окончательно дифференцированными клетками, вступающими в апоптоз вскоре после созревания [12]. В нашей работе отмечалась тенденция к снижению доли таких клеток в исследуемой группе по сравнению с контрольной (р>0,05).
Нейтрофилы – главные эффекторные клетки в борьбе с внеклеточными возбудителями инфекционных заболеваний. При оценке поглотительной функции, определяемой по доле клеток, поглотивших флуоресцентно меченные бактерии, показана более низкая фагоцитарная активность клеток у новорожденных по сравнению с клетками матерей (см. таблицу). Существенное снижение фагоцитарной активности отмечено в крови беременных с высоким инфекционным риском и их новорожденных детей.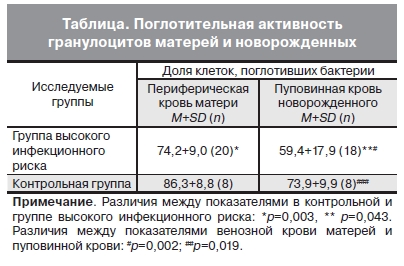
Полученные результаты частично согласуются с данными о более низкой экспрессии некоторых поверхностных маркеров и фагоцитарной активности фетальных гранулоцитов и моноцитов по
сравнению с клетками взрослых, с чем может быть связана бóльшая чувствительность новорожденных к инфекции [13].
Определение функциональной активности гранулоцитов крови по уровню спонтанной генерации АФК не выявило существенных различий между беременными с высоким инфекционным риском и их новорожденными (р=0,437), при наличии различий в контрольной группе (р<0,05) (рис. 1, А). В основной группе матерей уровень спонтанной продукции АФК был значительно ниже, чем в контрольной (р=0,002), в пуповинной крови наблюдалась тенденция к понижению (p=0,168).
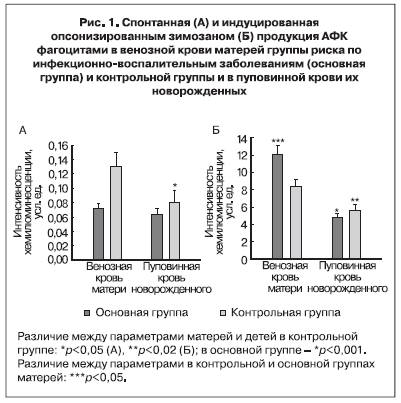
Уровни индуцированной продукции АФК, напротив, имели значимые отличия. Анализ ответа клеток на опсонизированный зимозан, который инициирует генерацию АФК как при поглощении опсонизированных частиц, так и при активации рецепторов плазматической мембраны опсонинами, показал, что интенсивность генерации АФК при фагоцитозе частиц опсонизированного зимозана у пациентов обеих групп была значительно ниже в клетках пуповинной крови по сравнению с клетками венозной крови беременных женщин. Обнаружена более интенсивная реакция на опсонизированный зимозан в нефракционированной крови беременных, имеющих высокий инфекционный риск, по сравнению с показателем у женщин контрольной группы (рис. 1, Б)
Результаты оценки уровня спонтанной и вызванной продукции АФК фагоцитами в группах матерей, сформированных в зависимости от состояния рожденных ими детей, и в пуповинной крови новорожденных представлены на рис. 2.
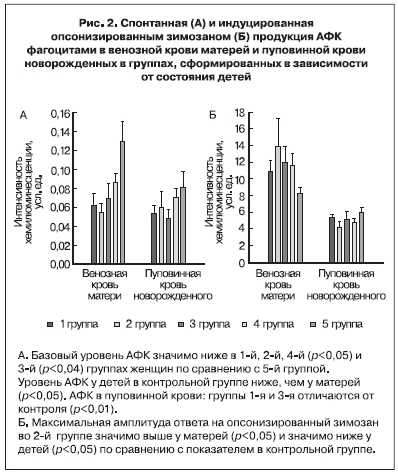
Уровень АФК у детей в контрольной группе ниже, чем у матерей (p<0,05). В 1-й группе (новорожденные с гипотрофией) в пуповинной крови уровень спонтанной продукции ниже, чем в
венозной крови матери. Во 2-й группе (ВУИ) нет различий между базовым уровнем АФК в крови матери и новорожденного. В крови матерей контрольной группы уровень АФК выше, чем в 1-й и 2-ой группах, но между собой последние не различаются. Уровень АФК в пуповинной крови в 1-й и 3-й группах ниже, чем в контрольной (р<0,01).
Проведенный анализ показал, что интенсивность генерации АФК при фагоцитозе частиц опсонизированного зимозана во всех группах была значительно ниже в клетках пуповинной
крови по сравнению с клетками венозной крови беременных женщин (рис. 2Б). В крови матерей, родивших детей с ВУИ, обнаружен наиболее высокий уровень АФК при фагоцитозе и самый низкий в пуповинной крови детей с ВУИ. Средние значения амплитуды ответа на опсонизированный зимозан у матерей и детей в этой группе различаются на 70%, тогда как в 1-й группе детей с гипотрофией – на 49,7%, в 3-й группе детей с неинфекционными осложнениями – на 59,4%, в 4-й группе – на 58,4%, в контрольной группе – на 32%. Уровни спонтанной и вызванной продукции АФК фагоцитами в 4-й группе (матери высокого инфекционного риска, родившие здоровых детей) при определенной тенден-
ции к нормализации не достигают уровней в контрольной группе.
Продукция АФК фагоцитами крови является критическим иммунным фактором защиты против микроорганизмов. Нами определен повышенный уровень генерации АФК клетками в крови матерей и пониженный – в крови новорожденных при ВУИ плода. У детей при гипотрофии без реализации инфекции также отмечено снижение продукции АФК, но количественно оно было менее выражено. В литературе имеются сведения о том, что гранулоциты новорожденных с более высокой массой тела и гестационным возрастом при индукции генерировали более высокие уровни АФК [14]. Возможно, сниженную функциональную активность гранулоцитов новорожденных с гипотрофией можно
объяснить их незрелостью.
Более низкий уровень спонтанной и индуцированной продукции АФК у новорожденных от матерей с высоким уровнем активности фагоцитов может свидетельствовать о сниженной способности новорожденных детей отвечать на инфекцию или воспаление, с которой связана их повышенная чувствительность к инфекции.
Нами получены данные, позволяющие сделать заключение о снижении функциональной активности гранулоцитов новорожденных, родившихся у матерей высокого инфекционного риска с повышенной активацией иммунной системы, особенно при реализации ВУИ в раннем неонатальном периоде. Обнаружение высокого уровня индуцированной продукции АФК у матери и низкого в пуповинной крови может служить одним из прогностических критериев, свидетельствующих о высокой вероятности реализации ВУИ.



