Эндометриоз представляет собой наличие железистого и стромального компонентов эндометрия за пределами слизистой оболочки матки. Поскольку объективная верификация заболевания возможна лишь при морфологическом изучении биопсийно-операционного материала, то имеющиеся сведения о больных эндометриозом варьируют в различных исследованиях.
Так, эндометриоз имеет бессимптомное течение и выявляется примерно у 2–4% пациенток, перенесших перевязку маточных труб [1], у 5–50% женщин, страдающих бесплодием [2], и в 5–21% наблюдений больных, госпитализированных по поводу тазовых болей [3]. По данным Buck Louis G.M. и соавт. [4], эндометриозом страдают порядка 2–11%, а по данным Giudice L.C. и соавт. [5] – 10–15% всех женщин репродуктивного возраста. При этом жительницы Юго-Восточной Азии и Японии имеют более высокую (15%) частоту распространенности эндометриоза по сравнению с женщинами США (10%) [6]. Важно, что эндометриоз диагностируется лишь через несколько лет от начала своего развития; при этом в 74% наблюдений выставляется по крайней мере один неправильный диагноз [7]. С другой стороны, большинство исследователей указывают на более частое выявление злокачественных новообразований у пациенток с эндометриозом, а также считают возможным малигнизацию самих очагов эндометриоза [8]. В этой связи актуальной задачей является выяснение патогенеза и факторов риска развития эндометриоза.
Цель работы – анализ данных литературы о факторах риска и причинах развития эндометриоза.
К сожалению, точные этиология и патогенез эндометриоза до настоящего времени не выяснены, вследствие чего существует ряд гипотез развития очагов эндометриоза, включающих многофакторные взаимосвязанные механизмы, в частности, гормональные, воспалительные, иммунологические, генетические, эпигенетические, экологические [9]. В этой связи ряд имеющихся в литературе работ посвящен выяснению факторов риска развития эндометриоза.
Анализируя факторы риска развития эндометриоза, следует отметить, что одни из них носят семейный характер, другие относятся к периоду младенчества и юности, некоторые возникают в зрелом возрасте, включая беременность и послеродовый период, часть является факторами внешней среды (табл. 1).
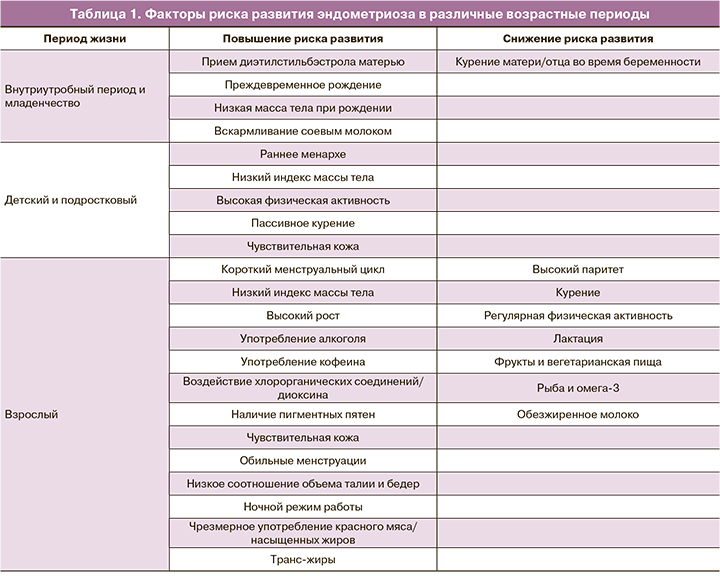
Действительно, в литературе имеются указания, что эндометриоз значимо чаще развивается у женщин, матери которых также страдали эндометриозом или миомой матки [10]. При этом распространенность эндометриоза среди сестер пациенток, страдающих эндометриозом, составляет 8,8%, а в контрольной группе – лишь 1,5% [11]. Именно поэтому ряд авторов даже говорят о наследственной природе эндометриоза (теории генетической предрасположенности) [12]. Характеристика молекулярно-генетических детерминант развития эндометриоза была представлена в обзоре Пономаренко И.В. и соавт. [13].
В результате проведенного метаанализа Rahmioglu N. и соавт. [14] выявили однонуклеотидные полиморфизмы в 6 локусах генов у женщин, родившихся в странах Европы и Японии. Согласно данным литературы [15], повышение риска развития эндометриоза зарегистрировано у женщин Восточной Азии, имеющих однонуклеотидные полиморфизмы CDKN2B-AS/rs10965253 и WNT4/rs16826658, промоторного региона TIMP-2; генов синтеза и метаболизма эстрогенов (несинонимных (nonsynonymous) SNPs rs6165, rs6166, rs2066479, rs700519); полиморфизма FGF2 754C/C; -C805 или -1031T/C гена TNFA; A264C HSD17B1 гена цитохрома P450 CYP19; аллеля a13 в интерфероне-γ (ИФН‑γ). Напротив, повреждения в области интрона 1 TIMP-2 и MMP‑2, аллеля 765c гена COX‑2, однонуклеотидные полиморфизмы рецепторов ФСГ гена FSHR, полиморфизмы FGF2 754C/G или G/G, -863С/АTNFA и 418C/C TIMP‑2 коррелируют со сниженным риском эндометриоза [16].
Вместе с тем не совсем понятна роль гена E-кадхерина, поскольку полиморфизмы 160C/-347 GA и 30-UTR C/T ассоциированы с высоким риском эндометриоза, а полиморфизмы -160C/A и ‑347 G/GA – нет [17].
В качестве подтверждения существования генетических факторов можно также привести работы по экспериментальному моделированию эндометриоза у животных. Birt J.A. и соавт. [18] в эксперименте на крысах показали, что моделирование эндометриоза вызывало нарушения экспрессии генов апоптоза эмбрионов на стадии 8 клеток. В другом исследовании у крысят, родившихся у крыс с эндометриозом, имелись различные аномалии репродуктивной системы, в частности, нарушения созревания ооцитов, аномалии структуры постовуляторных ооцитов и эмбрионов, а также спонтанные аборты [19].
Более частое развитие эндометриоза у пациенток, матери которых страдали миомой матки, обусловлено, по мнению Patel B. и соавт. [20], нарушениями рецепторов эстрогенов и прогестерона. Примечательно, что примерно у 25–30% женщин с эндометриозом выявляется также и миома матки [21].
Весьма интересными являются данные, указывающие на более высокий риск развития эндометриоза у женщин, имевших более низкие значения массы тела при рождении по сравнению с теми, кто родился с нормальной или повышенной массой тела [22]. Авторы установили, что женщины, родившиеся с малой массой тела (менее 5,5 футов), имели значительно больший риск развития эндометриоза в зрелом возрасте (относительный риск (ОР)=1,3, 95% доверительный интервал (ДИ) 1,0–1,8) по сравнению с пациентками, имевшими нормальную массу тела (7,0–8,4 футов) при рождении [22]. Возможными причинами подобной зависимости могут быть изменения внутриутробного уровня гормонов и кровоснабжения плода. По мнению Vannuccini S. и соавт. [10], это объясняется общими сигнальными путями роста плаценты/плода и развития эндометриоза.
В экспериментах на мышах было показано, что плацентарная недостаточность играет определенную роль в развитии органов и тканей малого таза плода, приводя к снижению эластичности кровеносных сосудов и последующему развитию ретроградных менструаций [23]. У младенцев, родившихся с низкой массой тела, обычно определяется более высокий уровень инсулиноподобного фактора роста (IGF-1), который также повышен в плазме и перитонеальной жидкости у женщин, страдающих эндометриозом [24].
Масса тела как фактор риска развития эндометриоза установлена не только для новорожденных, но и в детском и зрелом возрасте. Во французском случай-контроль когортном исследовании E3N 61 208 женщин оценивали свое телосложение в детском возрасте путем оценки соматотипа по Sorensen. У женщин, имевших бóльшие размеры тела по сравнению с худощавыми, отмечались меньшие значения риска развития эндометриоза (отношение шансов (ОШ)=0,86; 95% ДИ 0,77–0,95 и ОШ=0,79; 95% ДИ 0,71–0,88 соответственно) [25]. По данным корейских исследователей [26], пациентки, имевшие более низкую массу тела в детстве, значимо чаще страдали эндометриозом III–IV стадии, а не I–II стадии (р=0,002).
У худощавых 18-летних девушек с индексом массы тела (ИМТ) менее 18,5 кг/м² риск развития эндометриоза на 20–25% выше по сравнению с пациентками с нормальными значениями ИМТ (18,5–24,9 кг/м²), на 40% – по сравнению с полными и почти в 2 раза больше по сравнению с тучными. По данным Raimondo D. и соавт. [27], взрослые больные с эндометриозом мочевыделительной системы имели более низкие значения ИМТ по сравнению с пациентками без эндометриоза (19,2±2,8 кг/м² против 22,4±3,5 кг/м², р=0,02), ОШ составило 2,94 с 95% ДИ 1,24–6,97 (p=0,001). То есть в настоящее время считается доказанным факт более высокой частоты развития эндометриоза у женщин с более низкой массой тела.
Наличие такой закономерности, возможно, является и одной из причин большей распространенности эндометриоза среди азиатских женщин по сравнению с американскими пациентками, поскольку жительницы США намного чаще имеют более высокую массу тела. Можно также привести результаты исследования Shah D.K. и соавт. [28], показавших в 3 раза больший риск развития эндометриоза у женщин с соотношением объемов талии и бедер, характеризующим распределение жировой ткани в теле менее 0,60, чем у пациенток с коэффициентом 0,70–0,79 (ОР=2,78; 95% ДИ 1,38–5,60). По мнению McCann S.E. и соавт. [29], получивших аналогичные результаты, выявленные изменения указывают на генетическую природу такой взаимосвязи: один и тот же хромосомный локус 7p15.2 ответствен за развитие эндометриоза и распределение жира в организме, в частности соотношение объемов талии и бедер. В то же время взрослые женщины более высокого роста по сравнению с пациентками меньшего роста чаще страдали эндометриозом [28].
Согласно данным литературы, риск развития эндометриоза существенным образом зависит от времени наступления менархе и продолжительности менструального цикла. Еще 30 лет назад было отмечено, что раннее наступление менархе (в возрасте до 11 лет) повышает риск развития эндометриоза [30]. Использование статистических методов позволило установить, что более позднее наступление менархе достоверно ассоциировано со снижением риска развития эндометриоза (OШ=0,63; ДИ 0,50–0,81) при наступлении менархе в 15 лет, по сравнению с ОШ=0,75 (ДИ 0,60–0,93) при менархе в 14 лет [31]. На основании проведенного метаанализа 10 исследований случай-контроль Liston W.A. и соавт. [3] установили, что в наблюдениях эндометриоза стандартное отклонение составило 0,15 в год времени наступления менархе, по сравнению с контрольной группой.
Считается, что повышение риска эндометриоза при более раннем наступлении менархе обусловлено более длительным периодом циркуляции повышенного уровня половых гормонов и наличия ретроградных менструаций. По мнению Saha R. и соавт. [31], более ранняя высокая концентрация эстрадиола вследствие раннего наступления менархе способствует развитию очагов эндометриоза. Показано, что более высокие уровни эстрадиола и эстрона определялись у женщин зрелого возраста с более ранним возрастом наступления менархе. Кроме того, согласно результатам исследования Missmer S.A. и соавт. [32], эндометриоз выявлялся чаще у девушек позднего подросткового возраста (18–22 лет) с коротким (менее 26 дней) менструальным циклом по сравнению с пациентками, у которых длительность менструального цикла составляла 26–31 день. В то же время при обследовании корейских женщин Yi K.W. и соавт. [26] не нашли зависимости между тяжестью течения эндометриоза и продолжительностью менструального цикла.
Важным моментом является и то, что, по данным Vercellini P. и соавт. [33], прием оральных контрацептивов (ОК) способствует снижению риска развития эндометриоза. Однако такое снижение риска относится только к пациенткам, принимающим ОК на момент исследования. У женщин, принимавших ОК в прошлом, риск эндометриоза, наоборот, повышен [33]. Тем не менее в ряде случаев ОК используются для лечения эндометриоз-ассоциированной боли, что может расцениваться как снижение заболеваемости за счет подавления симптомов эндометриоза.
Еще одним общепринятым фактом считается наличие обратной связи между развитием эндометриоза и паритетом, в частности, рождением двух и более детей [32], и, наоборот, сильной ассоциации эндометриоза с бесплодием [34]. Saha R. и соавт. [31] установили более низкую частоту выявления эндометриоза у женщин, родивших двух и более детей, по сравнению с бездетными (ОШ=0,70; ДИ 0,59–0,83). При этом заболевание протекало более тяжело у женщин, родивших одного ребенка, по сравнению с пациентками, имеющими более одного ребенка. Повышенный риск развития эндометриоза ассоциируется и с бесплодием [34]. Так, в исследовании Prescott J. и соавт. [35] риск эндометриоза был в 2 раза выше у пациенток, страдающих бесплодием; при этом 83% пациенток с эндометриозом родили до 40-летнего возраста. Хотя при анализе данных литературы не всегда приводятся четкие доказательства, что именно эндометриоз являлся причиной бесплодия, тем не менее, нередко у женщин с диагностированным бесплодием впоследствии выявляется эндометриоз.
Помимо влияния беременности на развитие эндометриоза, важным, на наш взгляд, является также анализ осложнений беременности и родов. Vannuccini S. с соавт. [10] провели сравнительный анализ анамнестических данных о состоянии, в том числе течения беременности и родов, матерей 391 пациентки (161 с эндометриозом и 230 без эндометриоза). В результате авторы установили, что у матерей пациенток с эндометриозом значимо выше была частота развития преэклампсии (ПЭ) (p=0,0094) и преждевременных родов (ПР) (p<0,001). Аналогичные данные о положительной корреляции между ПЭ и ПР с последующим развитием эндометриоза были получены и Upson K. и соавт. [36]. Увеличение риска развития эндометриоза у женщин, родившихся у матерей с ПЭ во время беременности, видимо, связано с воздействием на плод повышенного уровня циркулирующих гормонов и факторов роста. Действительно, развитие ПЭ сопровождается повышением уровня экспрессии сосудисто-эндотелиального фактора роста и его рецепторов, плацентарного фактора роста в структурах плаценты [37, 38].
С другой стороны, грудное вскармливание понижает риск развития эндометриоза. Farland L.V. и соавт. [25] установили снижение риска эндометриоза у родильниц с более продолжительным периодом грудного вскармливания: ОР=0,92 с 95% ДИ 0,90–0,94 за каждые дополнительные 3 месяца грудного кормления и ОР=0,86 с 95% ДИ 0,81–0,90 при исключительно грудном вскармливании. В основе такого эффекта лежит более продолжительная послеродовая аменорея, когда повышенные уровни прогестерона и пролактина препятствуют процессам имплантации и прогрессирования эндометриоза. Другим благоприятным моментом грудного вскармливания является его положительный эффект на выраженность болевого синдрома при эндометриозе.
Говоря о вскармливании младенцев, следует отметить, что замена грудного и даже коровьего молока соевыми продуктами способствует повышению частоты выявления эндометриоза в зрелом периоде [39]. Подобная закономерность характерна главным образом для развивающихся стран и обусловлена наличием в соевых продуктах большого количества фитоэстрогенов [40]. В экспериментах на крысах было показано, что развитие и прогрессирование эндометриоза в зрелом возрасте отмечалось у животных, получавших в неполовозрелом периоде пищу, содержащую более 10% сои [41].
К сожалению, существенным фактором риска развития эндометриоза является и воздействие окружающей среды, в частности различных промышленных химических веществ. В первую очередь это относится к веществам, которые потенцируют либо ингибируют действие гормонов. По данным когортного исследования, пренатальное воздействие диэтилстильбэстрола, являющегося синтетическим эстрогеном, связано с большим (на 80%) риском развития эндометриоза (ОР=1,8; 95% ДИ 1,2–2,8) [22]. Выявленное повышение риска в популяции женщин исследователями Вашингтонского университета (Сиэтл, США) (ОШ=1,3; 95% ДИ 0,5–3,6) [35] Missmer S.A. и соавт. [22] обусловлено, по мнению авторов, внутриутробным воздействием диэтилстильбэстрола на изменение структуры репродуктивных органов и нарушение рецепторов эстрогена, что тем самым способствует развитию эндометриоза за счет усиления ретроградных менструаций и иммунных нарушений.
Длительное воздействие полихлорированных дифенилов и диоксина также может приводить к нарушениям уровня циркулирующих гормонов, способствуя тем самым развитию эндометриоза. При этом риск развития эндометриоза в определенной мере зависел от концентрации токсикантов: пациентки, подвергшиеся воздействию полихлорированных дифенилов в концентрации более 8 частей на миллиард, имели более высокую частоту эндометриоза по сравнению с женщинами, подвергшимися воздействию полихлорированных дифенилов в концентрации 5 частей на миллиард (ОР=1,68; 95% ДИ 0,95–2,98) [42]. Eskenazi B. и соавт. [43] более высокий риск развития эндометриоза (ОР=2,1; 95% ДИ 0,5–8,0) отметили у женщин, имеющих концентрацию 2,3,7,8-тетрахлордибензо-п-диоксина (TCDD) более 100 частей на триллион. Положительным моментом выяснения конкретных веществ, способствующих развитию эндометриоза, является возможность устранения такого воздействия окружающей среды. То есть данный фактор риска является модифицируемым, в отличие от ряда других, описанных выше и представленных в табл. 2.

Особый интерес представляет изучение влияния курения на риск развития эндометриоза. Подобные исследования, в силу эффективности устранения данного фактора, заслуживают отдельного анализа. К сожалению, данные литературы не позволяют сделать однозначные выводы. Так, при обследовании японских женщин с гистологически подтвержденным эндометриозом установлено повышение риска развития эндометриоза при курении [44]. Однако, по данным исследования в г. Бостоне, США, курение связано со сниженным риском эндометриоза, а исследователи из Швеции не нашли значимой связи между курением и эндометриозом [15].
Более того, внутриутробное воздействие сигаретного дыма связано с уменьшением риска эндометриоза на 80%, а пассивное курение в детском возрасте – с повышением риска развития [45]. При этом следует добавить, что курение приводит к снижению уровня циркулирующего эстрогена у женщин и, следовательно, действительно может явиться звеном патогенеза эндометриоза.
В литературе также имеются отдельные исследования, посвященные влиянию диеты на развитие эндометриоза. Так, Missmer S.A. и соавт. [46] установили наличие обратной связи между потреблением длинноцепочечных омега-3 жирных кислот, используемых в качестве единственной заправки для салата, и развитием эндометриоза (ОР=0,88; 95% ДИ 0,62-0,99). Аналогичная обратная ассоциация имелась и в исследовании случай-контроль [47]: эндометриоз выявлялся чаще у женщин с самым высоким квинтилем потребления транс-жиров по сравнению с пациентками с наиболее низким потреблением жиров (ОР=1,48; 95% ДИ 1,17-1,88). Наиболее вероятным механизмом участия жиров в развитии эндометриоза считается изменение уровня воспалительных цитокинов, в частности интерлейкина-6 (ИЛ-6) и фактора некроза опухоли (ФНО).
Наряду с этим, в литературе имеются противоречивые данные о влиянии продуктов питания на развитие эндометриоза, в частности, фруктов и овощей, молочных продуктов, красного мяса, фитоэстрогенов и изофлавонов сои [48].
Связь между потреблением алкоголя и кофеина также неоднозначна и может зависеть от статуса фертильности. В ряде исследований показано повышение риска развития эндометриоза у женщин с бесплодием при регулярном употреблении алкоголя или кофеина. Известно, что умеренное употребление алкоголя приводит к повышению биодоступности эстрогена, указывая на возможный механизм заболевания. Однако в исследовании женщин независимо от наличия бесплодия подобной ассоциации с алкоголем не было установлено. В результате проведенного метаанализа Chiaffarino F. и соавт. [49] также не выявили значимого влияния кофеина или потребления кофе на риск развития эндометриоза (ОР=1,26; 95% ДИ 0,95–1,66 и ОР=1,13; 95% ДИ 0,46–2,76 соответственно).
Физическая нагрузка и условия труда также могут модифицировать риски развития эндометриоза. В исследованиях случай-контроль было выявлено снижение примерно на 40–80% риска развития эндометриоза при регулярных физических нагрузках [50]. В основе такого протективного эффекта физической активности лежит снижение уровня эстрогена и повышение уровня глобулинов, связывающих половые гормоны. Однако в исследовании Vitonis A.F. и соавт. [51] снижение риска эндометриоза не имело статистически значимой разницы при сравнении женщин с максимальным и минимальным уровнями физической активности (ОР=0,89; 95% ДИ 0,77–1,03).
Важными следует считать и данные о положительной связи между работой в ночную смену и риском развития эндометриоза [52]. Примечательно, что работа в ночные смены закономерно приводит к нарушениям циркадного ритма секреции эстрогена и, соответственно, повышает риск и других эстрогензависимых заболеваний, в частности, рака молочной железы.
В литературе также имеются единичные сообщения о связи эндометриоза с пигментными особенностями кожи. Показано, что более высокий риск развития эндометриоза отмечался у женщин, имеющих родимые пятна на голенях (ОР=1,08; 95% ДИ 1,02–1,14) и семейный анамнез меланомы (ОР=1,13; 95% ДИ 1,01–1,26), а также у пациенток с голубыми или зелеными глазами [48].
Заключение
Таким образом, обобщая данные литературы о факторах риска развития эндометриоза, следует отметить, что повышение заболеваемости за последнее десятилетие в первую очередь, на наш взгляд, связано с улучшением диагностики и увеличением количества оперативных вмешательств. Ведь только морфологическое изучение операционного материала позволяет поставить точный диагноз и степень поражения эндометриозом.
Наряду с этим, повышение заболеваемости, несомненно, обусловлено и возрастанием воздействия различных факторов риска. Вышеуказанные факторы риска развития эндометриоза зависят от возраста пациентки, начиная от внутриутробного периода до взрослого, а также имеют определенные отличия в различных странах и регионах. К сожалению, ряд факторов, таких как генетические, раннее менархе, продолжительность менструального цикла, не может быть устранен. Другие же факторы, например, диета, влияние окружающей среды, паритет, продолжительность грудного вскармливания, физическая активность, могут быть модифицированы. То есть, даже не прибегая к медикаментозному лечению, а изменив образ жизни и воздействие факторов внешней среды, можно существенным образом снизить риск развития эндометриоза. Выяснение достоверных факторов риска должно лечь в основу разработки патогенетического лечения. Наличие же нескольких факторов риска может служить основанием для отнесения таких женщин в отдельную группу риска, а также проведения специального, более тщательного обследования для выявления очагов эндометриоза.



