Тромботические и тромбоэмболические осложнения с преимущественной локализацией в венозной системе занимают одно из ведущих мест в акушерской патологии [1]. Венозный тромбоэмболизм (ВТЭ) является одной из главных непосредственных причин материнской смертности даже в развитых странах [2]. При этом около 20% случаев приходится на долю тромбоэмболии легочной артерии (ТЭЛА). Развивающиеся с конца первого – начала второго триместров физиологическая гиперкоагуляция в сочетании со снижением естественного антикоагулянтного потенциала крови и фибринолитической активности создает предпосылки для развития тромбозов различной локализации. При этом послеродовый период представляет собой максимальный риск развития тромботических осложнений [3, 4].
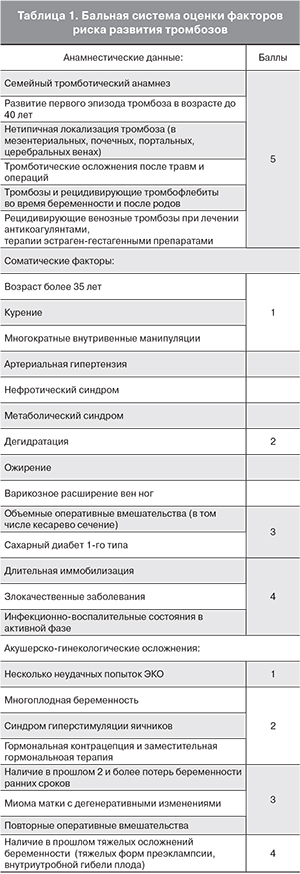
В акушерской практике выделяют факторы риска развития тромбозов, ассоциированные и неассоциированные с беременностью. По данным литературы и собственному опыту [5] следует выделять неблагоприятные анамнестические данные, соматические факторы и акушерско-гинекологические осложнения (табл. 1).
При сумме в 5 и более баллов риск развития тромботических осложнений следует расценивать как высокий.
 Мы разделяем точку зрения А.П. Момот и соавт. [6], касающуюся гипердиагностики тромбофилических состояний на основании только определения полиморфизма генов – компонентов системы гемостаза.
Мы разделяем точку зрения А.П. Момот и соавт. [6], касающуюся гипердиагностики тромбофилических состояний на основании только определения полиморфизма генов – компонентов системы гемостаза.
Авторы предлагают различать понятия «тромбофилия», «факторы тромбогенного риска», «состояние тромботической готовности». Риск тромбозов реален при сочетании врожденной и приобретенной склонности к тромбозам, а также зависит от длительности воздействия факторов риска и их управляемости. Состояние тромботической готовности, которое объединяет в себе лабораторно выявляемую гиперкоагуляцию, высокий уровень маркеров внутрисосудистого свертывания крови, а также ряд клинических признаков предтромбоза (увеличение вязкости крови, замедление кровотока по данным дуплексного ангиосканирования венозного кровотока, перманентные признаки органной дисфункции, тромбирование иглы при венопункции, нарушение фетоплацентарного кровотока, гипотрофия плода, нарушение сроков миграции или частичная отслойка плаценты и др.). Соответственно, реализация этой готовности при сохраняющихся факторах риска и их умножении (операцией, травмой, иммобилизацией, системным воспалительным процессом, онкологическим заболеванием, сахарным диабетом, сердечной недостаточностью, приемом эстрогенов, поздним сроком беременности) с высокой вероятностью способна проявиться сосудистой катастрофой.
Основными принципами противотромботической терапии в акушерстве являются ее эффективность и безопасность для организма матери и плода. Это, в свою очередь, требует знаний патогенеза различных акушерских осложнений и основ фармакотерапии препаратами противотромботического ряда, которые могут быть представлены следующими группами:
- Антитромбоцитарные препараты;
- Антикоагулянты прямого и непрямого действия;
- Тромболитичеческие препараты;
- Эндогенные антикоагулянты и рекомбинантные ингибиторы свертывания.
Наиболее широкое применение в акушерстве получили препараты антитромбоцитарного и антикоагулянтного действия. Следует отметить, что дифференциация указанных групп препаратов условна. Так, антитромбоцитарные препараты, блокируя высвобождение тромбина из тромбоцитов, препятствуют активации коагуляционного каскада и, таким образом, выступают в роли антикоагулянтов. А препараты антикоагулянтного действия, ингибируя генерацию тромбоцитов, препятствуют активации тромбоцитов и играют роль антитромбоцитарных препаратов.
Гепарин был открыт в 1916 г. Дж. Маклином, студентом Балтиморского университета, после чего вскоре был внедрен в клиническую практику и наиболее активно использовался во время Второй мировой войны для профилактики тромботических осложнений. Однако, несмотря на интенсивные международные исследования, многие механизмы биологических эффектов гепарина неясны. Гепарин является анионным полиэлектролитом с широким диапазоном колебаний молекулярной массы от 4000 до 40 000, в среднем 15 000 D. Благодаря наличию трех кислотных групп гепарин кроме антикоагулянтных свойств обладает антилипидными и антигемолитическими свойствами, ингибирует фермент АТФ-азу [7].
В зависимости от молекулярной массы препараты гепаринового ряда осуществляют противотромботическое действие различными путями. Для ингибирования тромбина молекулярная масса гепарина должна быть не менее 5400 D, при меньшей массе антитромбиновые свойства резко снижаются, поскольку лишь 30% гепарина связывается с антитромбином III (АТIII), а 70% – с ингибитором внешнего пути свертывания (TFPI). Различия в молекулярной массе обусловливают различные биологические эффекты нефракционированного гепарина (НФГ) и низкомолекулярного гепарина (НМГ). Вследствие гетерогенности структуры НФГ имеет низкую биодоступность (30%), так как связывается с белками крови, макрофагами, клетками эндотелия. Существенным недостатком является возможность образования комплексов гепарин – антигепариновый фактор тромбоцитов (фактор-4) с последующим развитием гепарининдуцированной тромбоцитопении (ГИТ) и тромбоза.
Гепарин катализирует связывание естественным антикоагулянтом – антитромбином III (АТIII) – нескольких ферментов, участвующих в процессах свертывания крови. Соединяясь с молекулой АТIII, молекула гепарина вызывает конформационные изменения последней, в результате чего как минимум в 1000 раз увеличивается способность активного центра АТIII взаимодействовать с рядом активированных факторов свертывания крови. Образуя комплекс с АТIII, эти ферменты перестают участвовать в процессе свертывания крови, что в конечном итоге приводит к уменьшению числа молекул тромбина. Необходимо отметить, что НФГ содержит полимеры с различной длиной цепи. Небольшие по размеру молекулы гепаринов усиливают антикоагулянтное действие за счет подавления активности фактора Ха, однако они не способны усиливать эффект антитромбина, направленный на угнетение фактора свертывания крови IIа. В то же время гепарины с большей длиной цепи повышают активность антитромбина в отношении фактора IIа [3].
В отличие от НФГ низкомолекулярный гепарин имеет короткие полисахаридные цепи (менее 18 моносахаридов), что значительно увеличивает биодоступность препарата при подкожном введении и обеспечивает более медленный клиренс, который осуществляется преимущественно почками. Кроме этого, НМГ по сравнению с НФГ теряет часть антитромбиновой активности, проявляя свое действие в комплексе с TFPI, а также приобретая способность селективно подавлять Ха-фактор, благодаря чему риск геморрагических осложнений значительно снижается. Кроме стандартного антикоагулянтного действия НМГ оказывают ряд позитивных плейотропных эффектов на тканевой активатор плазминогена и его ингибитор, фактор фон Виллебранда, систему активированного протеина С, эндотелиальные факторы роста, а также обеспечивают противовоспалительное, антипролиферативное и иммунологическое действие [3].
 Для НФГ более характерными являются развитие геморрагических осложнений, ГИТ, остеопороза, алопеции, местных и общих геморрагических реакций [4].
Для НФГ более характерными являются развитие геморрагических осложнений, ГИТ, остеопороза, алопеции, местных и общих геморрагических реакций [4].
Длительное время проводились исследования по возможности использования НМГ в акушерской практике, так как полагали, что снижение молекулярного веса будет способствовать проникновению НМГ через плаценту. В результате международного мультицентрового исследования [8] было показано, что НМГ безопасен при использовании у беременных как для матери, так и для плода.
Противопоказаниями к назначению НФГ и НМГ являются [3]: дородовые или массивные послеродовые кровотечения; повышенный риск кровотечения (например, предлежание плаценты); геморрагические состояния и заболевания (болезнь фон Виллебранда, гемофилии или приобретенные коагулопатии); острый инсульт в течение последних 4 недель (ишемический или геморрагический); тяжелые заболевания почек (скорость клубочковой фильтрации менее 30 мл/мин); тяжелые заболевания печени; язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения; неконтролируемая артериальная гипертензия (систолическое артериальное давление выше 180 мм рт. ст., диастолическое – выше 120 мм рт. ст.); тромбоцитопения (количество тромбоцитов менее 75×109); снижение активности АТIII менее 50%; гепарининдуцированная тромбоцитопения и тромбоз (ГИТ II тип).
С появлением НМГ показания для применения НФГ в основном ограничены лечением остро развивающегося тромбоза, а также при наличии искусственных клапанов сердца и протезированных сосудов [9]. Критерии эффективности и безопасности внутривенного введения НФГ – увеличение АЧТВ в 1,5–2 раза. Дополнительные критерии безопасности – отсутствие падения количества тромбоцитов в 2 и более раз по сравнению с исходным уровнем.
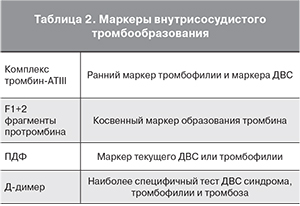
Эффективность использования НМГ и НФГ в конечном счете определяется уровнем маркеров потенциального или реального внутрисосудистого тромбообразования (табл. 2).
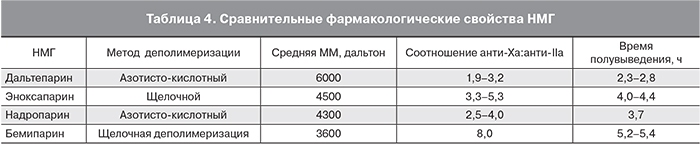
В настоящее время разрешены и наиболее применимы в акушерской практике НМГ первого поколения надропарин кальция, дальтепарин, эноксипарин и НМГ второго поколения – бемипарин натрия. В соответствии с конкретной клинико-гемостазиологической ситуацией используются профилактические или лечебные дозы НФГ и НМГ (табл. 3).
 При подборе конкретного НМГ существенной особенностью является соотношение анти-Xa/IIa-факторной активности.
При подборе конкретного НМГ существенной особенностью является соотношение анти-Xa/IIa-факторной активности.
Бемипарин натрия представляет собой НМГ нового поколения, получаемый путем щелочной деполимеризации НФГ, экстрагируемого из слизистой оболочки кишечника свиней. Благодаря самой низкой среди НМГ средней молекулярной массе 3600 Да, однородности молекулярных цепей, 85% которых весят менее 6000 Да, и самому продолжительному периоду полувыведения (5,3 ч) бемипарин относят к НМГ II поколения [10].
Антикоагулянтные свойства бемипарина, как и любого представителя НМГ, основываются на наличии специфической последовательности пентасахаридов, имеющей высокую афинность к АТIII и потенцирующей его анти-Ха-факторную активность. Поскольку для ингибирования тромбина (анти-IIa-факторная активность) требуется минимальная длина цепи полисахаридов, которая превышает длину цепей бемипарина, этот препарат демонстрирует самое высокое соотношение анти-Xa/IIa-факторных активностей, которое составляет 8:1. Свойства различных НМГ представлены в табл. 4.
Специфическая анти-Xa-факторная активность бемипарина составляет 80–120 МЕ/мг, анти-IIa-факторная активность – 5–20 МЕ/мг. Кроме того, бемипарин увеличивает плазменный уровень свободного и общего ингибитора пути тканевого фактора (TFPI). При сравнительном анализе in vitro запуска образования тромбина, вызванного низкой концентрацией тканевого фактора в присутствии тромбоцитов, было установлено, что в эквивалентных анти-IIa-факторных концентрациях бемипарин, эноксапарин, надропарин и далтепарин демонстрировали сходное ингибирующее действие во всех фазах образования тромбина. В то же время бемипарин оказался наименее мощным по влиянию на образование тромбина (анти-IIa-факторной активности) при самом высоком соотношении анти-Xa/IIa-факторной активности.
Известно, что некоторые НМГ (дальтепарин и эноксапарин) в стандартных дозировках не обеспечивают снижения активности Ха-фактора. Объяснением этому служит увеличение объема распределения препарата, а также возрастание почечного клиренса на ранних стадиях беременности и ближайшем послеродовом периоде [4, 11].
Применение бемипарина было начато в Испании в 1998 г. В настоящее время препарат применяется более чем в 50 странах. Препарат получили около 13 млн пациентов.
В России в настоящее время бемипарин (цибор, Берлин-Хеми/Менарини Фарма ГмбХ) зарегистрирован только в профилактических дозах. Цибор 2500 МЕ назначается при умеренной степени риска венозной тромбоэмболии, а цибор 3500 МЕ – при высокой степени риска. J.F. Boj [4] сообщает об успешном использовании бемипарина у 50 беременных при минимальных побочных эффектах, Т.А. Федорова [12] приводит убедительные данные о преимуществах использования бемипарина при АФС по сравнению с аспирином во время беременности. По данным M. Cruz и соавт. [13] у 646 женщин из группы высокого риска по развитию тромботических осложнений после операции кесарева сечения при использовании бемипарина в дозе 3500 МЕ в сутки был зафиксирован только один эпизод венозной тромбоэмболии. При терапии в течение 5 дней (на 2 дня меньше, чем в руководствах по клинической практике, предложенных Scottish Intercollegiate Guidelines Network [14]) препарат обладал достаточным эффектом для профилактики тромбоэмболических осложнений, хотя для нормализации уровня факторов свертывания крови может потребоваться несколько большее количество дней.
И.В Лыдина [15] приводит данные о значительном (в 6,4 раза) увеличении числа случаев наступления беременности при применении бемипарина в протоколе ЭКО.
Использование антикоагулянтной терапии во время беременности является трудной задачей из-за возможных осложнений как для матери, так и для плода [16]. В 2012 г. American College of Chest Physicians (ACCP) с позиций доказательной медицины выпустил новые научные рекомендации по антитромботической терапии и профилактике тромбозов [17].
ACCP-рекомендации в зависимости от степени риска развития тромбозов:
Для всех беременных с эпизодом ВТЭ рекомендовано использование НМГ в течение 6 недель после родов в профилактических или лечебных дозах или применение антагонистов витамина К при значениях МНО от 2,0 до 3,0 (2B).
При низком риске повторных ВТЭ предлагается тщательное наблюдение во время беременности (2С).
Для беременных группы среднего и высокого риска рецидива ВТЭ предлагается дородовое применение профилактических или терапевтических доз НМГ (2С).
При наличии гомозиготного полиморфизма генов факторов II и V у беременных без эпизода ВТЭ в анамнезе при наличии семейного тромботического анамнеза предлагается дородовое применение профилактических и лечебных доз НМГ, а затем в течении 6 недель пуэрперия или применение антагонистов витамина К при значениях МНО от 2,0 до 3,0 (2B).
Для беременных с другими формами тромбофилий при отсутствии эпизода ВТЭ в анамнезе, но при наличии семейного тромботического анамнеза предлагается тщательное дородовое наблюдение и послеродовое применение профилактических или терапевтических доз НМГ. При отсутствии дефицита протеинов С и S применение антагонистов витамина К при значениях МНО от 2,0 до 3,0 (2С).
При наличии гомозиготного полиморфизма генов факторов II и V, без эпизодов ВТЭ в анамнезе и без семейного тромботического анамнеза предлагается тщательное дородовое наблюдение с последующим назначением профилактических или терапевтических доз НМГ в течении 6 недель после родов или применение антагонистов витамина К при значениях МНО от 2,0 до 3,0 (2B).
ACCP-рекомендации для лечения острых ВТЭ во время беременности:
У беременных с острыми ВТЭ-состояниями рекомендуется подбор доз НМГ (1А), по сравнению с применением НФГ (1В).
У беременных с острыми ВТЭ предлагается применение антикоагулянтов в течение по крайней мере 6 недель после родов при минимальной общей продолжительности терапии не менее 3 месяцев (2С).
У беременных, получающих адекватные дозы НМГ или НФГ, рекомендуется отмена гепарина по крайней мере за 24 ч до индукции родов или кесарева сечения (или планируемой нейроаксиальной анестезии) (1В).
ACCP рекомендации для беременных с АФС и антифосфолипидными антителами:
При наличии лабораторных и клинических критериев АФС рекомендуется дородовое применение профилактических или терапевтических доз НФГ или профилактических НМГ в сочетании с низкими дозами аспирина, от 75 до 100 мг/сут. (1В).
ACCP-рекомендации после операции кесарева сечения:
У женщин без дополнительных факторов риска тромбозов рекомендуется ранняя активизация, а не тромбопрофилактика (1В).
При средней степени риска развития ВТЭ при наличии одного фактора из группы высокого риска или по крайней мере двух из группы низкого риска развития ВТЭ предлагается применение профилактических доз НМГ, а для пациентов с противопоказаниями к антикоагулянтам – применение средств механической профилактики (эластичные чулки или перемежающаяся пневмокомпрессия (2B).
Для женщин с высоким риском ВТЭ или при сочетании множества факторов низкого риска в послеродовом периоде предлагается использовать профилактические дозы НМГ в сочетании с механической профилактикой (2С).
В случаях крайне высокого риска ВТЭ предлагается длительная тромбопрофилактика в течение 6 недель после родов (2С).
ACCP-рекомендации при использовании вспомогательных репродуктивных технологий (ВРТ):
Пациенткам с выраженным синдромом гиперстимуляции яичников при применении ВРТ предлагается тромбопрофилактика НМГ в течение 3 месяцев. (2С).
ACCP-рекомендации при наличии искусственных клапанов сердца:
Для беременных с механическими клапанами сердца рекомендуется применение одной из следующих схем терапии:
Доза НМГ в течение всей беременности, подобранная таким образом, чтобы пик анти-Ха активности был достигнут через 4 ч после инъекции (1А).
В течение всей беременности НФГ рекомендуется вводить каждые 12 ч, а дозу следует подобрать таким образом, чтобы среднее АЧТВ возросло вдвое, а уровень анти-Ха-гепарина составлял от 0,35 до 0,70 ЕД/мл (1А).
До 13-й недели использовать НФГ или НМГ с переходом на антагонисты витамина K с отменой не менее чем за 5 дней до родов и последующим возобновлением НМГ или НФГ после родов (1А).
В группе с крайне высоким риском тромбоэмболии (протезы митрального клапана старых поколений, эпизод тромбоэмболии) предлагается применение антагонистов витамина К с отменой не менее чем за 5 дней до родов и последующим возобновлением НМГ или НФГ после родов (2С).
Заключение
Последние научные руководства рекомендуют преимущественное использование НМГ для профилактики и лечения ВТЭ по сравнению с НФГ и антагонистами витамина К. В инструкциях по применению гепаринов различного поколения до сих пор отсутствуют четко сформулированные показания и противопоказания для акушерской практики. В то же время развивающаяся во время беременности и сохраняющаяся в послеродовом периоде физиологическая гиперкоагуляция, зачастую сочетающаяся с дополнительными акушерскими и неакушерскими факторами риска развития тромбозов, диктует во многих случаях необходимость проведения профилактики и терапии потенциальных или реализующихся тромботических осложнений.



