В последние десятилетия появилась отчетливая тенденция к повышению частоты выявления гиперпластических процессов гормональнозависимых структур органов репродуктивной системы [1]. Миома матки и эндометриоз делят 2–3-е место в структуре гинекологической заболеваемости, а гиперпластические процессы эндометрия являются ведущей причиной хирургических вмешательств у женщин. Кроме этого, отмечена тенденция к снижению среднего возраста выявления клинически значимых случаев миомы матки, что негативно сказывается не только на качестве жизни женщин, но и на их репродуктивном потенциале.
На протяжении многих лет матка рассматривалась в качестве органа, необходимого исключительно для вынашивания плода. По завершении последней беременности она считалась «бесполезным, кровоточащим органом», причиной неприятных симптомов и источником повышенного риска развития злокачественных новообразований. В силу живучести подобных убеждений в медицинском сообществе гистерэктомия до сих пор выполняется неоправданно часто. Так, гистерэктомия является вторым по распространенности полостным хирургическим вмешательством у женщин (после кесарева сечения). Это одна из наиболее распространенных полостных операций в гинекологии. Средний возраст женщин, подвергшихся данному вмешательству, составляет около 40 лет (40,5±3,2 года), а к 45 годам каждая 4-я женщина уже прошла через эту калечащую операцию. Вместе с тем, помимо утраты репродуктивной функции, она может повлечь за собой целый ряд серьезных проблем: дисфункция тазового дна, недержание мочи при напряжении [2], ухудшение состояния кожи, нарушение липидного обмена, инсулинорезистентность [3], повышение риска сердечно-сосудистых заболеваний [4–6], риск развития новообразований [7–9], климактерические расстройства; депрессивные состояния [10] и др.
Риск развития онкопатологии не ограничивается репродуктивной сферой. У пациенток после проведенной гистерэктомии также чаще выявляются злокачественные новообразования щитовидной железы, почек и мочевого пузыря. Не в каждом из перечисленных примеров канцерогенез изучен достаточно подробно. Однако опухолевый процесс в почках связывают с изменением метаболизма гемопоэтина, катехоламинов, железа, гормональными и динамическими нарушениями в мочевыводящих путях [7–9].
В целом у женщин после гистерэктомии с сохраненными яичниками менопауза наступает раньше, чем в общей популяции. Оперативная менопауза, в свою очередь, увеличивает риск сердечно-сосудистой патологии в 7 раз. Ускоряется развитие остеопороза: после оперативной менопаузы кости растрачивают около 3% своей массы в год в течение пяти первых лет, а далее – 1–2% в год. Кроме этого, отмечаются проблемы в интимной жизни, более выраженное снижение сексуального желания, нежели при физиологической менопаузе [11]. Страдают и когнитивные функции: согласно исследованию, проведенному Американской академией неврологии в 2013 г., нарушения мыслительной способности и долговременной памяти тем более выражены, чем моложе была женщина на момент проведения операции. Также установлена значимая связь между хирургической менопаузой и болезнью Альцгеймера [12].
Если учесть весь спектр возможных проблем, возникают большие сомнения в том, что гистерэктомия при целом ряде патологий является оптимальным выбором. В России 90% гистерэктомий в репродуктивном возрасте проводится по поводу доброкачественных заболеваний [13]. В качестве самых распространенных причин подобного вмешательства сейчас выступают миома матки, аденомиоз [14], гиперплазия эндометрия [15], а также их сочетания. Все эти состояния являются эстрогенозависимыми.
Частое сочетание изменений миометрия и эндометрия не случайно. Об этом свидетельствуют схожий преморбидный фон, идентичные клинические проявления, а также некоторые клинико-патогенетические особенности миомы, аденомиоза и гиперплазии эндометрия. Важную роль играет как абсолютная, так и относительная гиперэстрогенемия [1]. При эстрогенозависимых пролиферативных заболеваниях матки большое значение может иметь не столько общая гиперэстрогенемия, сколько соотношение метаболитов эстрадиола, состояние рецепторов. Вместе с тем гиперпластические изменения эндометрия в сочетании с миомой матки, а также с пролиферативными заболеваниями молочных желез могут быть спровоцированы и избыточной экстрагонадной секрецией эстрогенов. Так, ароматаза [16], накапливающаяся в миоматозных узлах и эндометриоидных эксплантах, способствует трансформации андростендиона в эстрадиол, который не способен переходить в непролиферативные фракции (эстрон, эстрон-сульфат) из-за дефекта фермента 17-дегидрогеназы.
Продолжительная гиперпродукция эстрадиола стимулирует пролиферативные процессы в тканях-мишенях, активирует рецепторы к факторам роста. При оценке пролиферативной активности по количеству интерфазных ядер слизистой у больных с гиперплазией эндометрия в сочетании с миомой матки выявлено достоверное повышение пролиферативной активности клеток эндометрия по сравнению с больными без миомы матки. Дефект 17-дегидрогеназы в миоматозных и эндометриоидных очагах, стимулирующий ароматизацию андростендиона, способствует и усугублению дисбаланса метаболитов эстрогенов – 2-гидроксиэстрона (2-ОНЕ1) и 16α-гидроксиэстрона (16α-ОНЕ1) [17]. В норме соотношение 2-ОНЕ1/16α-ОНЕ1 должно составлять 2 и более. Повышение уровня 16α-ОНЕ1 способствует усилению патологических пролиферативных процессов в гормонозависимых органах и тканях.
Метаболизм эстрогенов представляет собой тонкий, сложный и весьма уязвимый процесс. Так, если он пойдет по пути преимущественного формирования 16-ОН- и 4-ОН-метаболитов, возникает риск гипер- и неоплазий основных тканей-мишеней. Даже в результате формирования на 1-м этапе метаболизма эстрогенов менее активных фракций – 2-ОН, на 2-м этапе при нарушении процесса метилирования могут сформироваться семиквиноны с их генотоксическим действием на эндометрий, миометрий и ткани молочной железы.
В связи с вышеизложенным поиск путей коррекции нарушений метаболизма эстрогенов в качестве альтернативы хирургическому лечению в настоящее время представляется весьма актуальным.
Существующие современные схемы консервативного лечения гормонозависимых заболеваний и профилактики рецидивов после органосохраняющих хирургических вмешательств [18] подразумевают почти исключительно гормональную терапию. Однако применение гормональных препаратов не всегда позволяет решить поставленную задачу в силу различных причин (низкий уровень комплаентности пациенток, отказ от гормонотерапии из-за плохой переносимости, индивидуальные особенности, отрицательно влияющие на эффективность гормонотерапии, и др.) [19, 20]. Нередко пациентки открыто заявляют о своем принципиальном отказе от гормональных методов терапии. В то же время выжидательная тактика не соответствует современным взглядам на курацию пациенток с миомой матки, эндометриозом и гиперплазией эндометрия. В этой связи большие перспективы имеет другое направление поиска, а именно – разработка терапевтической стратегии, включающей нутрицевтическую коррекцию питания.
Уникальный по своим свойствам активный природный фитонутриент – индол-3-карбинол (I3C) получают из глюкозинолатов, присутствующих в растениях семейства крестоцветных, в том числе в разнообразных видах капусты (брокколи, брюссельская, белокочанная, цветная), а также в редьке, редисе, репе и др. [21–23].
Индол-3-карбинол известен своим выраженным противовоспалительным, противоопухолевым и иммуногенным действием.
Экспериментально и клинически доказано ингибирующее влияние индол-3-карбинола на молекулярные механизмы, способствующие патологической пролиферации (как гормонозависимой, так и гормононезависимой – через цитокиновый механизм и контроль активности факторов клеточного роста). I3C препятствует сниженному апоптозу, опухолевому неоангиогенезу, провоспалительной и инвазивной активности трансформированных клеток. Идентифицировано большое число биологически активных молекулярных мишеней, ингибируемых I3C и опосредующих патогенетические звенья злокачественного роста.
В частности, I3C препятствует образованию 16α-ОНЕ1, обладающего пролиферативным и даже канцерогенным действием на ткани-мишени. Попадая в желудок, при достаточном количестве соляной кислоты I3C быстро проходит реакцию, приводящую к формированию трех наиболее важных соединений: гексагидроциклонон-трииндола (HNTI), индол[3,2-b]карбазола (ICZ), 3,3’-дииндолметана (DIM). При этом ICZ ингибирует пролиферативную эстрогенную активность и поддерживает процессы фазы I детоксикации эстрогенов в тканях, а DIM проявляет антиканцерогенные свойства на различных клеточных и животных моделях [24]. Такой широкий спектр молекулярных эффектов обеспечивает патогенетический эффект I3C.
I3C уже довольно давно и широко применяется в комплексной терапии пролиферативных заболеваний молочных желез. Многочисленные исследования подтверждают высокую эффективность включения I3C в схемы консервативного лечения различных форм мастопатии [25].
Главной задачей описываемого исследования было изучение современной эпидемиологии эстрогенозависимых заболеваний матки и оценка эффективности комплексных схем терапии с применением фитонутриента «Гарде 150» с целью лечения и профилактики рецидивов гормонозависимых заболеваний матки – миомы матки, гиперплазии эндометрия, аденомиоза. «Гарде 150» имеет дозировку, отличную от других средств, содержащих I3С, – 150 мг (далее I3C 150).
Материалы и методы
«Эпидемиологическая наблюдательная программа по частоте встречаемости гормонозависимых заболеваний в практике акушера-гинеколога женской консультации и оценке эффективности терапии пациенток с гормонозависимыми заболеваниями матки в комплексной терапии с индол-3-карбинолом» (ЭНИГМа) проходила в 34 российских городах (Белгород, Бронницы, Владивосток, Владикавказ, Владимир, Волгоград, Воронеж, Екатеринбург, Ижевск, Казань, Краснодар, Курск, Липецк, Махачкала, Москва, Нижний Новгород, Омск, Орел, Пермь, Пушкино, Пятигорск, Ростов-на-Дону, Самара, Санкт-Петербург, Саратов, Серпухов, Севастополь, Симферополь, Ставрополь, Тула, Тюмень, Уфа, Хабаровск, Челябинск). Данное проспективное когортное исследование проводилось в период с 1 июля 2020 г. по 15 февраля 2021 г. В нем приняли участие 128 врачей, к исследованию были допущены 1217 пациенток, средний возраст которых составил 40,0±8,7 года, средний индекс массы тела (ИМТ) – 25,3±4,4 кг/м2.
Пациентки были разделены на 4 группы. В группе 1 (n=497), в которую вошли женщины с миомой матки, не требующей оперативного вмешательства, были выделены две подгруппы: получающие лечение аналогами гонадотропин-рилизинг-гормона (аГнРГ) (243 пациентки) и получающие аГнРГ в сочетании с I3C 150 (254 пациентки). В группу 2 (n=444) вошли пациентки с аденомиозом, они составили две подгруппы: проходящие монотерапию препаратом диеногест и получающие комбинацию диеногеста с I3C 150 (198 и 246 пациенток соответственно). Группа 3 (n=200) состояла из пациенток с гиперплазией эндометрия без атипии. Одна подгруппа (n=89) получала базовую терапию (аГнРГ/гестаген), а другая (n=111) – комплексную (аГнРГ/гестаген, I3C 150). Гестаген был представлен препаратом диеногест – по 2 мг в сутки в непрерывном режиме. Группа 4 (n=76) состояла из пациенток, перенесших органосохраняющую операцию (миомэктомию) и нуждающихся в противорецидивном лечении. Они были разбиты на 3 подгруппы: получающие базовую терапию (аГнРГ), получающие комплексное лечение (аГнРГ/I3C 150) и находящиеся на монотерапии I3C 150 (25, 27 и 24 пациентки соответственно). В группе аГнРГ использовался «Бусерелин Депо» 3,75 мг 1 раз в 28 дней. В качестве источника I3C применялись капсулы «Гарде 150» – по 1 капсуле 150 мг 2 раза в день в непрерывном режиме.
Были изучены эффективность и переносимость лечения в каждой из подгрупп с целью сравнения избранных терапевтических схем. Характеристика групп представлена в таблице 1.
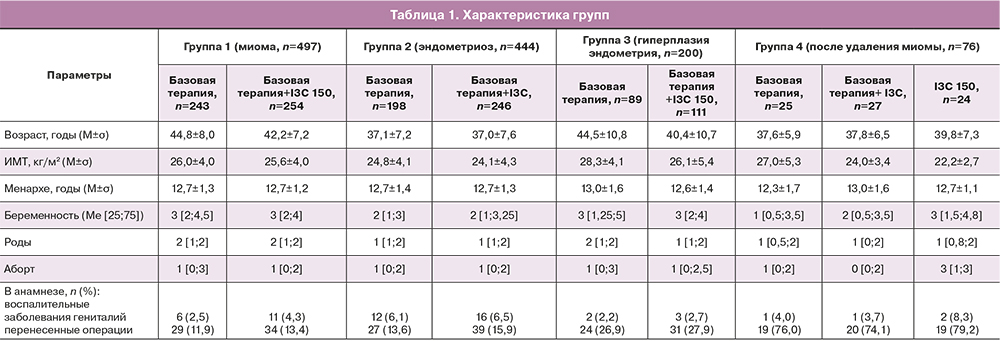
Во всех группах пациентки проходили три точки контроля: Т0 – постановка диагноза и начало лечения, Т90 – 3-й месяц лечения, Т180 – 6-й месяц лечения. С целью контроля динамики изменения размеров матки, доминирующего миоматозного узла и изучения особенностей кровообращения в матке проводилась допплерография с помощью сонографа с использованием трансвагинального датчика 5–9 МГц в раннюю пролиферативную фазу менструального цикла (7–9-й день менструального цикла). На основе полученных данных рассчитывали объем матки и диаметр доминирующего миоматозного узла (узлов). Количественные данные в работе представлялись в виде M±σ и Me [25;75].
Цель исследования: оценить эффективность комплексных схем терапии и противорецидивного лечения больных с миомой матки.
Результаты
Анализ данных исследования показал, что общая переносимость лечения оказалась сходной во всех группах (табл. 2).
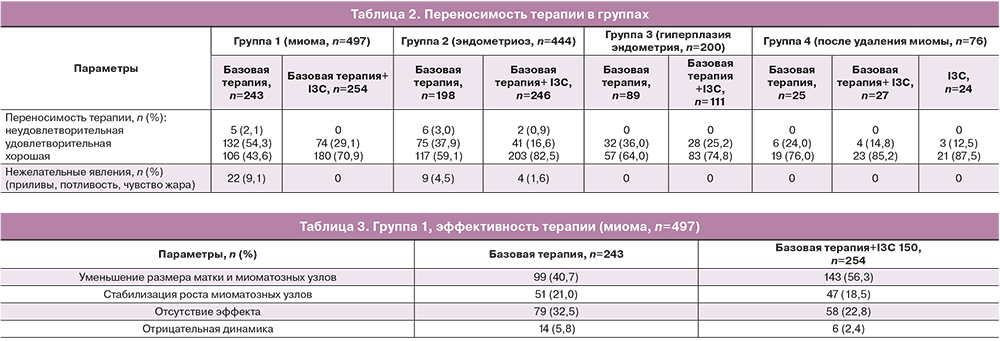
Оценка эффективности показала следующее.
1) Зафиксировано преимущество сочетания аГнРГ и I3C 150 перед монотерапией аГнРГ в лечении миомы матки (табл. 3).
2) Частота выявления положительной динамики в течении эндометриоза при использовании комплексной терапии (диеногест, I3C 150) была выше по сравнению с базовой (табл. 4).
3) Эффективность противорецидивной терапии гиперплазии эндометрия с использованием комплексной схемы (аГнРГ/гестаген, I3C 150) была выше, чем при базовой схеме (табл. 5).
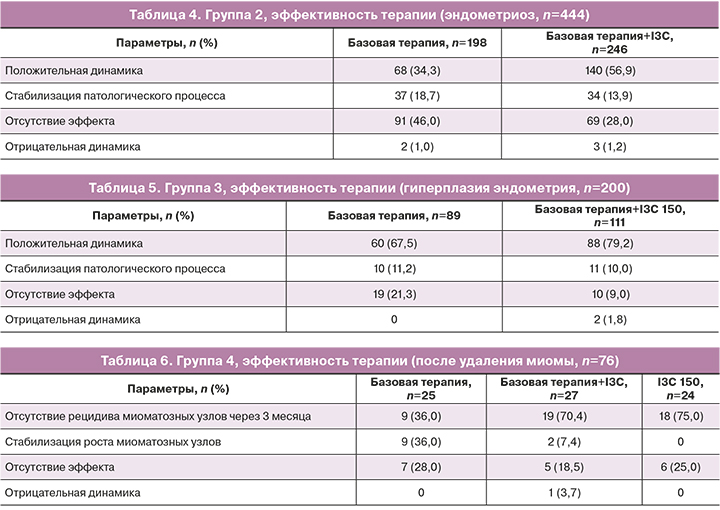
4) Эффективность противорецидивной терапии (оценивалась по стабилизации роста и отсутствию рецидивов миоматозных узлов через 3 месяца) у пациенток после органосохраняющих операций оказалась одинаково успешной как при использовании аГнРГ, так и при применении I3C 150 (табл. 6). Контроль через 3 месяца является промежуточным, но в то же время во многом определяющим этапом.
Обсуждение
Суть органосохраняющей хирургии миомы матки заключается в удалении патологических очагов при сохранении органа в тех случаях, когда это возможно [26]. Это необходимо в первую очередь для решения репродуктивной задачи [27]. Рецидивы миоматозных узлов после успешно проведенной операции являются весьма распространенным явлением. Именно в этой связи крайне важным направлением представляется эффективное и безопасное послеоперационное противорецидивное лечение.
Половые гормоны (эстрогены и прогестерон) по отношению к миоме матки не выступают в качестве антагонистов. В то же время эстрогены представляют собой «подготавливающие» гормоны, они ответственны за индукцию рецепторов прогестерона и факторов роста. «Активные зачатки роста» миомы матки развиваются на фоне физиологического колебания уровней гормонов в течение менструального цикла. Именно эстрогены обеспечивают формирование в миометрии рецепторов к Р4, Е2, факторам роста. I3C – вещество, способное прикрепляться к рецепторам эстрогенов [24] в возможных «активных зачатках» после миомэктомии и блокировать их, тем самым предотвращая рецидивы.
Различными исследованиями доказана эффективность применения I3C для коррекции пролиферативных процессов в женской репродуктивной системе [21–25]. В данном исследовании подтверждена активность I3C в отношении аденомиоза, гиперплазии эндометрия, миомы матки. Введение этого фитонутриента в терапевтические схемы в дополнение к гормональной терапии позволяет добиваться более высокой результативности лечения. Приведенные выше данные наблюдательного исследования показали, что в некоторых случаях (например, при отказе пациентки от гормонотерапии) возможно назначение монотерапии I3C. Одна капсула «Гарде 150» (источник I3C в приведенном исследовании) содержит 150 мг индол-карбинола, при этом оптимальная суточная доза (300 мг) может быть достигнута приемом 2 капсул в день.
Заключение
Таким образом, проведенное исследование показало значимость индол-3-карбинола («Гарде 150») в комплексном консервативном лечении эстрогенозависимых доброкачественных заболеваний матки. При добавлении «Гарде 150» к традиционно используемым схемам гормональной терапии эндометриоза, миомы матки и гиперплазии эндометрия повышается эффективность этих схем лечения.
Также важную роль имеет добавление «Гарде 150» в схемы послеоперационной противорецидивной терапии после органосохраняющих операций. Эффективность противорецидивной терапии у пациенток после органосохраняющих операций оказалась одинаково успешной как при использовании аГнРГ, так и при применении I3C. Положительные результаты применения I3C («Гарде 150») для предотвращения рецидивов миоматозных узлов позволяют надеяться на снижение в дальнейшем числа повторных хирургических вмешательств у этих пациенток, улучшение качества жизни, а также сохранение их репродуктивной функции.
Кроме этого, отмечена хорошая переносимость предлагаемых схем лечения, что представляется особенно важным, если принять во внимание существенную длительность курса приема (от 3 до 6 месяцев).



