Последние 40 лет неонатальные инфекции, вызванные стрептококками группы В (СГВ), остаются в центре внимания многих специалистов в области перинатальной медицины. Ранние СГВ-септицемии и пневмонии у новорожденных отличаются тяжелым течением и высокой летальностью, что обратило на себя внимание еще в 70-е годы, когда в развитых странах СГВ вытеснил грамотрицательные бактерии с первых позиций в этиологической структуре неонатальных инфекций. С тех пор прошли десятилетия, но ведущая роль СГВ в структуре бактериальных перинатальных инфекций остается незыблемой, несмотря на предпринимаемые лечебные и профилактические мероприятия. Оказалось, что СГВ-инфекции новорожденных относятся к плохо управляемым инфекциям.
Было установлено, что СГВ (Streptococcus agalactiaе) являются комменсалом микробиоты кишечника человека, а у 20–40% женщин СГВ можно обнаружить во влагалище и часто – в уретре их половых партнеров. Показана достоверная связь носительства СГВ во влагалище не только с ранними септицемиями новорожденных, но и с самопроизвольными выкидышами, преждевременными родами, дородовым излитием околоплодных вод, мочевой инфекцией у беременных, рождением недоношенных детей, развитием хориоамнионита в родах, послеродовым эндометритом и сепсисом у родильниц [1–3]. Однако связь акушерской патологии и СГВ-носительства оказалась далеко не прямолинейной. Носительство СГВ во влагалище не является постоянным и чаще всего носит перемежающийся характер. Поэтому обследование во время беременности не дает адекватного прогноза о ситуации в родах. И хотя контаминация плода в родах происходит у каждой второй роженицы – носительницы СГВ, только у 2–5% инфицированных новорожденных развиваются тяжелые формы СГВ-инфекций с летальностью 20–70% [4] и наивысшими показателями при преждевременных родах. Чаще всего СГВ-сепсис регистрируют у новорожденных, рожденных матерями с высокой степенью колонизации влагалища, тем не менее, около 30% неонатального СГВ-сепсиса регистрируют при низких титрах СГВ в родовых путях [5]. Механизм заражения плода всегда связан с восходящим из влагалища инфицированием околоплодных вод, размножением и накоплением в них СГВ. Заражение плода происходит при заглатывании и аспирации им инфицированных околоплодных вод. Параллельно происходит развитие родовой деятельности. Известна родственность многих антигенов условно-патогенных микроорганизмов с тканевыми антигенами организма-хозяина. В норме тканевые фосфолипазы амнионального эпителия являются триггерами родовой деятельности, запуская синтез простагландинов Е2 и F2α. В условиях «синдрома инфекции околоплодных вод» быстро нарастает титр бактериальных фосфолипаз, которые и активируют синтез простагландинов при любом сроке беременности. Поэтому бактериальное инфицирование плодного яйца всегда является интранатальной инфекцией и сопровождается прерыванием беременности. В экспериментальных исследованиях показано, что СГВ проникают в околоплодные воды через неповрежденные плодные оболочки значительно быстрее, чем колиформные бактерии и гонококк, подтверждая точку зрения, что СГВ – наиболее вирулентный патоген в перинатальном периоде. В клинике при СГВ-амнионите возможно развитие внутриутробной асфиксии плода при целых плодных оболочках и рождение ребенка с симптомами респираторного дистресс-синдрома и/или асфиксическим механизмом смертельного исхода, когда морфологические и клинические признаки септического процесса еще не успевают развиться [6, 7].
Учитывая сравнительно низкий уровень неонатальных СГВ-инфекций при высокой частоте вагинального СГВ-носительства, можно полагать, что имеются выраженные механизмы защиты организма-хозяина от инвазивной инфекции, или патогенные потенции различных клонов СГВ значительно разнятся. Приходится констатировать, что о патогенетических механизмах развития СГВ-инфекций мы еще мало знаем, хотя в последние годы появляется много работ о молекулярно-генетических особенностях штаммов СГВ [3]. Уже можно считать реальностью создание вакцин для защиты новорожденных, хотя скепсис по поводу эффективности этого мероприятия не лишен основания, учитывая оппортунистический характер СГВ-инфекций (S. agalactiae – слабый иммуноген), при которых не выявляется выраженный иммунный ответ, и заболевают только индивиды с определенными дефектами иммунной системы. Тем не менее, вакцинация может стать наиболее эффективной стратегией по профилактике СГВ-инфекций у беременных и новорожденных [3, 8].
Первая попытка стратегического подхода к профилактике СГВ-инфекций новорожденных была предпринята Комитетом по инфекционным болезням Американской академии педиатров, издавшим в 1992 году Руководство по СГВ-профилактике. В 1996 году вышло Руководство, в котором был достигнут консенсус трех профессиональных сообществ: CDC, Американской академии педиатров и Американского общества акушеров-гинекологов. Периодически Руководство пересматривается и уточняется.
В США, Канаде, странах ЕЭС ставится стратегическая задача сделать СГВ-инфекцию управляемой. Поэтому решение проблемы проводят на эпидемиологическом уровне: регламентированы регистрация СГВ-носительства при обязательном скрининге всех беременных, а также выполнение всеми лечебными учреждениями единых профилактических и лечебных мероприятий среди рожениц. Рекомендации разработаны на основе многоцентровых исследований. Если в начале 1990-х годов в США частота ранних случаев СГВ-инфекций составляла 1–3 на 1000 рожденных живыми, то после введения скрининга беременных на СГВ-носительство и антибиотикопрофилактики в родах этот показатель снизился до 0,35–0,5, а летальность упала с 70 до 5–9% [4]. Самые высокие показатели раннего СГВ-сепсиса в Европе зарегистрированы во Франции, частота которого составляла в начале века 0,75‰, а при учете «возможных» случаев раннего СГВ-сепсиса достигала 4,75‰. Близкие показатели в Нидерландах – 1,71‰. В Испании частота раннего СГВ-сепсиса снизилась с 2,7 в 1992 году до 0,2‰ в 2001 г. [9]. Тем не менее, следует отметить, что в Англии и Швеции при отсутствии системного скрининга беременных и широкой антибиотикопрофилактики в родах показатели заболеваемости тяжелыми СГВ-инфекциями многие годы составляют 0,5–0,4‰ [10] . В этих странах придерживаются стратегии выявления клинических факторов риска как главного подхода к профилактике СГВ-инфекций у новорожденных, что нашло отражение в Европейском Руководстве по клинической практике. Исключение составляет скрининг мочевой СГВ-инфекции или бессимптомной СГВ-бактериурии (у 2–4% беременных), которые является абсолютным показанием для этиотропной терапии во время беременности.
Учитывая полученные доказательные данные о неэффективности как местного, так и системного применения пенициллинов у беременных для профилактики СГВ-инфекций у новорожденных, стратегия была сосредоточена на отборе беременных, которым показана антибиотикопрофилактика в родах. При этом предложено два приоритетных направления, в равной мере приемлемых: одно основывается на выявлении у рожениц клинических факторах риска (в анамнезе имеются указания на СГВ-инфекцию у новорожденного, выявлена СГВ-бактериурия во время настоящей беременности, преждевременные роды, лихорадка в родах >38°C, безводный промежуток более 18 часов); другое – на положительных результатах посевов (мазок из влагалища и прямой кишки, взятых на один тампон) при скрининге на СГВ-носительство всех беременных женщин в сроки 35–37 недель гестации. При отсутствии у беременной такого обследования в родах используют быстрые тесты выявления СГВ, например, ПЦР-диагностика при амплификации специфического cfb-гена [11].
Оба варианта не лишены недостатков и в последних рекомендациях CDC предлагается сочетать эти две стратегии, выбирая те или иные действия в каждом конкретном случае.
В России отсутствует официальная регистрация СГВ-инфекций новорожденных, и чаще всего эти случаи включены в общую графу «инфекции, характерные для перинатального периода». Обследование беременных на носительство СГВ также не является регламентированным. Отсутствуют данные по распространенности СГВ-носительства среди разных групп населения, что не позволяет делать выводы о распространении СГВ в российской популяции, разнообразии серотипов и генетической структуры, их роли в патологии мочеполовой системы у беременных и тяжелых инфекций у новорожденных. Отсутствие национальных данных диктует необходимость работы в этом направлении для получения современных данных, отражающих течение эпидемического процесса при СГВ-инфекции среди российской популяции беременных с учетом генетических особенностей как циркулирующих в стране штаммов S.agalactiae, так и иммунного статуса контингента беременных СГВ- носителей.
По данным нашего Центра частота тяжелых СГВ-инфекций у новорожденных (сепсис, менингит, пневмония) с ранним (до 7 суток жизни) началом за период 1997–2013 годы имела отчетливую тенденцию к снижению (рис. 1). Показатель составлял в 1997 году 3,53 на 1000 живорожденных, летальность – 60%. Снижение достигло показателя 0,46‰ к 2006 году. С 2008 по 2013 год отмечен подъем заболеваемости до 2,14–1,14‰. Летальность при тяжелых СГВ-инфекциях отсутствовала, начиная с 2002 года. Сравнительно высокие показатели заболеваемости СГВ-инфекциями объясняются концентрацией в Центре значительной доли беременных высокого риска, большим числом преждевременных родов, а начиная с 2008 года – выхаживанием детей, родившихся с очень низкой и экстремально низкой массой тела.
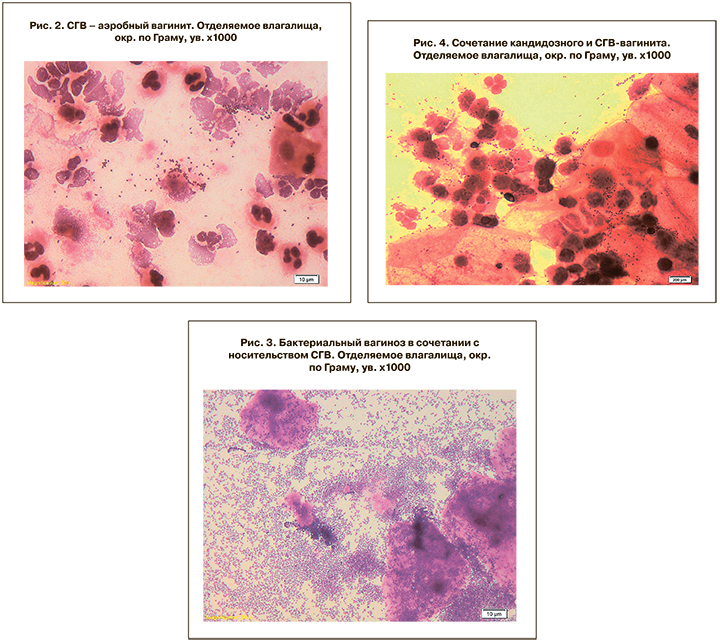
Что касается частоты вагинального носительства, то выявление его в различных группах женщин, по нашим данным, варьировало от 8–10% у небеременных женщин до 13–25% у беременных различной степени риска инфекционной патологии, достигая наивысших показателях при невынашивании беременности. Обследование 312 женщин группы инфекционного риска в динамике беременности показало, что присутствие СГВ во влагалище часто не является бессимптомным носительством, так как сопровождается комплексом признаков, позволяющим говорить о воспалительном процессе. У этих женщин отмечается отчетливое нарушение состава микробиоты влагалища: количественный уровень лактобацилл снижается <4 lg КОЕ/мл, при высоких показателях обсеменения СГВ >5 lg КОЕ/мл; часто отсутствуют другие виды транзиторного компонента микробиоты. Такие показатели культурального исследования сопровождаются выраженной лейкоцитарной реакции (более 20 лейкоцитов в поле зрения) в грам-мазках влагалищного отделяемого, что свидетельствует об активном воспалительном процессе (рис. 2 см. на вклейке). В таких случаях микробиологические данные позволяют диагностировать «аэробный вагинит» стрептококковой этиологии. Единичные случаи клинически выраженных вагинитов, вызванных СГВ, описаны E. Honig и соавт. [12] и V. Savini и соавт. [13]. По нашим данным, высеваемость СГВ при аэробных вагинитах у беременных составила 62,2%, на втором месте – энтерококки (48,7%), на третьем – кишечная палочка (40,8%,). Аэробные вагиниты в свою очередь диагностированы у 22% беременных с оппортунистическими инфекциями влагалища [14].
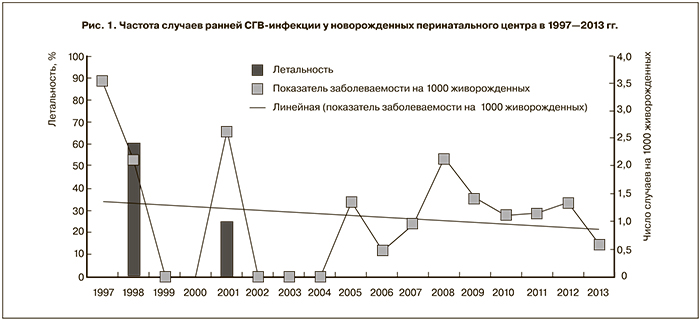
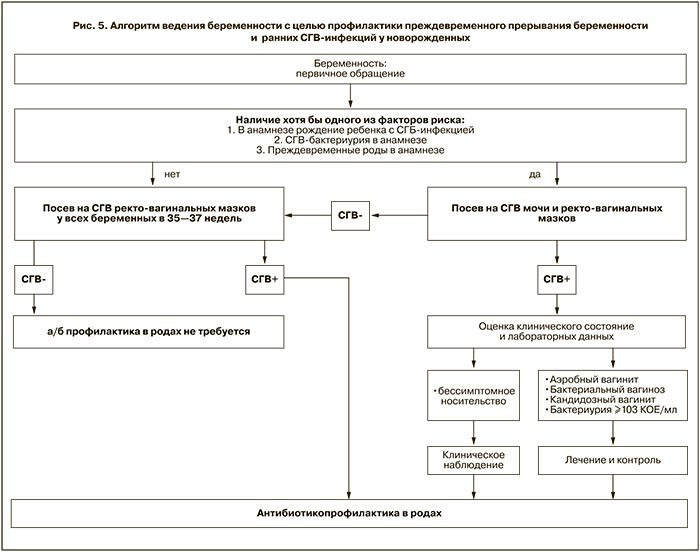
Кроме того, СГВ выявлен как сопутствующий компонент микробиоты у 16,4% беременных с бактериальным вагинозом (рис. 3 см. на вклейке) и у 17,0% обследованных при кандидозном вагините (рис. 4 см. на вклейке). Можно полагать, что в этих случаях лечение антианаэробными препаратами или антимикотиками будет создавать для СГВ селективные преимущества, что обеспечивает им благоприятные условия для размножения и проявления патогенных свойств.
При выявлении инфекций влагалища мы проводили местное антимикробное лечение преимущественно антисептиками, начиная с I триместра беременности, с последующим клиническим и микробиологическим контролем. Установлено, что среди женщин, обратившихся в ранние сроки беременности, не было случаев преждевременных родов. При обращении в консультативный центр во II триместре частота рождения недоношенных детей составила 6,7% и увеличивалась до 13,5% при первичном обращении в центр в III триместре беременности.
При микробиологическом обследовании сразу после рождения 295 новорожденных групп риска бактериальная колонизация желудочно-кишечного тракта обнаружена нами у 88 (12,9%), при этом клинические признаки инфекционного процесса имели место у 18 новорожденных (6,1%). Ведущим патогеном был S. agalactiae – у 8 детей (44,4%). E. coli выделена у 4 новорожденных, другие колиформные бактерии (Enterobacter asburiae, Klebsiella pneumoniae) – у 2 (11,1%), Сandida albicans – у 5 (27,8%). Полученные результаты полностью соответствуют этиологической структуре «аэробных» вагинитов у беременных. Мы полагаем, что при обследовании беременных на носительство СГВ только в сроки гестации 35–37 недель остаются неучтенными случаи прерывания беременности в ранние сроки, связанные с восходящим инфицированием СГВ.
Наша тактика профилактики преждевременного прерывания беременности и ранних СГВ-инфекций у новорожденных представлена на схеме (рис. 5) и включает следующие мероприятия:
- скрининг на вагинальное и мочевое СГВ-носительство среди беременных групп риска инфекционной патологии при первичном обращении, в том числе женщин, у которых в анамнезе имела место СГВ-инфекция у новорожденного;
- при выявлении у беременных носительства СГВ – конкретизация диагноза (вагинит, вагиноз, носительство), лечение (по клиническим и эпидемиологическим данным) с использованием местно антисептиков, как альтернатива – адекватная этиотропная терапия; в дальнейшем – микробиологический контроль в течение беременности;
- при выявлении у беременных бактериурии, вызванной СГВ – адекватное этиотропное лечение мочевой инфекции;
- в родах при наличии одного из факторов риска (лихорадка 38°С и выше, преждевременное излитие околоплодных вод при сроке беременности <37 недель, безводный промежуток более 18 часов, СГВ-бактериурия во время настоящей беременности, в анамнезе – рождение ребенка с СГВ-инфекцией) и отсутствии данных о СГВ-носительстве во время беременности необходимо обследование на СГВ-носительство с помощью быстрых тестов (ПЦР, иммунохроматографические тесты) и превентивное лечение ампициллином (внутривенно) до получения результата лабораторного обследования или окончания родов;
- бактериологическое обследование новорожденных групп инфекционного риска сразу после рождения (мазки из зева, меконий, аспират из желудка, по показаниям – пуповинная и периферическая кровь) с использованием селективных, хромогенных СГВ-сред и ПЦР-диагностики. Превентивное лечение ампициллином по клиническим показаниям до получения результатов лабораторного обследования.
Небезосновательны опасения, что на фоне значительного числа выявляемых беременных с вагинальным носительством СГВ, которые по программе общего скрининга должны получать антибиотики в родах (не менее 30% общей популяции рожениц), может увеличиться вероятность селекции резистентных к пенициллинам грамнегативных, в частности, колиформных бактерий. Эта закономерность четко показана в исследовании Е.М. Levine [15], когда на фоне увеличения охвата антибиотикопрофилактикой с 3 до 13% рожениц не было случаев ранних СГВ-инфекций у новорожденных, но частота случаев грамнегативного сепсиса увеличилась в 2 раза. При преждевременном излитии околоплодных вод при преждевременных родах P. Kuhn и соавт. [9] показали достоверное увеличение этиологической роли аминопенициллин-устойчивых штаммов E.coli в случаях раннего сепсиса у недоношенных новорожденных на фоне антимикробной СГВ-профилактики в родах. Хотя S.J. Schrag и соавт. [16] не отметили увеличения риска развития E. coli-раннего сепсиса, связанного с антибиотикопрофилактикой в родах, наш опыт показывает необходимость учета результатов микробиологического мониторинга у каждой конкретной пациентки.
Таким образом, решение проблемы СГВ-инфекций у новорожденных тесно связано с профилактикой преждевременных родов и зависит от таких региональных показателей, как частота вагинального носительства СГВ и других условно патогенных микроорганизмов, характеризующих состояние микробиоты влагалища у беременных (этиологическая структура оппортунистических вагинитов), а также частота преждевременных родов, механизм развития которых обусловлен восходящим инфицированием. С учетом этих показателей следует обозначить контингент беременных, подлежащих обследованию (с последующим лечением и/или наблюдением), а также тех, кто должен быть обследован в родах (быстрые тесты лабораторной диагностики).
Кроме того, стратегия профилактики ранних СГВ-инфекций у новорожденных должна быть более дальновидной и гибкой. СГВ-сепсис – только часть большой проблемы перинатальных септицемий, включающих, например, инфекции, вызванные колиформными бактериями, при которых действуют те же факторы риска, но спектр антибиотикочувствительности и механизмы развития резистентности у этих бактерий заметно отличаются от таковых у стрептококков.