Пролапс тазовых органов (ПТО) является одной из основных проблем здравоохранения, затрагивающей до 50% женщин, и его распространенность увеличивается с возрастом [1]. Апикальным пролапсом (АП) принято считать опущение шейки матки или оставшейся части влагалища после гистерэктомии, которая может сочетаться с передним (цистоцеле) и задним пролапсом (ректоцеле) [2–4]. АП составляет 15% всех видов пролапсов гениталий (ПГ), 80% АП сочетается с передним пролапсом [5–7]. Коррекция АП представляет собой одну из основных проблем в реконструктивной хирургии тазового дна [2].
Для лечения АП применяют консервативные и хирургические методы. Однако и в настоящее время продолжаются дискуссии о том, какие методы являются наиболее эффективными и безопасными [2].
К консервативным методам лечения АП относят: пессарий, фотодинамическую терапию, упражнения Кегеля. Однако данные способы лечения не являются эффективными для АП III–IV степени и применяются в основном с целью профилактики или на начальном этапе заболевания [8, 9]. Кроме того, рецидивы после коррекции ПТО составляют 30–40% [10], и, по данным рандомизированных перспективных и ретроспективных исследований, безупречные анатомические результаты не всегда гарантируют пациентке функциональную удовлетворенность в выполненной операции [10, 11].
В этой статье мы представляем различные хирургические способы лечения АП, а именно вагинальный подход к лечению АП, который может включать определенные методы, например, крепление к маточно-крестцовой или сакроспинальной связке или фиксацию с использованием mesh-технологий [12].
Подвешивание за маточно-крестцовую связку (uterosacral ligament suspension, далее – ULS) впервые было описано Miller N.F. в 1927 г. Операция выполнялась вагинальным способом путем билатеральной фиксации свода влагалища к основанию ножек крестцово-маточных связок нерассасывающимися «подъемными швами» [13]. Позже, в 1957 г., McCall M. предложил совмещать данную технику с кульдопластикой и сообщал об отсутствии послеоперационного энтероцеле после 3 лет наблюдения [14].
В 2000 г. Shull B.L. et al. опубликовали результаты 5-летнего наблюдения за отдаленными результатами после ULS у 302 женщин с АП IV степени по Baden Walker. Авторы отметили, что на повторный прием пришли 289/302 (96%) женщин. Из них 86% (251/289) не имели никаких жалоб и рецидивов пролапса, у 14% (38/289) отмечено незначительное опущение, при этом у 14/38 (37%) отмечен рецидив цистоцеле. В трех наблюдениях потребовалась интраоперационная гемотрансфузия, в одном наблюдении – утероцистостомия из-за повреждения мочеточника, двум пациенткам пришлось снять швы из-за отсутствия оттока мочи в раннем послеоперационном периоде, позже швы были наложены под контролем цистоскопии. Кроме того, одна женщина 85 лет с деменцией умерла дома на 4-е сутки после операции. Вскрытие не проводилось, предположительно – тромбоэмболия легочной артерии. Еще в одном наблюдении отмечена интраоперационная гибель у женщины 56 лет из-за сердечной недостаточности [15].
Повреждения мочеточника и мочевого пузыря являются одной из частых проблем во время операции ULS, поэтому после операции требуется проведение контрольной цистоскопии [16]. В некоторых случаях, когда маточно-крестцовые связки не идентифицированы или имеют недостаточную длину, применяется фиксация свода влагалища к фасции подвздошно-копчиковой мышцы билатерально. Эта процедура имеет преимущества в виде снижения вероятности нервно-сосудистой травмы и послеоперационного цистоцеле [17, 18]. Meeks G.R. (1994) сообщали об анатомическом успехе в 96% наблюдений у 110 пациентов [19]. Medina C.A. et al. (2008) сообщали, что подвешивание к фасции подвздошно-копчиковой мышцы не сокращает длину влагалища, в то время как при сакроспинальной фиксации наблюдается укорочение [20].
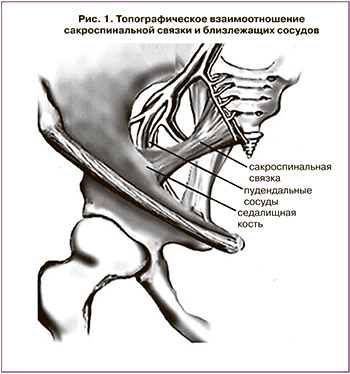 Фиксация за сакроспинальную связку (sacrospinous ligament fixation, далее –SLF) трансвагинальным доступом получила широкое применение после публикации Randall и D. Nichols в 1971 г. Данная методика используется для коррекции постгистерэктомического пролапса купола влагалища. Одной из основных причин является нарушение целостности крестцово-шеечно-кардинального комплекса, приводящего к ослаблению тазовой диафрагмы (рис. 1, 2) [8, 12, 21].
Фиксация за сакроспинальную связку (sacrospinous ligament fixation, далее –SLF) трансвагинальным доступом получила широкое применение после публикации Randall и D. Nichols в 1971 г. Данная методика используется для коррекции постгистерэктомического пролапса купола влагалища. Одной из основных причин является нарушение целостности крестцово-шеечно-кардинального комплекса, приводящего к ослаблению тазовой диафрагмы (рис. 1, 2) [8, 12, 21].
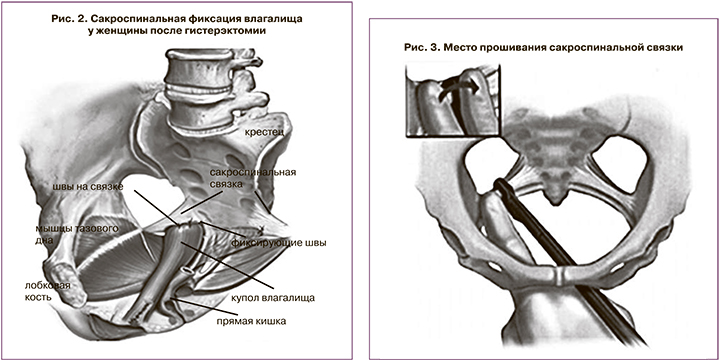
Суть данной методики заключается в фиксации свода влагалища к сакроспинальной связке нерассасывающимися синтетическими швами. Хирургическая техника сакроспинальной фиксации начинается с разреза по задней стенке влагалища с диссекцией тканей, открытия параректального пространства, выделения сакроспинальной связки. Для прошивания связки существует несколько методик. Наиболее распространены фиксация с использованием иглы Дешана и техника K. Myazaky (1987). Она более безопасна и проста, так как иглу проводят сквозь связку в околопрямокишечном пространстве под визуальным контролем. Продолжительность операции в среднем не превышает 25–40 минут [8] (рис. 3).
C. Giberti в 2000 г. предложил использовать перфораторы для проведения через связку нерассасывающегося шва. Особенностью данного способа являлось то, что перфораторы вводились под пальцевым контролем на заданную глубину [22].
W. Chang et al. (2006) предложили использовать для трансвагинальной сакроспинальной фиксации носитель Veronikis (VLC). Согласно их утверждению, это позволяет быстрее и безопаснее проводить лигатуру через сакроспинальную связку [23].
В литературе представлены данные об успешных односторонних фиксациях шейки матки к правой крестцовой-остистой связке у женщин репродуктивного возраста с наступлением беременности у одной из этих женщин [24].
Вагинальный способ SLF в сравнении с абдоминальным имеет ряд преимуществ: отсутствие лапаротомии, короткий срок пребывания в стационаре, сохранение длины влагалища [25, 26].
Наиболее распространенным недостатком SLF является высокая частота развития послеоперационного цистоцеле – до 20–33% [27, 28]. К другим недостаткам можно отнести несостоятельность шва [29], послеоперационные инфекции [30]. Это объяснялось техническими трудностями в обнажении связок, чрезмерным натяжением связок во время фиксации, высоким риском травм пудендальных и нижних ягодичных сосудов, седалищного и пудендального нерва [17]. Для предотвращения указанных осложнений большинство исследователей предлагают фиксировать швы к cакроспинальной связке на 2,5 см медиальнее от бугров вдоль седалищных остей к верхней границе крестцово-остистой связки [30].
Для снижения риска возникновения послеоперационного цистоцеле H. Winkler предложил фиксацию к сакропинальной связке через переднюю стенку влагалища, обнажая паравезикальное и параректальное пространство. Данная манипуляция позволяет занимать куполу влагалища более естественное анатомическое положение, чем при задней фиксации. Также для лечения тяжелых форм ПТО и восстановления анатомии тазового дна сакроспинальную фиксацию сочетают с применением сетчатых имплантов в комбинации с передней и задней кольпоррафией [31].
Впервые коррекцию постгистерэктомического пролапса с использованием синтетического материала вагинальным способом предложил P. Petros в 1997 г. [32]. Суть методики заключалась в восстановлении апикального компонента путем замещения дефекта крестцово-маточных связок синтетической лентой. Позже методика была переименована в заднюю интравагинальную слингопластику (ЗИВС) [33]. Наиболее частым осложнением методики ЗИВС была эрозия сетчатого импланта (8,5–9,8%). Шкапура Д.Д. в своей статье сообщает о высокой 9-летней эффективности ЗИВС (93,18%) [5].
Итальянскими учеными в 2014 г. было проведено исследование у 122 пациенток с апикальным пролапсом III–IV стадии по POP-Q. Они сравнили результаты после 61 наблюдения ЗИВС с 61 наблюдением после ULS. Срок наблюдения составил 36 месяцев. В группе женщин после ЗИВС не было выявлено ни одного рецидива пролапса. Однако у 4 (6,6%) пациенток были выявлены эрозии сетки и влагалищно-промежностные свищи, у 1 (1,6%) было выявлено ухудшение качества сексуальной жизни согласно опроснику PISQ-12 (The Pelvis Organ Prolapse/Urinary Incontinence Sexual Questionnaire). В 4 наблюдениях при эрозии пришлось прибегнуть к иссечению этих имплантов на фоне проведения антибиотикотерапии. Повторное оперативное вмешательство потребовалось только 1 пациентке из 4 в связи с развитием фистулы.
В группе ULS в 6,6% (4/61) наблюдений было отмечено бессимптомное рецидивирование АП. Следует отметить, что рецидив АП никак не влиял на качество жизни и на сексуальную функцию пациенток. Кроме этого, в обеих группах не было выявлено никаких отличий в длине влагалища. Исходя из этого, авторы пришли к выводу, что при постгистерэктомическом пролапсе методом выбора в первой очереди должна быть фиксация ULS, а использование синтетических материалов (ЗИВС) предпочтительнее при рецидивирующем пролапсе [34].
По мнению Д.Д. Шкапура, эффективная коррекция переднеапикального пролапса возможна при использовании полноразмерных сетчатых эндопротезов, обеспечивающих замещение поврежденных структур, реализуемая путем фиксации рукавов эндопротеза к сакроспинальным связкам троакарным или бестроакарным методом [5, 35, 36].
В 2017 г. Д.Д. Шкапурой были опубликованы данные о билатеральной сакроспинальной фиксации для лечения постгистерэктомического пролапса вагинальным способом при помощи монофиламентного синтетического эндопротеза «передний Пелвикс» (ООО «Линтекс», Санкт-Петербург). Оценка удовлетворенности составила 96%. Особенностью данной процедуры была фиксация купола влагалища через центральную часть протезирующего устройства (апикального слинга). При этом в качестве фиксирующих билатеральных лигатур использовался нерассасывающийся материал (Фторекс USP1). Затем фиксирующие лигатуры слинга завязывались между собой, тем самым создавая неоцервикс [35].
Гиперактивность мочевого пузыря персистировала спустя 12 месяцев в 37% наблюдений (3/8). У трех пациенток (5,6%) отмечена ургентность de novo. В большинстве случаев данная симптоматика купирована приемом холинолитиков. Стрессовое недержание мочи de novo было отмечено в 4 наблюдениях (6,5%). В течение полугодия 3 пациенткам был установлен добавочно субуретральный слинг. Одна пациентка отказалась от предложенного хирургического лечения ввиду слабой выраженности недержания [35].
Далее, в 2018 г. Шкапура Д.Д. применил этот же протез для лечения переднеапикального пролапса. В исследование были включены 150 женщин с переднеапикальным пролапсом III–IV стадии по POP-Q. После 2-летнего наблюдения отмечалось улучшение показателей уродинамики и качества жизни по данным опросника PISQ-12 (Pelvis Floor Impact Questionnaire) [5, 36].
Согласно данным FDA, к 2010 г. было проведено более 300 тыс. операций по коррекции генитального пролапса. При этом в 33% наблюдений использовались сетчатые импланты, четверть всех операций по коррекции пролапса гениталий выполнялась вагинальным способом [9].
Проблема настолько велика, что в 2012 г. в США решением комиссии FDA по применению сетчатых имплантов, после почти 2000 судебных исковых заявлений, широкое применение сетчатых протезов в гинекологии было признано нежелательным. По поводу mesh-осложнений было подано около тысячи исков. В результате последовала широкая дискуссия о безопасности метода [9, 37, 38]. В результате, по данным Heneghan, в июне 2019 г. 7 производителям пришлось выплатить почти 8 млн долларов более чем 100 тыс. пациенток [37].
В связи с многочисленными сообщениями FDA по поводу осложнений, возникающих после установки сеток, в Соединенных Штатах с 16 апреля 2019 г. прекращены продажа и распространение трансвагинальных сеток [38].
В Европе и частично в России наблюдалась аналогичная ситуация по поводу систем Elevate (AMS) и Prolift (ETHICON). По данным, приведенным в 2017 г. Шкапурой Д.Д., многочисленные интра- и послеоперационные осложнения, а также mesh-ассоциированные осложнения ограничили широкое распространение данных систем [35].
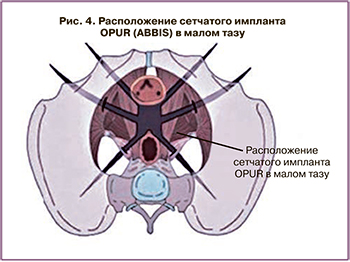 На смену старым системам пришел шестирукавный эндопротез OPUR (6-strap) (рис. 4), разработанный Delorme E. в 2008 г. в частной больнице (SainteMarie, ChalonsurSaone) во Франции. Согласно Delorme E., данный эндопротез должен обеспечивать естественную поддержку мочевого пузыря и, соответственно, апикальную. То есть данная конструкция должна создавать адекватную опору для основания мочевого пузыря и надежную апикальную опору. Помимо этого, вместо опасной и непредсказуемой техники вывода троакара была разработана методика введения заднего транссакроспинального (TSS) троакара по методике in-out. Это позволило вводить троакар через малый таз под ручным контролем вне «опасной» ишиоректальной зоны и предотвращать тяжелые осложнения (ранения прямой кишки и/или генитального сосудисто-нервного пучка) [39].
На смену старым системам пришел шестирукавный эндопротез OPUR (6-strap) (рис. 4), разработанный Delorme E. в 2008 г. в частной больнице (SainteMarie, ChalonsurSaone) во Франции. Согласно Delorme E., данный эндопротез должен обеспечивать естественную поддержку мочевого пузыря и, соответственно, апикальную. То есть данная конструкция должна создавать адекватную опору для основания мочевого пузыря и надежную апикальную опору. Помимо этого, вместо опасной и непредсказуемой техники вывода троакара была разработана методика введения заднего транссакроспинального (TSS) троакара по методике in-out. Это позволило вводить троакар через малый таз под ручным контролем вне «опасной» ишиоректальной зоны и предотвращать тяжелые осложнения (ранения прямой кишки и/или генитального сосудисто-нервного пучка) [39].
В 2016 г. A. Guyomard, E. Delorme опубликовали результаты трехлетнего опыта лечения передне-апикального пролапса 74 пациенток с применением 6-рукавного эндопротеза OPUR (ABISS). Успех данной процедуры составил 97%. Однако в раннем послеоперационном периоде наблюдались следующие осложнения: фебрилитет 14%; послеоперационные гематомы 4%; ишурия 28%; боль в области ягодицы 78%; инфекционные процессы урогенитального тракта 20%; эрозия слизистой влагалища 2% [40].
В России данную методику впервые применили А.Н. Никитин и А.М. Ищенко (2016) и опубликовали свой опыт лечения переднеапикального пролапса с применением синтетического протеза OPUR (ABISS) [41]. По данным авторов, у 43 женщин после 3-месячного наблюдения анатомический успех составил 93% и улучшение качества жизни достигнуто в 100%. В 11,6% наблюдений в послеоперационном периоде отмечены гематомы между мочевым пузырем и передней стенкой влагалища, разрешившиеся в течение 6 недель. В одном наблюдении во время операции отмечено кровотечение из ягодичной артерии (800 мл) [41].
В Польском журнале (Ginekologia Polska 2017 г.) были опубликованы результаты лечения переднеапикального пролапса у 39 пациенток с использованием сетчатого импланта OPUR [42]. В статье были проанализированы интраоперационные и послеоперационные осложнения. Послеоперационная оценка включала сбор анамнеза, клиническое обследование, УЗИ тазового дна, выполненное с использованием трансвагинального 2D-датчика и абдоминального 4D-датчика. В результате осложнений, требующих дополнительного оперативного вмешательства, отмечено не было. Анатомический успех составил 94,1%. У всех пациенток уретральный конец сетки располагался достаточно далеко от средней части уретры (по шкале POP-Q, УЗИ) и послеоперационных аррозий сетчатого импланта не наблюдалось. У 5 пациентов отмечена лихорадка продолжительностью менее 7 дней. У 3 пациенток возникли гематомы, которые прошли самостоятельно. Также не было ни одного случая послеоперационной диспареунии [42].
В числе обзора источников литературы, посвященных лечению АП вагинальным доступом, представляется важным рандомизированное исследование Еникеева М.Е., Еникеева Д.В., Королева Д.О., опубликованное в 2019 г. [43].
Авторы исследовали и осветили результаты применения протеза OPUR (ABBIS). В исследовании приняли участие 142 пациентки с переднеапикальным пролапсом (цистоцеле III и IV стадий по POP-Q). Средний возраст пациенток составил 57 лет, максимальный срок наблюдения переднеапикального пролапса 4 года. Все пациентки были обследованы через месяц после операции. Кроме того, 126 (89%) пациенток через 12 месяцев после операции и далее ежегодно в амбулаторных условиях также обследовались. Так, эффективность хирургического лечения пролапса шейки матки отмечена в 97% (138/142) наблюдений. Кроме того, в 85% случаев ирритативный компонент или полностью разрешился, или его проявление было незначительным. Обструктивное мочеиспускание было устранено во всех случаях. Ургентность de novo наблюдалась у 11 женщин (8%). В связи с этим в течение последующих 12 месяцев 8 пациенткам выполнена уретропексия. Согласно опроснику PISQ-12, было отмечено улучшение качества сексуальной жизни. В 100% случаев удалось справиться с цистоцеле. Однако в 73% случаев женщины жаловались на болезненность в ягодичной области, что, по-видимому, по мнению авторов, было связано с травматическим повреждением крестцово-спинальной связки и ягодичных мышц. Кроме того, авторы отмечают, что болезненность не влияла на качество жизни, не требовала обезболивающих средств и купировалась самостоятельно в течение 3–10 дней после операции, также не отмечено рецидивов цистоцеле [43].
Необходимо отметить, что в 2016 г. были опубликованы данные о 94% случаев успеха операций с использованием системы UpHold (BostonScientific) (протез меньше и легче предшествующих). Недостатки, связанные с использованием системы, таковы: 17% случаев экструзии сетчатого импланта, 3 случая перфорации стенок мочевого пузыря и единичный случай интраоперационного кровотечения [35].
Также в современной литературе опубликованы данные о лечении переднеапикального пролапса с помощью ультралегкой вагинальной сетки. А именно вагинальной сетки Restorelle DirectFix (19 г/м2). В данном исследовании приняли участие 142 пациентки, срок наблюдения составил 1 год. По данным исследования, анатомический успех составил 72% (восстановление цистоцеле), диспареунии de novo составили 13%, функциональный успех отмечен у 82% больных. Кроме того, 9 пациенток из 142 (6,3%) перенесли хирургическое вмешательство по поводу рецидива пролапса и 2/70 (2,9%) – по поводу обнажения влагалищной сетки [44].
По мнению ряда авторов, некоторые пациентки репродуктивного возраста, имеющие АП, опасаются сетчатых имплантатов. Альтернативой для них могут быть реконструктивно-пластические операции с использованием нативных тканей. Однако авторы в своих исследованиях связывали использование нативных тканей с высокой частотой рецидивов [45].
По данным Гаспарова А.С. (2014 г.), для женщин репродуктивного возраста с опущением матки (с одновременной элонгацией ее шейки) до настоящего времени является актуальной манчестерская операция (сочетание ампутации шейки матки, укорочения кардинальных связок, передней кольпорафии и леваторопластики) [46]. Широкое применение манчестерской операции объясняется использованием только влагалищного доступа, возможностью в последующем половой жизни и наступлением беременности. Следует также отметить, что наименьший процент рецидивов авторы отмечали именно после манчестерской операции [46, 47].
В 2017 г. Lua L.L., Vicente E.D. и соавт. сообщили о результатах проведенного исследования. В данном исследовании сравнивали сакроспинальную фиксацию (SLF), абдоминальную сакрокольпопексию (ASC) и лапароскопическую сакрокольпопексию (LSC) с учетом общей стоимости лечения при АП. Использовали базы данных Encounter в 2008–2012 гг. (статистический анализ проводился с использованием программы SAS 9.3). Сроки наблюдения составили 90 дней. Рассчитывались показатели повторных госпитализаций, амбулаторных посещений и посещений отделения неотложной помощи. За это время было проведено 17 547 операций (SLF), 6126 (ASC) и 10 708 процедур (LSC). Средняя стоимость при SLF составила $10,993; ASC – $12,763 и LSC – $13,647. По результатам данного исследования, они пришли к выводу, что затраты на SLF значительно ниже, чем на ASC/LSC [48].
В том же году рабочая группа FIGO в журнале Pelvic Floor Medicine and Reconstructive Surgery описывала различные методы лечения АП, основываясь на данных литературы, экономической эффективности, степени сложности и суммируя их с рекомендациями экспертов. Среди вагинальных оперативных вмешательств фиксация крестцово-спинальной связки (SLF) и подвешивание к маточно‐крестцовой связке (USL) имели сопоставимые результаты эффективности, невысокое количество осложнений и благоприятные исходы затрат [49].
В 2018 г. под эгидой британского общества урогинекологии (BSUG) было проведено электронное анкетирование урологов, работающих в высших учебных заведениях, гинекологов, проявляющих особый интерес к урологии, а также общих гинекологов. Целью была оценка тенденций в выборе хирургического лечения ПТО. Согласно результатам анкетирования, при маточно-влагалищном пролапсе основными методами хирургической коррекции по-прежнему остаются влагалищная гистерэктомия и репарация нативными тканями, (до 75% всех вмешательств). При АП методом выбора, согласно результатам анкетирования, оказалась сакрокольпопексия (до 54%). Лапароскопический доступ в сравнении с абдоминальным оказался наиболее предпочтительным для лечения АП (62% против 38% соответственно) [50].
В том же году Jelovsek J.E. et al. провели сравнительный анализ эффективности двух методик коррекции (ULS и SLF). Согласно их анализу, частота рецидивов после ULS составила 61,5%, а после SLF – 70,3%, что является несущественным отличием [51].
В 2019 г. группой французских ученых в рамках многоцентрового ретроспективного исследования была проведена оценка заболеваемости и смертности при ПТО. Из 4322 операций у 975 (22,5%) больных применялся абдоминальный подход, у 3277 (75,9%) женщин – вагинальный, у 68 (1,6%) больных – комбинированный. При абдоминальном подходе чаще фигурировали такие осложнения, как недержание мочи de novo, запоры и кишечная непроходимость. При влагалищном доступе чаще отмечались задержки мочи, образование гематом, возникновение de novo хронических болей и чрезмерное натяжение сетчатого импланта. Статистически значимых различий между группами по частоте тяжелых осложнений выявлено не было. Через год после хирургической коррекции переднеапикального пролапса с использованием сетчатых имплантов вагинальным доступом была отмечена более высокая частота недержания мочи de novo, хронической боли de novo и необходимости удаления импланта, чем после коррекции с применением нативных тканей. Был сделан вывод о том, что частота осложнений после двух типов операций (абдоминальным и вагинальным доступом) в целом вполне сопоставима. Однако лечение ПТО при помощи установки сетчатого импланта вагинальным способом сопровождается большей частотой послеоперационных осложнений в сравнении с использованием нативных тканей при вагинальной репарации [52].
Заключение
Таким образом, в настоящее время, по мнению исследователей, отмеченных в настоящем обзоре, не существует универсального метода коррекции АП вагинальным доступом. Так же, как и авторы, указанные в данном исследовании, мы считаем, что выбор оперативного вмешательства зависит от типа и выраженности пролапса, наличия или отсутствия таких симптомов, как нарушение дефекации, мочеиспускания, сексуальной дисфункции. Необходимо учитывать общее состояние здоровья женщины, желание сохранить матку, возможности хирурга. Важным является знание топографической анатомии, соблюдение техники установки импланта, опыт хирурга.



