Вульвовагинальный кандидоз (ВВК) – это вторая по частоте выявления причина патологических вагинальных выделений у женщин репродуктивного периода [1]. Примерно у 56–75% женщин развивается как минимум один эпизод ВВК в течение жизни, у 50% из них развивается повторный эпизод, а 8% женщин страдают от рецидивирующего ВВК [2].
Диагностика ВВК основывается на оценке жалоб и клинической картины, а также результатов лабораторных исследований. Клинические признаки ВВК включают зуд, жжение, отечность слизистых оболочек, творожистые выделения, гиперемию слизистой вульвы и/или влагалища. Однако ни один из них не является патогномоничным. Так, например, «классические» творожистые выделения выявляются только у 20–60% пациенток, а зуд у 50–87% [3].
Основными методами лабораторной диагностики ВВК являются микроскопия окрашенного препарата и культуральное исследование – посев на среду Сабуро.
Микроскопия окрашенного препарата позволяет получить результаты исследования в короткие сроки, однако чувствительность данного метода составляет 40–60% [4]. Кроме того, микроскопия не позволяет отличить C. albicans от других видов кандид, хотя известно, что C. glabrata и C. krusei проявляют резистентность или дозозависимую чувствительность к препаратам азолового ряда [5].
Культуральное исследование обладает большей чувствительностью [4], однако длительное время проведения исследования (до 7 дней) ограничивает использование метода, когда при наличии острого процесса необходимо быстрое получение результата.
В последние годы в лабораторную практику активно внедряются молекулярно-биологические методы (в частности, полимеразная цепная реакция (ПЦР) в режиме реального времени), которые, с одной стороны, обладают высокой чувствительностью, а с другой – позволяют получить результаты исследования в кратчайшие сроки [6–8]. Ранее в ФБУН ЦНИИ Эпидемиологии был разработан набор реагентов «АмплиСенс-Флороценоз/Кандиды-FL», который позволяет проводить определение и количественную оценку наиболее значимых видов Candida (С. albicans, C. glabrata, C. krusei, C. parapsilosis, C. tropicalis) в биоматериале из влагалища.
Целью данного исследования стало сравнение диагностических характеристик лабораторных методов (микроскопия, культуральное исследование, ПЦР) и клинических признаков в диагностике ВВК.
Материал и методы исследования
В исследование были включены образцы биологического материала от 154 пациенток Научно-консультативного клинико-диагностического центра (НККДЦ) ФБУН ЦНИИ Эпидемиологии Роспотребнадзора. Сбор материала проводили с декабря 2012 по июнь 2013 года. Средний возраст пациенток составил 28±6,3 года (от 17 до 45 лет). Основным критерием включения пациенток в исследование было наличие одного или нескольких симптомов инфекций вульвы/влагалища: жалобы на выделения из половых путей, зуд, жжение, гиперемию в области половых органов. В исследование включали пациенток, не принимавших антимикробные и пробиотические препараты, а также не использовавших антисептические средства в течение 4 недель до посещения врача. Все пациентки подписывали форму информированного согласия на участие в исследовании. Исследование было одобрено этическим комитетом ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Всем пациенткам проводили осмотр влагалища и шейки матки в зеркалах, а также бимануальное исследование. При осмотре получали вагинальные мазки с боковой стенки влагалища ватным тампоном (3 образца от каждой пациентки). Один из образцов помещали в пробирку со средой Amies, второй – в пробирку с транспортной средой ТСМ (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора), третий наносили на стекло для дальнейшей окраски по Граму и проведения микроскопии. Полученные образцы хранили следующим образом: образец для проведения культурального исследования – при температуре 6±2°C не более 24 часов до момента доставки в лабораторию, образцы для проведения ПЦР и микроскопии – при комнатной температуре не более двух суток до момента исследования.
 Для проведения микроскопии образцы окрашивали по Граму, далее проводили исследование с применением объективов х10 и х100. Во всех образцах регистрировали соотношение полиморфноядерных лейкоцитов (ПМЯЛ) и эпителиальных клеток (ЭК) как маркера воспалительной реакции слизистой влагалища, состав и соотношение разных морфотипов, наличие дрожжеподобных грибов.
Для проведения микроскопии образцы окрашивали по Граму, далее проводили исследование с применением объективов х10 и х100. Во всех образцах регистрировали соотношение полиморфноядерных лейкоцитов (ПМЯЛ) и эпителиальных клеток (ЭК) как маркера воспалительной реакции слизистой влагалища, состав и соотношение разных морфотипов, наличие дрожжеподобных грибов.
Культуральное исследование включало посев материала, выделение чистой культуры, идентификацию выделенного гриба рода Candida. Посев производили на чашки Петри со средой Сабуро с левомицетином методом истощающего штриха. Чашки помещали в термостат при температуре 37°С на 48 часов. При наличии роста на чашке производили пересев-перенос культуры гриба, выросшей на питательной среде, на другую, свежую питательную среду для получения чистой культуры. На следующий день суточную культуру исследовали для видовой идентификации. Для этого использовали систему «Auxacolor 2» (Bio-Rad, США). Рост дрожжей оценивали визуально по изменению цвета индикатора среды.
Для проведения молекулярно-биологического исследования методом ПЦР использовали набор реагентов «АмплиСенс-Флороценоз/Кандиды-FL» (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора), позволяющий одновременно выявлять в количественном формате Candida albicans, Candida glabrata, Candida krusei, Candida parapsilosis, Candida tropicalis. Для проведения исследования из исходной пробирки с биологическим материалом в среде ТСМ отбирали аликвоту 100 мкл, проводили выделение нуклеиновых кислот с помощью набора реагентов «ДНК-сорб-АМ» (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора) в соответствии с инструкцией производителя. Далее проводили амплификацию и учет результатов в соответствии с инструкцией производителя. Обработка результатов амплификации с количественной оценкой осуществлялась автоматически с использованием программного обеспечения, рекомендованного производителем.
После проведения лабораторных исследований определяли истинно положительные результаты (ИПР) – результаты выявления грибов рода Candida одновременно двумя или тремя методами (тестами), и истинно отрицательные результаты (ИОР) – отрицательные результаты, полученные одновременно двумя или тремя методами.
Диагноз ВВК считался установленным, если у пациентов с ИПР выявления грибов рода Candida присутствовали признаки воспаления: отек и/или гиперемия слизистой вульвы и/или влагалища. Диагноз ВВК считался неустановленным из-за отсутствия либо грибов рода Candida (ИОР), либо признаков воспаления. Диагностическая чувствительность (ДЧ) и диагностическая специфичность (ДС) каждого метода (М) рассчитывали относительно установленных случаев ВВК по формулам:
ДЧ (М) = (Npos/NВВК)*100%, ДС (М) = (Nneg/NВВК-neg)×100%,
- где ДЧ (М) – диагностическая чувствительность метода;
- ДС (М) – диагностическая специфичность метода;
- Npos – число положительных результатов по данным метода, полученных для пациенток, которым был установлен диагноз ВВК;
- NВВК – количество пациенток, которым был установлен диагноз ВВК;
- Nneg – число отрицательных результатов по данным метода, полученных для пациенток, которым не был установлен диагноз ВВК;
- NВВК-neg – количество пациенток, которым не был установлен диагноз ВВК.
Для оценки достоверности полученных в данной работе различий использовали точный тест Фишера.
Результаты исследования и обсуждение
Совершенствование диагностики ВВК по-прежнему остается актуальной задачей в связи с тем, что включает в себя как необходимость лабораторного выявления возбудителя инфекции (грибов рода Candida), так и оценку клинического статуса пациентки, в первую очередь, на предмет наличия или отсутствия признаков воспаления.
Основными лабораторными методами выявления грибов рода Candida являются микроскопия и культуральное исследование. В последние годы в лабораторной практике стали применяться молекулярно-биологические методы исследования на основе ПЦР. Каждый метод имеет свои особенности, которые влияют на интерпретацию результатов комплексного клинико-лабораторного обследования.
Все обследованные в нашей работе пациентки имели те или иные симптомы и субъективные причины для обращения к врачу. Причинами обращения стали патологические вагинальные выделения у 118 (76,6%) пациенток, у 37 (24,0%) из них выделения сопровождались зудом наружных половых органов; зуд наружных половых органов у 30 (19,5%) пациенток; боль в области наружных половых органов у 5 (3,2%) пациенток; жжение в области наружных половых органов у 1 (0,6%) пациентки.
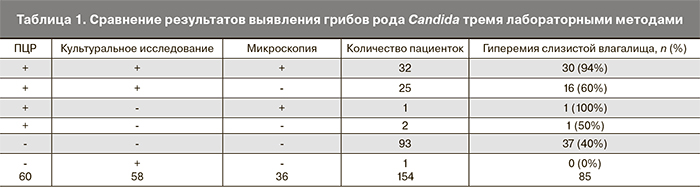
Из 154 обследованных пациенток грибы рода Candida были выявлены каким-либо из трех лабораторных методов у 63 пациенток. Наиболее высокий процент совпадений наблюдался между культуральным исследованием и ПЦР, а наименьший – между указанными методами и микроскопией. Исходя из принятых нами критериев, ИПР, то есть подтверждающими наличие кандидозной инфекции, были признаны результаты, полученные для 58 (37,7%) пациенток (табл. 1).
В качестве основного объективного признака воспаления нами была выбрана гиперемия слизистой влагалища. Среди всех обследованных женщин данный признак присутствовал у 85 (55,2%) пациенток. Из общего числа пациенток, инфицированных грибами рода Candida, признаки воспаления слизистой вульвы и/или влагалища были установлены у 47 женщин, которым и был поставлен диагноз ВВК.
Таким образом, доля пациенток с ВВК составила 81% пациенток с кандидозной инфекцией и 30,5% обследованных пациенток, что находится в рамках значений распространенности ВВК среди симптоматичных пациентов, установленных в исследованиях других авторов (15–40%) [1].
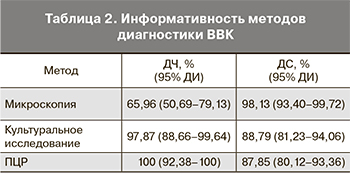
На основании полученных данных были рассчитаны характеристики (ДЧ и ДС) лабораторных методов диагностики ВВК (табл. 2).
Микроскопия, оставаясь самым быстрым и простым в исполнении лабораторным методом диагностики ВВК, обладает наименьшей чувствительностью.
В нашем исследовании ДЧ микроскопии составила 66%, что не позволило установить диагноз ВВК у 34% пациенток. По результатам исследований других авторов, ДЧ микроскопии значительно варьировала: 52% [9], 65% [10], 78% [11]. ДС в нашем исследовании оказалась довольно высокой (98,13%), в то время как в исследованиях других авторов этот показатель составлял 89% [10]. Факторами, которые могут приводить к диагностическим ошибкам при микроскопическом исследовании как в одну, так и другую сторону, являются низкая концентрация грибов рода Candida (21 из 24 (87,5%) полученных нами образцов с отрицательными результатами микроскопии содержали Candida в концентрации от 102 до 104 геномных эквивалентов в мл); присутствие в образце других микроорганизмов в высокой концентрации, включая грибы, не относящиеся к роду Candida, наличие клеточных ядер, пузырьков воздуха, частиц пыли [12].
Помимо простоты и скорости выполнения микроскопического исследования дополнительным преимуществом перед другими методами является возможность наблюдать диморфизм грибов рода Candida, заключающийся в способности пребывать в форме бластоспор, то есть клеточных форм, и/или (псевдо-) гифов (мицеллярных форм). Образование (псевдо-) гифов, согласно представлением о патогенезе кандидоза, отражает увеличение вирулентности грибов и является признаком их инвазии [13–15].
Однако в условиях лабораторного исследования не всегда удается выявить мицеллярные формы и тем более установить связь с клиническими проявлениями [11]. В нашей работе в результатах микроскопического исследования отсутствовали данные о наличии мицелия грибов. Физиологическими факторами, оказывающими влияние на переход одних форм Candida в другие, являются рН среды, плотность колонизации грибами, температура и др. [14, 16, 17]. Лабораторной причиной, затрудняющей выявление мицеллярных форм, является необходимость для их лучшего контрастирования исследовать препараты, предварительно обработанные 10–15% гидроксида калия [18]. В подавляющем же большинстве практических лабораторий такая обработка не проводится, и использование данного маркера для повышения информативности микроскопического исследования остается недоступным для клиницистов. Наконец, C.glabrata при микроскопии обнаруживается только в клеточной форме [19].
Культуральное исследование – значительно более чувствительный метод диагностики ВВК по сравнению с микроскопией (табл. 2). С использованием культурального исследования выявляется от 34%, как установлено в нашем исследовании, до 44 и даже 50%, как установлено в исследовании других авторов, случаев ВВК, не диагностируемых с помощью микроскопии [20]. В своем исследовании мы использовали методику культивирования с видовой идентификацией грибов и количественной оценкой. Самым существенным недостатком методики была длительность культивирования. В нашем случае получение чистой культуры занимало 3 дня, еще 3 дня требовалось для видовой идентификации кандид. В связи с этим в зарубежной практике культуральное исследование рекомендуют проводить при получении отрицательных результатов микроскопии и наличии у пациентки признаков вагинита, а видовую идентификацию – при осложненных формах ВВК и подозрении на устойчивость к антимикотическим препаратам [18, 21].
Однако такой подход в клинической практике Российской Федерации трудно применим, так как требует повторного посещения врача, а решение о спектре необходимых лабораторных исследований клиницист должен принимать уже при первичном обращении пациентки.
ПЦР-исследование с использованием набора реагентов «АмплиСенс-Флороценоз/Кандиды-FL» продемонстрировало самую высокую ДЧ – 100%, при этом показало высокую конкордантность с культуральным исследованием: 93,4% – совпадение положительных результатов и 95,9% – совпадение отрицательных результатов.
Особенностью использованной методики является возможность выявлять не только наиболее распространенный и патогенный вид кандид – C.albicans, но и другие виды (C.glabrata, C.krusei, C.parapsilosis и C.tropicalis) среди которых C.krusei резистентны, а C.glabrata проявляют дозозависимую чувствительность к препаратам азолового ряда (в частности, к флуконазолу) [5]. Таким образом, несмотря на то что ПЦР не позволяет напрямую определить чувствительность к антимикотическим препаратам, она позволяет определить те виды, присутствие которых требует изменения тактики терапии. Кроме того, методика позволяет проводить количественную оценку содержания кандид в биологическом материале, поскольку высокая концентрация кандид является маркером манифестной формы кандидозной инфекции, и наоборот, низкие концентрации грибов чаще ассоциированы с бессимптомным кандиданосительством [20, 22]. Наконец, время проведения ПЦР-исследования составляет в общей сложности 3,5 часа.
Подавляющее большинство выявленных грибов относились к виду C.albicans. По результатам ПЦР у всех 47 пациенток с ВВК обнаруживалась именно C.albicans, из них у одной из пациенток C.albicans обнаруживалась в сочетании с C.glabrata и C.krusei. По данным культурального исследования, C.albicans выявлена у 36 из 38 пациенток, еще у 8 пациенток определение вида Candida не проводилось. У одной пациентки была обнаружена C.glabrata, еще у одной – Criptococcus albidus (как было сказано выше, у этих пациенток по данным ПЦР была установлена принадлежность Candida к виду albicans). Необходимо отметить, что в процессе культурального исследования видовая идентификация производится на основании различной способности видов Candida к метаболизму сахаров и, соответственно, изменения цвета индикатора среды. В то же время в разработанном ранее и применяемом в данном исследовании наборе реагентов «АмплиСенс-Флороценоз/Кандиды-FL» видовая идентификация производится при помощи детекции генетической мишени (фрагмент области ITS между генами рРНК), специфичность которой для каждого вида Candida доказана в предыдущих зарубежных исследованиях [23]. В связи с этим есть основания полагать, что для дискордантных случаев верной является идентификация именно при использовании ПЦР.
ДС сравниваемых методов лабораторной диагностики ВВК находилась в пределах 87,85% для ПЦР и 98,13% для микроскопии (табл. 2). Соответственно, по данным разных методов, у 1,87–12,5% пациенток обнаруживали грибы рода Candida в отсутствие признаков ВВК. Наши результаты согласуются с результатами других исследователей, показавшими, что у 10–15% женщин наблюдается колонизация грибами рода Candida без симптомов и клинических проявлений ВВК [24]. Выявление случаев кандиданосительства имеет важное прогностическое значение, поскольку женщины, у которых наблюдается колонизация кандидами без клинических проявлений на момент обследования, – группа риска развития ВВК в будущем, в первую очередь после антибактериальной терапии [25–27].
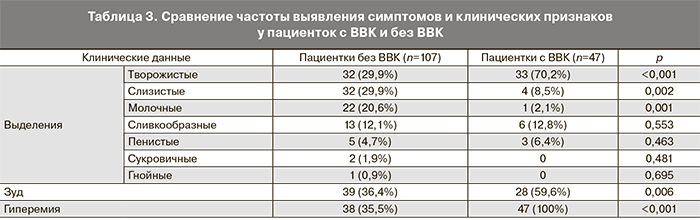
После установления случаев с доказанным ВВК была изучена частота выявления отдельных симптомов и клинических проявлений у пациентов с ВВК и без ВВК (табл. 3).
Как уже было указано, выделения из влагалища являлись основным симптомом. Творожистые выделения встречались в группе пациенток с ВВК достоверно чаще, чем в группе пациенток без ВВК (р<0,0001), однако и этот признак смог обеспечить ДЧ 70,2% при ДС 70,1%. Наименее информативным клиническим признаком оказался зуд в области наружных половых органов (ДЧ 59,6% при ДС 63,5%). Соответственно, при оценке клинических данных возможно предположить наличие ВВК в случае гиперемии слизистой влагалища (однако невысокая специфичность этого признака не позволяет поставить диагноз без лабораторных исследований), другие клинические признаки (творожистые выделения, зуд) обладают низкими показателями ДЧ и ДС, а потому не могут служить основанием для подтверждения или опровержения диагноза ВВК.
Заключение
Таким образом, при сравнении трех методов диагностики ВВК метод ПЦР и культуральное исследование продемонстрировали такие преимущества, как высокая чувствительность и специфичность, возможность количественного определения содержания Candida spp. и их видовой идентификации, при этом сроки получения результата методом ПЦР были сопоставимы с микроскопическим исследованием. Сочетание результатов ПЦР с данными клинического обследования позволят в кратчайшие сроки выявить наибольшее число случаев ВВК, а также обозначить группу риска развития заболевания в будущем среди здоровых пациенток.



