Рак шейки матки является одним из наиболее распространенных заболеваний женщин со смертельным исходом [1]. В мире ежегодно диагностируется более 500 000 случаев рака шейки матки, которые в половине случаев заканчиваются летально [2, 3]. Рак шейки матки – многостадийный процесс, развитию которого предшествуют предраковые процессы в шейке матки, инициированные вирусом папилломы человека (ВПЧ) [4, 5].
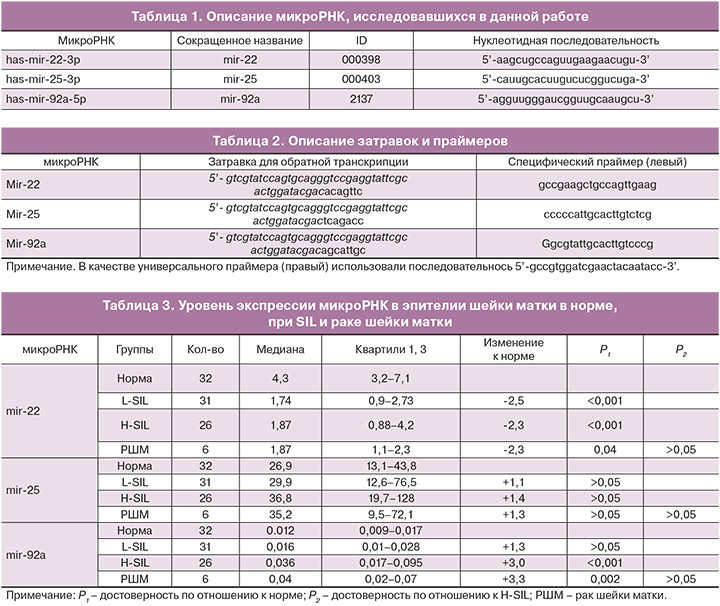
В настоящее время используется классификация предраковых поражений, предложенная в 1988 г. в США в г. Бетесда (Terminology Bethesda System, TBS) которая была пересмотрена в 1991, 2001 и 2014 гг. и на сегодняшний день рекомендована Всемирной организацией здравоохранения (ВОЗ) как наиболее оптимальная для интерпретации цитологических заключений.
К ее основным терминологическим характеристикам относятся: NILM (Negative for intraepithelial lesion or malignancy) – негативные в отношении интраэпителиального поражения или злокачественности; ASC (Atypicals squamous cells) – атипичные клетки плоского эпителия; ASC-US (Atypicals squamous cells undertermined significance) – атипичные клетки плоского эпителия неясного значения; ASC-H (Atypicals squamous cells cannot exclude HSIL – атипичные клетки плоского эпителия, не позволяющие исключить поражение эпителия тяжелой степени; LSIL (Low grade squamous cells intraepithelial lesion) – низкая степень плоскоклеточного интраэпителиального поражения; HSIL (High grade squamous cells intraepithelial lesion) – высокая степень плоскоклеточного интраэпителиального поражения; CIS (Carcinoma in situ) – рак in situ.
На сегодняшний день имеются убедительные доказательства, что основной причиной заболевания является инфицированность высокоонкогенными типами ВПЧ базальных эпителиальных клеток шейки матки, сопровождающаяся репликацией вирусной ДНК и синтезом ранних вирусных онкопротеинов Е5, Е6 и Е7, способных подавить клеточную дифференцировку, нарушить нормальные процессы апоптоза и пролиферации, вызвать повреждения хромосом и инициировать гиперпластические процессы в пораженной ткани вплоть до рака шейки матки [6].
В то же время известно, что наличия одной только папилломавирусной инфекции недостаточно для инициации злокачественной трансформации, необходимы другие факторы, как внутренние, так и внешние, которые играют важную роль в развитии рака шейки матки.
В последние годы открытие нетранслируемых низкомолекулярных РНК – микроРНК, регулирующих экспрессию генов на транскрипционном и посттранскрипционном уровне, кардинально изменило современную концепцию канцерогенеза шейки матки [7]. МикроРНК – короткие одноцепочечные молекулы длиной 20–25 нуклеотидов, осуществляющие регуляцию экспрессии генов на постранскрипционном уровне. Они участвуют в регуляции практически всех фундаментальных биологических процессов развития организма: делении клеток, апоптозе, дифференциации, клеточной миграции и инвазии, ангиогенезе, формировании иммунного ответа [8]. Многочисленные исследования свидетельствуют о значительной роли микроРНК в развитии онкологических заболеваний, в том числе и рака шейки матки [9, 10].
В настоящее время известно более 50 микроРНК, экспрессия которых меняется при неопластической трансформации эпителия шейки матки в процессе перехода от нормы к плоскоклеточным интраэпителиальным поражениями и цервикальному раку [11]. Развитие как предраковых, так и злокачественных процессов сопровождается повышением экспрессии проонкогенных микроРНК, усиливающих пролиферативную активность клеток, способствующих их метастазированию и инвазии, активирующих локальный ангиогенез. Одновременно снижается синтез противоопухолевых микроРНК, обеспечивающих функцию апоптоза, тормозящих процессы пролиферации, миграции, инвазии и ангиогенеза. Изучение динамики изменения экспрессии микроРНК на разных стадиях развития плоскоклеточных интраэпителиальных поражений, предоставляют новые возможности для разработки тканевых онкомаркеров с целью ранней диагностики, а также возможность использования микроРНК в качестве мишеней для противоопухолевой терапии.
В связи с этим целью настоящей работы было оценить возможность дифференциальной диагностики степени тяжести интраэпителиальных плоскоклеточных поражений шейки матки на основании количественной оценки экспрессии про- и противоонкогенных микроРНК: has-mir-22-3р, has-mir-25-3р и has-mir-92a-5р в соскобах шеечного эпителия.
Материал и методы исследования
В исследование были включены 95 женщин в возрасте от 18 до 49 лет (средний возраст составил 32,7±0,5 года). Всем было проведено общеклиническое обследование, тест на ВПЧ методом полимеразной цепной реакции (ПЦР) в реальном времени, цитологическое и иммуноцитохимическое обследование с определением р16ink4α/Ki67.
На основании результатов морфологического исследования были выделены 4 группы женщин: без патологии шейки матки (n=32), с LSIL (n=31), с НSIL (n=26) и с раком шейки матки (n=6). Критерии исключения: беременность, период лактации, отсутствие возможного следования протоколу. Среднее время наблюдения за пациентами составило 15,8 месяца.
Комплексное обследование женщин включало: сбор жалоб, анамнеза, оценку гинекологического статуса (наличие патологических процессов аногенитальной области, слизистой влагалища и шейки матки, наличие или отсутствие остроконечных кондилом), расширенную кольпоскопию, молекулярно-биологические методы исследования, цитологическое исследование, гистологическое исследование биопсийного материала. Жидкостная цитология проводилась по общепринятому протоколу – взятие мазков в surepath виалы (BD, США), приготовление цитологических препаратов и окрашивание по Папаниколау с помощью TriPath процессора (BD, США). Для иммуноцитохимического исследования использовали антитела для двойной окраски p16/Ki67 (CINtec PLUS cytologykit, Рош). Ставились положительные и отрицательные контрольные реакции.
Для исследования экспрессии микроРНК соскобы эпителия шейки матки собирали с помощью урогенитальных зондов, собранный материал переносили в пробирки с физиологическим раствором и центрифугировали при 1600 g в течение 10 минут. Надосадок удаляли, осадок растворяли в 100 мкл физиологического раствора. Суммарную РНК выделяли с использованием набора реагентов miRNeasyMiniKit (QiagenGmbH, Hilden, Germany) в соответствии с инструкцией к нему. Количественное измерение микроРНК проводили, как описано в протоколе [12]. Реакцию обратной транскрипции проводили с использованием шпилечной затравки к 3’, к концу которой дошивались специфические для каждой микроРНК 7-членные олигонуклеотиды. Коротко: к 5 мкл выделенной из образца суммарной РНК добавляли 7 мкл RT-смеси и олигонуклеотидной затравки (3 пМ). Реакция проводится 30 мин при 16°С, 30 мин при 42°С и 5 мин при 85°С. ПЦР проходила в объеме 20 мкл (18,5 мкл PCR-смесь; 1,5 мкл ДНК). Реакция проводилась 45 циклов в режиме 95°С – 15 сек, 50°С – 2 мин и 62°С – 15 сек. Описание использованных в работе микроРНК приведено в табл. 1, затравок и праймеров – в табл. 2.
Количественную оценку микроРНК проводили в условных единицах путем оценки ∆∆Сt по отношению к количеству ДНК, измеренному в том же объеме (5 мкл). Для измерения количества ДНК в исследуемом образце использовали комплект реагентов для ПЦР-амплификации геномной ДНК человека в режиме реального времени (КВМ) (НПФ ДНК-технология, Москва). Нормирование по отношению к ДНК проводили в связи с тем, что ее стабильность более высокая, чем мРНК и лучше коррелирует с количеством клеток в соскобах эпителия.
Для оценки суммарного уровня экспрессии одновременно по нескольким микроРНК данные их экспрессии у каждого пациента суммировали, используя формулы: для двух микроРНК – Аs=αА1/βА2, и для трех микроРНК – Аs =αА1/(βА2+gА3), где А1 – уровень экспрессии mir-22, А2 – mir-25 и А3 – mir-92a. α, β и g коэффициенты регрессии, которые для mir-25 – равны 1, для mir-22 – 12,75, для mir-92а – 1663,5.
Статистическую обработку результатов исследования экспрессии микроРНК проводили методом непараметрического анализа с использованием программы Statistica 10, IBM SPSS Statistics v22. Для сопоставления двух групп по количественным признакам применяли U-критерий Манна–Уитни. Различие между группами полагали статистически значимыми при р<0,05. Для выявления точки отсечки положительных результатов диагностического теста и определения его диагностической точности использовались бинарная логистическая регрессия и ROC-кривая.
Результаты исследования
На первом этапе исследования проводилась гистологическая верификация процесса. Диагноз плоскоклеточного интраэпителиального поражения высокой степени (H-SIL), подтверждался при обнаружении крупных комплексов разрозненно лежащих атипичных клеток плоского эпителия полиморфного вида с резко выраженным дискариозом, а также фигурами митозов; плоскоклеточного интраэпителиального поражения низкой степени (L-SIL) – при выявлении клеток плоского эпителия с легким дискариозом в сочетании с наличием сохранных зрелых клеток парабазального и поверхностного слоев. В мазках, негативных в отношении интраэпителиального поражения, содержались единичные койлоциты, лейкоциты, пласты плоского и цилиндрического эпителия с реактивными изменениями и явлениями лейкопедеза, атипичные клетки отсутствовали, что соответствует диагнозу NILM.
В табл. 3 приведены результаты оценки экспрессии микроРНК в соскобе эпителия из шейки матки при SIL различных степей тяжести. Экспрессия mir-22 более чем в 2 раза была снижена при LSIL и HSIL, по сравнению с нормой, но зависимости от степени поражения не выявлено. Экспрессия mir-25 была несколько выше при плоскоклеточных интраэпителиальных поражениях (LSIL и HSIL) по сравнению с нормой, однако эти различия были не достоверные. Уровень экспрессии mir-92а при HSIL и раке шейки матки по сравнению с контрольной группой был повышен в 3 и более раз, тогда как при LSIL экспрессия mir-92а в шеечном эпителии практически не отличалась от нормы.
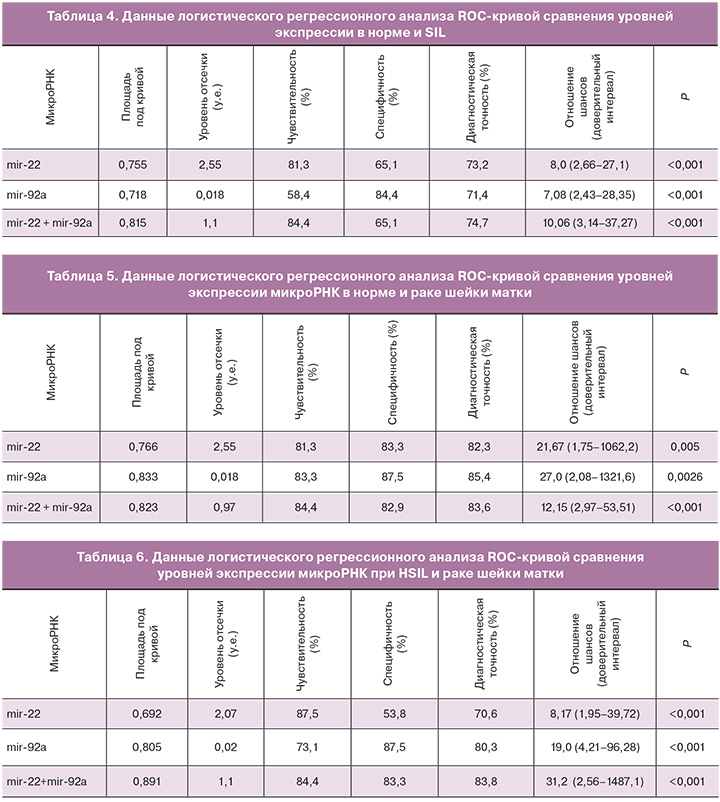
С целью оценки возможности применения значений уровней экспрессии микроРНК в соскобах из шейки матки для дифференциальной диагностики плоскоклеточных интраэпителиальных поражений был применен ROC-анализ. Результаты, представленные в табл. 4, показали, что наибольшая диагностическая точность выявления SIL, независимо от их степени тяжести достигалась при оценке суммарного показателя экспрессии двух (mir-22+92а) и трех (mir-22+25+92а) микроРНК – 74,7 и 75,5% соответственно. При этом шанс правильной постановки диагноза был повышен в 10 раз (р<0,001).
Точность диагностики рака шейки матки (табл. 5) была одинаково высокой при оценке как уровня экспрессии отдельно mir-22 или mir-92а (соответственно 82,3 и 85,4%), так и суммарного показателя экспрессии mir-22+92а (83,6%) или mir-22+25+92а (82,3%). Чувствительность и специфичность диагностики рака шейки матки при уровне экспрессии mir-22 выше 2,55 у.е. составили соответственно 81,3 и 83,3% (отношение шансов – 21,67, р=0,005). Несколько большая точность диагностики рака шейки матки выявилась при оценке экспрессии mir-92а – при уровне экспрессии выше 0,018 у.е. чувствительность составили 83,3%, специфичность – 87,5%. Похожие результаты были получены по данным показателя суммарной экспрессии, как по двум, так и по трем микроРНК.
Проведение логистического регрессионного анализа ROC-кривой результатов количественной оценки экспрессии микроРНК позволяет выявить критерии дифференциации рака шейки матки от HSIL (табл. 6).
При уровне экспрессии mir-22 ниже 2,07 у.е. диагноз рака шейки матки может быть поставлен с чувствительностью 87,5% и специфичностью 53,8% (отношение шансов – 8,17, р=0,001). При уровне экспрессии mir-92а выше 0,02 у.е. чувствительность и специфичность дифференциации рака шейки матки от HSIL составили соответственно 73,1% и 87,5% (отношение шансов – 19,0, р<0,001). Максимальная диагностическая точность достигалась при анализе суммарного показателя экспрессии mir-22+mir-92а – при значении показателя ниже 1,1 чувствительность и специфичность дифференциации рака шейки матки от HSIL составили соответственно 84,4 и 83,3% (ОШ=31,2, р=0,001).
Обсуждение результатов
На сегодняшний день установлено более 50 микроРНК, уровень экспрессии, которых меняется в пораженных тканях в процессе перехода от нормы к LSIL, далее к HSIL и цервикальному раку [13, 14].
Выявление меняющих экспрессию микроРНК в соскобах шейки матки делает их практически идеальными неинвазивными маркерами для диагностики плоскоклеточных интраэпителиальных поражений различных степеней тяжести. В работе О. Tian с соавт. [15] было показано, что изменение уровня экспрессии 4 микроРНК – mir-424, mir-375, mir-34а и mir-218 более эффективно, чем Рар-тест, дифференцирует плоскоклеточные интраэпителиальные поражения низкой степени от высокой, а предраковые состояния – от рака шейки матки. В другой работе было показано, что уровень микроРНК Let-7c в соскобах шеечного эпителия снижается пропорционально тяжести интраэпителиального поражения [16].
В настояшей работе было показано, что экспрессия по крайней мере двух микроРНК – mir-22 и mir-92а значительно менялась в клетках шеечного эпителия по сравнению с нормой. Экспрессия mir-22 снизилась более чем в 2 раза при всех плоскоклеточных интраэпителиальных поражениях, независимо от тяжести. Снижение экспрессии этой микроРНК в пораженных тканях было показано и при многих других формах рака [17].
Известно, что mir-22 стимулирует канцерогенез и метастазирование, являясь прямой мишенью для противоопухолевых генов PTEN и TET [18].
Прямой мишенью для mir-92а также является ген PTEN, повышение экспрессии данной микроРНК было установлено при многих видах злокачественных заболеваний [19]. В проведенных нами исследованиях экспрессия mir-92а также была значительно повышена в шеечном эпителии у пациенток с HSIL и раком шейки матки; небольшое повышение отмечено при LSIL.
Mir-25 относится к кластеру miR-17-92a-1, синтезиуется в составе единого транскрипта с mir-92а. Как и в отношении всех микроРНК этого кластера, повышенную экспрессию mir-25 выявляли при многих типах опухолей человека [16]. Однако в своей работе мы увидели лишь небольшую тенденцию к повышенной экспрессии mir-25 в шеечных соскобах пациенток с HSIL и раком шейки матки. В то же время было отмечено на три порядка более высокое содержание mir-25, чем mir-92а в шеечном эпителии (см. табл. 3). Mir-25 участвует практически во всех процессах клеточного деления, подавляя апоптоз и активируя клеточную пролиферацию [20]. По-видимому, столь высокая экспрессия этой микроРНК в данном случае объясняется способностью железистого эпителия к самообновлению, высокой пролиферативной активностью клеток шеечного эпителия и в норме.
Выявленные нами изменения экспрессии микроРНК в шеечных соскобах, коррелирующие с тяжестью интраэпителиальных поражений в шейке матки, дают возможность для неинвазивной диагностики заболевания. Установленные в работе пороги отсечки уровней экспрессии mir-22 и mir-92а позволяют с хорошей точностью (более 80%) дифференцировать рак шеки матки как среди пациенток без патологий, так и с HSIL. Наибольшая эффективность диагностики SIL достигалась при оценке показателя суммарной экспрессии двух или трех микроРНК.
Заключение
Таким образом, изменение профиля экспрессии микроРНК, позволяет с высокой точностью дифференцировать ранние стадии плоскоклеточных интраэпителиальных поражений шейки матки от нормы и цервикальный рак от предраковых состояний. Так снижение более чем в 2 раза уровня экспрессии гена miR-22 достоверно чаще выявляется у пациенток с легкими и тяжелыми поражениями шеечного эпителия (p<0,001). Изучение уровня экспрессии гена miR-92а при HSIL и раке шейки матки установило трехкратное и более повышение уровня экспрессии гена по сравнению с контрольной группой. Также было установлено, что показатель суммарной экспрессии по двум и трем генам микроРНК позволяет более точно верифицировать тяжесть плоскоклеточных интраэпителиальных поражений и рака шейки матки по сравнению с показателем уровня экспрессии одного гена. Так снижение суммарного показателя уровня экспрессии miR-22+miR-92а отмечалось в 2,6 раза у пациенток с LSIL и в 6 и более раз – у пациенток с HSIL и раком шейки матки (p<0,001). При анализе суммарного показателя уровня экспрессии miR-22+miR-92а было установлено, что значение ниже 1,1 у.е. позволяет дифференцировать рак шейки матки от HSIL с чувствительностью 84,4% и специфичностью 83,3% соответственно.
Проведенное исследование позволяет наряду с традиционными методами рассматривать уровени экспрессии микроРНК mir-22 и mir-92а как информативные молекулярные маркеры прогнозирования степени поражения цервикального эпителия при предраке и раке шейки матки.



