До недавнего времени наиболее эффективным методом скрининга распространенных хромосомных аномалий плода (синдром Дауна, синдром Эдвардса, синдром Патау и синдром Тернера) считали биохимический и ультразвуковой скрининг в первом триместре беременности.
Комплексная оценка уровня биохимических маркеров (свободный хорионический гонадотропин человека (ХГЧ) и плазменный протеин, связанный с беременностью (РАРР-А)) в сочетании с толщиной воротникового пространства в 11–13 недель беременности и возрастом матери позволяет выявить до 90% плодов с трисомией 21 при уровне ложноположительных результатов 5% [1].
Использование дополнительных биохимических и ультразвуковых маркеров, включая определение плацентарного фактора роста в сыворотке беременной, оценку носовых костей и кровоток в венозном протоке, может повысить выявляемость до 95% и снизить уровень ложноположительных результатов до 3% [1].
Инвазивная пренатальная диагностика (биопсия ворсин хориона или амниоцентез), проведение которой требуется беременным «группы риска», в 1% случаев сопряжена с риском осложнений.
Обнаружение внеклеточной ДНК плода, свободно циркулирующей в плазме матери, позволило получить новый метод скрининга анеуплоидий плода – неинвазивный пренатальный тест (НИПТ). Поскольку внеклеточная ДНК плода преодолевает гематоплацентарный барьер и попадает в материнский кровоток, то просто взяв кровь у беременной, можно обнаружить нарушение численности хромосом у плода, избежав при этом риска внутриматочного вмешательства, которое необходимо для получения клеток плода на исследование. Концентрация внеклеточной ДНК плода в сыворотке беременной с 9 недель в среднем составляет 10% общего объема внеклеточной ДНК. Процент фетальной фракции нарастает с увеличением гестационного срока.
Исследования показали высокую эффективность НИПТ в отношении наиболее частых анеуплоидий плода (синдромов Дауна, Эдвардса, Патау, Тернера), которые составляют 95% всех хромосомных аномалий. Выявляемость трисомии 21 при НИПТ превышает 99% при уровне ложноположительных результатов около 0,1% [2–11].
Существует два принципиально различных подхода к анализу фетальной ДНК. При «количественном» методе, используемом большинством тестов, проводится статистическая обработка результатов секвенирования суммарной внеклеточной ДНК матери и плода и сравнение с референсным геномом. Тест Panorama – единственный, при котором специально секвенируют однонуклеотидные полиморфизмы (SNP) и различают генотип матери и плода.
Целью данного исследования являлась оценка эффективности НИПТ Panorama, основанного на исследовании SNP, для выявления трисомий 21, 18, 13 и анеуплоидий половых хромосом плода в образцах материнской крови.
Материал и методы исследования
Образцы материнской венозной крови (20 mL in Streck cell-free DNA BCTTM tubes) были получены у 2028 пациенток с одноплодной беременностью на сроке от 9 до 24 недель и отправлены в лабораторию Натера (Сан-Карлос, Калифорния). Информация, предоставленная в лабораторию по каждому из образцов, была следующей: уникальный код пациента, возраст матери, гестационный возраст, расовая принадлежность и дата забора крови.
Подготовка образцов включала ПЦР-амплификацию, секвенирование и информационный анализ результатов секвенирования, который позволяет разделить фетальную ДНК от материнской геномной ДНК.
Для анализа внеклеточной ДНК плода использован метод, основанный на исследовании однонуклеотидных полиморфизмов (SNP) с использованием таргетной амплификации и анализа 19488 SNPs на хромосомах 21, 18, 13, X, и Y в одной реакции [12, 13].
После секвенирования из плазмы получают генотип матери и плода, а из лейкоцитов генотип матери, из информации о генотипе плода и матери удалили информацию о генотипе матери и таким образом получили изолированную информацию о генотипе плода. Затем применялся статистический метод максимального правдоподобия в сочетании с алгоритмом NATUS (Next-generation Aneuploidy Test Using SNPs – тест на анеуплоидии следующего поколения, использующий SNP) для определения количества хромосомного материала от пяти хромосом, исследуемых в каждом образце. Результаты были представлены в виде числа копий пяти хромосом, исследованных в каждом образце, вместе с вычисленной погрешностью по каждой хромосоме.
Затем определяли корреляцию между результатами анализа и кариотипом плода или исходами родов. Кариотип плода исследовали с помощью стандартного цитогенетического анализа (G-окрашивание) клеток ворсин хориона или амниотической жидкости.
Результаты исследования
Средний возраст матери в исследуемой группе составил 34,6 года (диапазон от 19 до 45 лет), а средний гестационный возраст на момент забора проб составил 14,9 (от 9, 2 до 24,1) недель.
Результаты анализа фетальной ДНК в крови матери были получены для 2010 (99,1%) из 2028 беременных. В 66 наблюдениях (3,3%), в том числе в 1 случае трисомии 18 и в 1 случае трисомии 13 у плодов результат не был получен с первого раза, поскольку в образце был недостаточный процент фетальной фракция ДНК (менее 3,5%). Мы произвели повторный забор венозной крови у 62 беременных, в 18 наблюдениях результат так и не был получен. Средний уровень фетальной ДНК среди пациентов, у которых не получился результат – 2,9%, в отличие от пациентов с полученным результатом – 11,1%.
Большинство беременных (1109 из 2028 обследованных) сдавали НИПТ в связи с высоким риском анеуплоидии плода по результатам комбинированного пренатального скрининга, основанного на оценке возраста матери, биохимических маркеров (свободный ХГЧ и РАРР-А) в сочетании с толщиной воротникового пространства в 11–13 недель гестации. На основании общепринятой схемы обследования эти беременные должны были подвергнуться инвазивной пренатальной диагностике, связанной с риском осложнений. Средний предполагаемый риск трисомии 21-й, 18-й или 13-й хромосом при комбинированном тесте у обследованных беременных был 1: 2519 (диапазон 1:7 – 1:21 827).
В 39 наблюдениях по результатам НИПТ получен высокий риск хромосомой патологии, беременным рекомендовано проведение инвазивной пренатальной диагностики). Две пациентки с высоким риском аномалий по половым хромосомам отказались от инвазивного вмешательства. В 37 наблюдениях нами проведена инвазивная пренатальная диагностика: в 10 случаях – аспирация ворсин хориона, в 27 – амниоцентез. Результаты пренатального кариотипирования в 34 наблюдениях полностью совпали с данными полученными при анализе фетальной ДНК (табл. 1).
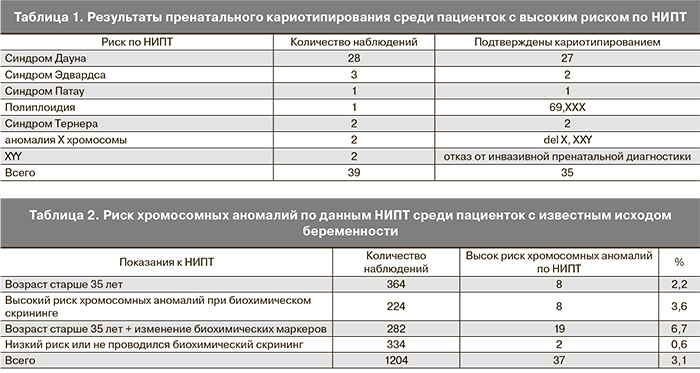
Таким образом, при исследовании фетальной ДНК с использованием SNPs были правильно идентифицированы 27 случаев трисомии 21, 2 – трисомии 18, 1 – трисомии 13, 2 – моносомии Х, 2 – аномалии Х-хромосомы. Пол плода определен правильно во всех случаях. В 1 наблюдении с повышенным риском по НИПТ трисомии 18 и в 1 – трисомии 21, при цитогенетическом исследовании клеток амниотической жидкости аномалий в хромосомном наборе плода не выявлено. Таким образом в 2 наблюдениях обнаружен ложноположительный результат. В одном случае было обнаружено множество материнских гаплотипов, что указывает или на многоплодную беременность, или на триплоидию. Поскольку ультразвуковое исследование подтвердило одноплодную беременность, образец был идентифицирован как триплоидный и подтвержден при амниоцентезе (69,ХХХ). В 2 наблюдениях мы получили заключение о высоком риске аномалий Х-хромосомы. При кариотипировании в 1 наблюдении диагностирован синдром Клайнфельтера (47 ХХУ), в 1 – делеция на коротком плече Х хромосомы.
В 1204 наблюдениях нам известны исходы беременностей: 35 пациенток с выявленной хромосомной патологией плода (подтвержденной пренатальным кариотипированим) прервали беременность, 1169 – закончились родами без хромосомной патологии.
Из 1204 беременных 870 (72,2%) относились к группе высокого риска: 364 – старше 35 лет, 224 – с аномальными биохимическими показателями сыворотки крови, 282 – с сочетанием факторов риска. Всем 870 беременным было показано проведение инвазивной пренатальной диагностики. По результатам НИПТ только 37 (4,3%) из них потребовалось инвазивное вмешательство (табл. 2).
Без показаний НИПТ сдавали 334 беременные (по собственному желанию), среди них в 1 наблюдении обнаружена моносомия Х, в 1 – трисомия 21.
Из 28 пациенток с высоким риском синдрома Дауна по результатам НИПТ при кариотипировании трисомия 21-й хромосомы подтверждена в 27 наблюдениях, отмечен 1 ложноположительный результат. Ложноотрицательных результатов по Panorama-тесту нами не было получено. Таким образом чувствительность НИПТ для синдрома Дауна в нашем исследовании достигла 100%, положительный предсказательный результат составил 96,6% при уровне ложноположительных ответов – 0,05%.
Из-за небольшого количества образцов с трисомиями 13, 18, моносомией X чувствительность для этих синдромов не рассчитывалась. У 611 плодов мужского пола, за исключением синдрома Клайнфельтера, была одна копия хромосомы Х и одна копия хромосомы Y. У 589 плодов женского пола, за исключением двух случаев синдрома Тернера и одного случая триплоидии, число копий хромосомы X было равно двум, таким образом, точность метода для определения пола плода составила 100%.
Обсуждение
Результаты этого исследования показали, что НИПТ на частые анеуплоидии значительно превосходит по эффективности традиционные скрининговые методы. При проведении НИПТ, основанного на SNP-анализе внеклеточной ДНК плода в крови матери, полученной на сроке от 9 до 24 недель 2010 одноплодных беременностей, выявлены все случаи трисомий 13-й, 18-й, 21-й хромосом, синдрома Тернера, синдрома Клайнфельтера и полиплоидии. Отмечено 2 ложноположительных результата и правильно определен пол плода во всех случаях. Тест не дал результатов в 0,9% наблюдений. Наиболее частой причиной этого была низкая фракция фетальной ДНК. По данным ряда исследователей, снижение уровня фетальной фракции ДНК наблюдается при снижении ХГЧ в сыворотке крови и при избыточной массе тела беременной [14]. Также исследователями отмечено, что при отсутствии результата в четыре раза выше вероятность обнаружить анеуплоидию [15].
Высокий риск трисомий 21-й, 18-й и 13-й хромосом на основании возраста матери, данных ультразвукового и биохимического исследований сыворотки крови матери является причиной, по которой родители принимают решение о инвазивном вмешательстве с целью кариотипирования плода. В нашем исследовании 1239 беременным удалось избежать инвазивной пренатальной диагностики, связанной с риском осложнений.
Хотя в большинстве стран скрининг анеуплоидий, по существу, фокусируется на скрининге трисомии 21-й хромосомы, инвазивная диагностика в группе с положительными результатами скрининга приводит к обнаружению множества дополнительных клинически значимых анеуплоидий. В данном исследовании были выявлены трисомия 13, 18, моносомия X, синдром Клайнфельтера, дисомия Y-хромосомы, полиплоидия и микроделеция Х-хромосомы.
Как показано в данном исследовании, большинство беременностей, при которых комбинированный тест выявил высокий риск трисомии 21-й, 18-й или 13-й хромосомы, являются эуплоидными, и в таких случаях, использование анализа фетальной ДНК помогло значительно снизить количество ненужных инвазивных тестов и устранить связанный с ними риск потери беременности. НИПТ также может быть полезным в качестве второго теста по результатам комбинированного скрининга, основанного на данных ультразвукового и биохимического исследований и возраста матери.
В это исследование также были включены беременные с низким риском. В этой группе в 2 наблюдениях мы выявили хромосомные аномалии. Следовательно НИПТ может применяться в качестве универсального скринингового теста на анеуплоидии у всех беременных женщин.
Заключение
Данное исследование показало, что анализ свободно циркулирующей внеклеточной ДНК плода в крови матери с использованием таргетного секвенирования SNPs на хромосомах 13, 18, 21, X, и Y и использование алгоритма NATUS является точным методом обнаружения аутосомных анеуплоидий, аномалий половых хромосом и триплоидии у плода с 9 недель беременности, который может быть рекомендован всем беременным в качестве высокоэффективного пренатального скрининга.



