Внутриутробные инфекции (ВУИ) остаются одними из наиболее серьезных заболеваний плода и новорожденного. В связи с увеличением числа новорожденных с экстремально низкой (ЭНМТ) и очень низкой массой тела при рождении (ОНМТ) инфекция у данного контингента пациентов остается одной из главных причин заболеваемости и смертности. По данным Национального института здоровья детей и Общества исследования неонатального развития (США) возникновение инфекции в первые трое суток коррелировало с весом при рождении и гестационным возрастом [1].
В результате исследования 9500 родов K. Seo и соавт. подтвердили связь между наличием хориоамнионита, эндометрита, неонатальной инфекции и недоношенности [2]. Данные наблюдения предполагают, что субклиническое течение инфекции приводит к преждевременным родам, а клинические проявления инфекционного процесса проявляются после рождения. Ряд исследователей связывает более частое развитие врожденной инфекции у недоношенных новорожденных с незрелостью иммунного ответа [3, 4]. ВУИ также могут быть обусловлены наличием специфической флоры в родовых путях матери [5–7]. Согласно современным представлениям, хроническая персистирующая инфекция в организме матери способствует постоянному поддержанию высокого уровня врожденных факторов иммунной защиты в активном состоянии [7, 8] посредством воздействия на Толл-рецепторный аппарат клеток. Результатом активации рецепторов является запуск цитокинового каскада и реализация воспалительного ответа [9, 10]. Учитывая продолжающийся рост частоты ВУИ у новорожденных с ЭНМТ и ОНМТ, необходимость прогнозирования и совершенствование диагностики данной патологии, актуальным является поиск точных диагностических маркеров как у беременной, так и у новорожденного в первые часы жизни.
Цель исследования: разработка критериев диагностики ВУИ у новорожденных с ЭНМТ и ОНМТ на основании комплексного клинико-иммунологического обследования беременных.
Материал и методы исследования
Было проведено проспективное исследование 108 пар мать – новорожденный, выполненное в акушерском обсервационном отделении ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Все пациентки были ознакомлены с целью и методами, дали письменное согласие на их включение в научное исследование. Критерии включения: преждевременные роды на сроке гестации от 23 до 32 недель. Критерии исключения: многоплодная беременность, тяжелая экстрагенитальная патология, пороки развития плода.
Все пациентки, вошедшие в исследование, были осмотрены акушером-гинекологом и сдали венозную кровь и мазок отделяемого заднего свода влагалища на 17–19-й неделе гестации. В I группу были включены 52 пациентки с ВУИ у новорожденных, развившейся в раннем неонатальном периоде и подтвержденной при клинико-лабораторном обследовании, во II – 56 пациенток без реализации ВУИ у новорожденного.
У всех беременных и новорожденных было проведено микробиологическое исследование (отделяемого влагалища у матери, отделяемого носоглотки и ануса у ребенка). Определение содержания цитокинов (интерлейкина (ИЛ)-1β, ИЛ-6, ИЛ-8, ИЛ-10, фактора некроза опухоли (ФНО)-α) в сыворотке крови и отделяемом заднего свода влагалища беременных, белков острой фазы (С-реактивный белок (СРБ), прокальцитонин (ПКТ)) в венозной крови беременных до начала регулярной родовой деятельности и новорожденных на 3-и сутки жизни проводили методом твердофазного иммуноферментного анализа (ELIZA) с использованием наборов «Cytimmune» (CША). Оценку оптической плотности осуществляли на фотометре «Microplate reader Model 550» («Bio Rad», США) при длине волны 495 нм. Для забора отделяемого заднего свода влагалища применяли стандартную схему. Среднее количество отделяемого составило 50 мкг. Количество цитокинов рассчитывалось на 1 г белка в отделяемом заднего свода влагалища. Определение белка в смыве проводили с помощью бицинхонинового метода по Лоури.
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 (Abramson, J.H. WINPEPI (PEPI-for-Windows): computer programs for epidemiologists. Epidemiologic Perspectives & Innovations 2004, 1:6). Для определения статистической значимости различий применялись точный двухсторонний критерий Фишера и U-тест Манна–Уитни для несвязанных совокупностей. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты исследования
Возраст беременных, включенных в исследование, колебался от 24 до 41 года и составил в среднем 35,4±0,5 и 31,4±0,5 года соответственно по группам. Анализ структуры экстрагенитальной патологии показал, что у пациенток с ВУИ достоверно чаще отмечались хронические заболевания ЛОР-органов (30,6%), хронический пиелонефрит (24,5%) и цистит (31,2%), (p<0,05). В I группе достоверно чаще встречались хроническое носительство вируса простого герпеса (46,2 и 33,3%), кандидозный и неспецифический вульвовагинит (42,3 и 33,3%), уреаплазма (38,5%) (p<0,05). При изучении структуры гинекологической заболеваемости в I группе достоверно чаще встречался хронический эндометрит (23,0%) (p<0,05). В результате анализа акушерского анамнеза выявлено: в I группе достоверно чаще встречались самопроизвольные выкидыши (19,2%) и бесплодие (26,9%) (p<0,05), во II группе – антенатальная гибель плода (8,3%) (p<0,05). При проведении анализа акушерских и перинатальных исходов у пациенток I группы отмечались такие проявления, как неспецифический вульвовагинит (23,0%), истмико-цервикальная недостаточность (23%) и многоводие (19,4%) (p<0,05). В 75% случаев пациентки были родоразрешены путем операции кесарева сечения по экстренным показаниям. Более чем в половине случаев кесарево сечение выполнялось в связи с ухудшением состояния плода и нарастанием тяжести хронической гипоксии плода. При этом у 42,5% пациенток I группы отмечался преждевременный разрыв плодных оболочек (р<0,05). В I группе средний гестационный срок, на котором пациентка была родоразрешена, составил 30,6 недели, во II группе – 31,4 недели. Послеродовый период у пациенток I группы в 23,1% осложнился субинволюцией матки (p<0,05).
Обследованы 108 новорожденных: 62 мальчика (57,4%), 46 девочек (42,6%), из них 36 (33,3%) детей с ЭНМТ и 72 (66,7%) ребенка с ОНМТ. У всех детей отмечали дыхательные нарушения, потребовавшие проведения респираторной терапии. Анализ структуры ВУИ в I группе показал превалирование таких тяжелых форм, как врожденная пневмония (62,0%) и сепсис (в 18,0% случаев). Данные оценки состояния новорожденных по группам представлены в таблице.
При оценке микробиологического исследования отделяемого заднего свода влагалища в I группе обнаружено превалирование E. coli (32,7%), тогда как во II группе в 50% случаев – Lactobacillus spp., Enterococcus faecalis определялся у женщин в обеих группах, и занял второе место в структуре выявленных микроорганизмов среди обследованных беременных (30,8 и 14,3% соответственно). Однако достоверных различий при анализе видового состава в обследованном локусе между группами получено не было (р>0,05).
При анализе результатов микробиологического исследования отделяемого зева у новорожденных отмечалось достоверно не значимое превалирование стафилококков, так в I группе в 3,8% случаев выявлялся Staphylocccus hominis, в 7,7% Staphylocccus haemolyticus, во II группе в 3,8% – Staphylocccus epidermidis. Интерес представляет выявление в обеих группах новорожденных практически равного количества случаев роста E. coli (3,8 и 2,8% соответственно), тогда как Enterococcus faecalis в 7,7% случаев обнаружен только у новорожденных I группы. Данные представлены на рис. 1 (см. на вклейке). Учитывая неоднозначность полученных результатов при оценке видового состава микрофлоры влагалища матери и зева новорожденного, был проведен корреляционный анализ, в результате которого взаимосвязь между показателями в группах не была установлена.
Таким образом, особый интерес представляло изучение факторов врожденного иммунитета на системном и локальном уровнях для разработки критериев прогнозирования и ранней диагностики ВУИ среди глубоко-недоношенных новорожденных. Было проведено количественное определение уровня про- и противовоспалительных цитокинов в сыворотке крови беременной и локально в отделяемом заднего свода влагалища, белков острой фазы в сыворотке крови беременной и новорожденного на 3-и сутки жизни. Получены данные о достоверном увеличении уровня ИЛ-8 (19,78 пг/мл, p=0,022) и ИЛ-6 (42,99 пг/мл, p=0,038) в сыворотке крови беременных, родивших детей с последующей реализацией ВУИ.
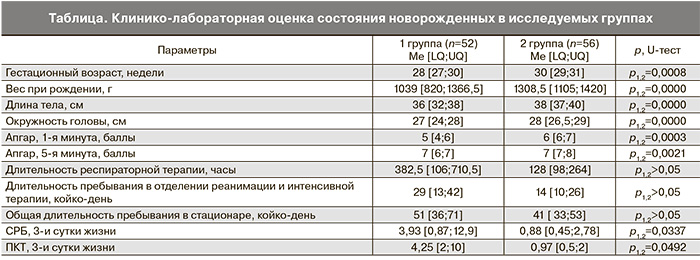
При количественной оценке уровня про и противовоспалительных цитокинов в отделяемом заднего свода влагалища было выявлено достоверное увеличение уровня ИЛ– 6 (92,37 мкг/г) и ИЛ-1β (159,55 мкг/г) у беременных I группы (р<0,05) (рис. 2).
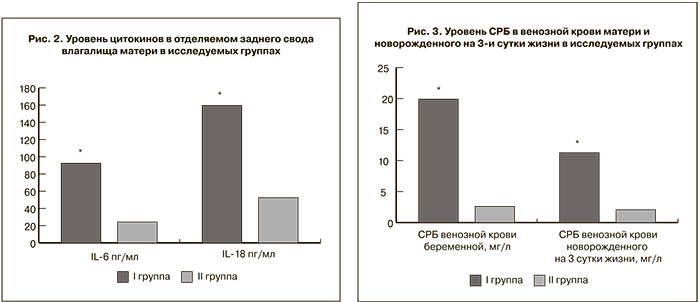
При анализе результатов исследования уровня белков острой фазы в сыворотке крови беременных было выявлено достоверное увеличение уровня СРБ в I группе, составившее 19,9 мг/мл (р=0,018), тогда как во II группе он не превышал возрастную норму (2,6 мг/л) (рис. 3).
При оценке результатов исследования белков острой фазы в сыворотке крови новорожденных, проводившееся на 3-и сутки жизни, выявлено достоверное увеличение в I группе уровня СРБ (11,3 мг/л, р=0,0057) и ПКТ (14,3 нг/мл, р=0,0004). Во II группе уровни СРБ (2,1 мг/л) и ПКТ (1,5 нг/мл) не превышали возрастную норму (5 мг/л и 2 нг/мл соответственно) [11].
Обсуждение
Внутриутробными инфекциями принято называть те инфекционные заболевания, при которых инфицирование плода произошло в анте- или интранатальный период. В ряде стран не существует понятия ВУИ, а используется термин «врожденная инфекция». В Российской Федерации диагностика врожденной инфекции и уточнение диагноза проводится в течение первых 72 часов жизни новорожденных, свидетельствуя о наличии воспалительного процесса, развившегося как антенатально, так и интранатально.
К факторам риска развития ВУИ у пациенток с преждевременными родами принято относить: хронические заболевания ЛОР-органов и мочевыделительной системы (хронический пиелонефрит и цистит), хронический эндометрит и самопроизвольные выкидыши в анамнезе, истмико-цервикальную недостаточность и многоводие во время данной беременности. Ряд авторов также выделяют такие факторы риска ВУИ, как отягощенный акушерско-гинекологический анамнез, патологическое течение беременности, заболевания мочеполовой системы у матери, инфекционные заболевания любых других органов и систем у матери [12–14].
По мнению большинства исследователей, в период беременности на первый план выходит не моно-, а смешанная инфекция. Зачастую она протекает в субклинической форме, что затрудняет ее своевременное выявление. Однако C. Bose и соавт. (2009) указывают на отсутствие корреляции между воспалительными заболеваниями матери и развитием ВУИ [15]. В результате углубленного микробиологического обследования беременных и их новорожденных детей не было получено корреляционной связи между микробным составом биотопа влагалища и отделяемым локусов ребенка с реализацией ВУИ. Это может быть связано как с необходимостью более детального отбора пациенток группы риска и проведением среди них углубленного диагностического поиска, так и с другой этиологией ВУИ у глубоко недоношенных детей. У детей с ЭНМТ при рождении важную роль в развитии воспаления играют незрелость функций фагоцитов и иммунного ответа. Глубоко выраженные метаболические изменения также повышают риск развития сепсиса и тяжелых заболеваний.
У беременных при ВУИ наблюдается активация механизмов врожденной иммунной системы как на локальном, так и на системном уровнях. При количественной оценке уровня цитокинов: на системном уровне отмечали увеличение таких провоспалительных цитокинов, как ИЛ-6 и ИЛ-8, а при оценке данного параметра на локальном уровне – ИЛ-1β и ИЛ-6.
ИЛ-6 продуцируется различными типами клеток, включая мононуклеарные фагоциты, лимфоциты и фибробласты. Он участвует в активации Т и В-лимфоцитов, гемопоэза, синтеза острофазовых белков, процессов коагуляции [16, 17]. По данным ряда авторов определение повышенного уровня ИЛ-6 в отделяемом цервикального канала сопровождается хориоамнионитом, хронической внутриутробной гипоксией плода, отслойкой плаценты, преждевременными родами [18–20]. ИЛ-1 синтезируется преимущественно моноцитами и макрофагами в двух формах: ИЛ-1α и ИЛ-1β. Он имеет схожие биологические эффекты с ФНО-α, вызывая активацию лейкоцитов и эндотелиальных клеток, комплемента, синтез белков острой фазы [21]. В экспериментальной модели эндотоксинемии ИЛ-1 достигает пика концентрации в крови через 4 часа. ИЛ-1β был признан наилучшим прогностическим критерием хориоамнионита [22, 23]. ИЛ-8 обладает выраженными провоспалительными свойствами, вызывая экспрессию молекул межклеточной адгезии, что свидетельствует о его важной роли в предикции воспалительного ответа. ИЛ-8 вызывает хемотаксис и активацию нейтрофилов, что способствует дальнейшей выработке цитокинов и повышению сократительной способности матки.
В нашей работе была выявлена зависимость реализации ВУИ у новорожденных детей от наличия высокого содержания ИЛ-6, ИЛ-8 и СРБ в крови беременной и ИЛ-6 и ИЛ-1β в отделяемом заднего свода влагалища. Уникальность данных ИЛ заключается в том, что, будучи одними из самых ранних медиаторов воспаления, эти цитокины длительное время продуцируются в очаге воспаления [24]. Существует взаимосвязь повышенной концентрации ИЛ-8 в амниотической жидкости и лейкоцитарной инфильтрации амниотических оболочек при преждевременных и срочных родах. Почти у 50% обследованных беременных женщин с преждевременными родами обнаружено повышенное содержание ИЛ-8, ИЛ-1 и ИЛ-6 в амниотической жидкости [25]. По данным литературы определение содержания ИЛ-8, ПКТ и СРБ в сыворотке крови рассматривают как критерии системного воспалительного ответа при раннем неонатальном сепсисе [26], что согласовывается с данными, полученными в результате нашего исследования. Уровень СРБ и ПКТ в группе новорожденных с реализацией ВУИ был достоверно выше, чем в группе без реализации ВУИ.
Полученные данные позволяют использовать скрининг беременных, входящих в группу высокого риска реализации ВУИ, так и среди их новорожденных детей. Принципиальной особенностью данного метода является возможность ранней (дородовой) диагностики, что позволяет вовремя провести профилактические мероприятия. Также немаловажно, что исследование крови и отделяемого заднего свода влагалища матери является неинвазивной процедурой для плода. Выше изложенное определяет диагностическую значимость определения иммунологических маркеров воспаления для снижения риска инфекционных осложнений у новорожденных.



