Самопроизвольный выкидыш – наиболее частое акушерское осложнение, возникающее на ранних сроках беременности. Причины спорадического самопроизвольного выкидыша чрезвычайно разнообразны и не всегда четко обозначены. Действие повреждающих факторов носит преходящий характер, не нарушая репродуктивную функцию женщины в будущем. Вместе с тем, в группе женщин, потерявших первую беременность, существует категория пациенток (2–5%), в последующем развивающих симптомокомплекс привычного выкидыша. Актуальность предотвращения привычных потерь беременности обусловлена не только возрастающим риском выкидышей при увеличении числа неудач, но и воздействием осложненного течения беременности на ранних сроках на перинатальные исходы. Так, было установлено, что женщины с привычным выкидышем в анамнезе составляют группу риска по реализации плацентарной недостаточности, ранних преждевременных родов, задержки роста плода, излития околоплодных вод при недоношенном сроке беременности, отслойкам плаценты во втором и третьем триместрах беременности. Результаты проведенного мета-анализа, обобщившего данные за 28 лет, убедительно показали, что пациентки с привычным выкидышем демонстрируют худшие перинатальные исходы по сравнению с общепопуляционными данными.
При исключении общеизвестных этиологических факторов привычных потерь беременности (генетических, анатомических, гормональных, инфекционных, аутоиммунных) остается категория супружеских пар с привычным выкидышем неясного генеза (идиопатическим привычным выкидышем). В настоящее время на основании многочисленных исследований в области иммунологии репродукции стало очевидно, что в развитии идиопатического привычного выкидыша ключевую роль играют аллоиммунные нарушения.
Установлено, что вероятность иммунологических нарушений в генезе привычного выкидыша увеличивается при многократных потерях беременностей [1]. Множество исследований было проведено с целью определения иммунологических маркеров, свидетельствующих о качестве ответа иммунной системы матери на антигены эмбриона отцовского происхождения [2].
Одним из направлений поиска иммунологических критериев прогноза развития беременности является оценка клеточных субпопуляций периферической крови [3]. Основное внимание привлекают маркеры цитотоксической функции клеток. Клетки с естественной киллерной активностью (НК-клетки) и фенотипом CD56+, CD16+, CD3-CD56,16+, CD3-CD8+ являются клетками врожденного иммунитета. Цитотоксические клетки, появляющиеся в эффекторной фазе иммунного ответа и имеющие фенотип CD3+CD8+ и CD3+CD56,16+, относят к клеткам адаптивного иммунитета.
Предполагается, что в генезе привычного выкидыша большую роль играет нарушение взаимодействий НК-клеток (CD56+, CD16+) и клеток адаптивного иммунитета. Однако, несмотря на довольно продолжительный период изучения НК-клеток периферической крови в генезе привычного выкидыша, значимость их оценки для прогноза ранней беременности остается невыясненной [4].
В основе реализации механизмов толерантности рассматривалось участие различных типов клеток, однако ведущая роль, по всей видимости, принадлежит Т-клеткам с фенотипом CD4+CD25+ и внутриклеточной экспрессией фактора Foхр3+ – Т-регуляторным клеткам (Трег) [5, 6]. Многие авторы дефицит именно Трег-клеток связывают с развитием привычного выкидыша [7].
Считается, что в формировании адекватного ответа иммунной системы матери на антигены плода отцовского происхождения важная роль принадлежит толерогенной молекуле СD200. В результате взаимодействия CD200 с рецепторами как дендритных клеток, так и НК-клеток в них индуцируется секреция индоламиндиоксигеназы, и они приобретают способность посредством продукции трансформирующего фактора роста-b (ТФР-b) стимулировать генерацию Т-регуляторных клеток и, соответственно, индуцировать формирование специфической периферической толерантности [8–11].
В последнее время в иммунологии репродукции активно исследуются механизмы функционирования естественных Трег-клеток. В качестве основы иммунорегуляции беременности рассматривают уже не парадигму Th1/Th2-ответа (Т-хелперов 1-го и 2-го классов), а парадигму Th1/Th2/Th17/Tрег-клеток [12].
Однако до сих пор особенности фенотипа лимфоцитов периферической крови у женщин с привычным выкидышем неясного генеза остаются неизученными, отсутствуют данные о маркерах формирования толерантности в раннем гестационном периоде. В качестве иммунологических маркеров генеза привычного выкидыша рассматривались субпопуляции лимфоцитов с различным фенотипом, но сравнение диагностической значимости их определения при привычным выкидыше не проводилось.
Целью настоящей работы стало изучение и сравнение чувствительности и специфичности тестов фенотипирования лимфоцитов периферической крови женщин с привычным выкидышем.
Материал и методы исследования
Группу исследования составили 70 женщин с двумя и более ранними потерями беременности в анамнезе, произошедшими в первом триместре.
В контрольной группе было обследовано вне беременности 15 фертильных женщин без соматических заболеваний с неотягощенным акушерским анамнезом в возрасте от 25 до 38 лет, имеющих последнего ребенка не старше 2 лет.
Отбор пациенток в основную группу проводился вне беременности на стадии предгестационного обследования и подготовки. Всего полное клинико-лабораторное обследование прошли 320 супружеских пар по схеме, разработанной и принятой в отделении профилактики и терапии невынашивания беременности для пар с привычным выкидышем.
Обследование включало: кариотипирование супругов, HLA-типирование, исследование полиморфизмов генов ферментов фолатного цикла и тромбофилий, исключение анатомических причин привычного выкидыша (ультразвуковое исследование органов малого таза в I и во II фазу цикла, гистероскопия по показаниям, соногистерография, гистеросальпингография), диагностика антифосфолипидного синдрома (проба на волчаночный антикоагулянт (ВА), антитела к β2-гликопротеину, аннексину, протромбину, фосфатидилсерину и кардиолипину), гормональное обследование, гемостазиологическое обследование, бактериологическое обследование (количественная полимеразная цепная реакция – «фемофлор 16», «фемофлор комплекс», микроскопия вагинального отделяемого), исследование спермограммы партнера.
По результатам проведенного обследования было установлено, что сбалансированные хромосомные перестройки родителей были причиной привычного выкидыша в 3,6% случаев, тромбофилии высокого риска – в 6,3%, анатомические факторы (пороки развития матки, синехии, субмукозные узлы миомы матки, полипы эндометрия) – в 14,4% случаев. Гормональные нарушения (гиперпролактинемия, поликистозные яичники, недостаточность лютеиновой фазы, сахарный диабет, гипотиреоз) послужили причиной привычных потерь беременностей в 20,0% наблюдений, антифосфолипидный синдром диагностирован в 19,7% случаев, из них в 3,8% – вторичный, на фоне системных заболеваний соединительной ткани. У 15 пациенток (4,7%) диагностирована тяжелая экстрагенитальная патология (хронические заболевания печени, почек, артериальная гипертония), в 10 случаях (3,1%) определен мужской фактор привычных выкидышей и в 20 наблюдениях (6,3%) диагностированы воспалительные заболевания органов малого таза – сальпингит, сактосальпингс, оофорит, тубоовариальное образование, потребовавшие как консервативного, так и хирургического лечения.
После исключения вышеуказанных причин в группу исследования отобраны 70 супружеских пар с привычным выкидышем, у которых генез потерь беременности оставался неясным и, по-видимому, был обусловлен аллоиммунными причинами. Супружеские пары с аллоиммунным генезом привычных выкидышей составили 21,9% всех пар с привычными потерями беременностей.
Таким образом, критериями включения в группу исследования были: подписание формы информированного согласия на участие в исследовании, наличие не менее 2 выкидышей ранних сроков от одного и того же партнера (если в каждом случае был подтвержден нормальный кариотип абортуса), возраст женщины от 20 до 40 лет, нормальный кариотип партнеров, нормозооспермия партнера, самопроизвольное наступление беременностей, отсутствие анатомических, генетически обусловленных, аутоиммунных, гормональных нарушений, тяжелых экстрагенитальных заболеваний.
Критериями включения в контрольную группу были: подписанная форма информированного согласия на проведение исследования, наличие как минимум одних родов в анамнезе от данного партнера, возраст женщины от 20 до 40 лет, неотягощенный акушерский и гинекологический анамнез, отсутствие гормональных нарушений, сопровождающихся изменениями менструального цикла, нормальный кариотип партнеров, нормозооспермия.
В связи с наличием ультразвуковых признаков хронических воспалительных заболеваний органов малого таза (хронический эндометрит) и выявленными изменениями по данным кольпоскопии и изучения влагалищного биотопа (хронический цервицит, вульвовагинит, хламидийная инфекция, выраженный дисбиоз влагалища) противовоспалительная терапия была проведена 40 супружеским парам (57,1%) с привычным выкидышем препаратами с антианаэробной активностью (метронидазол, орнидазол) и при наличии показаний – антибактериальными препаратами широкого спектра действия (фторхинолоны).
После проведения противовоспалительной терапии взяты контрольные анализы: все показатели в пределах нормы. Через 2–3 месяца после проведенного лечения у пациенток исследовали иммунный статус лимфоцитов периферической крови. Кровь для анализа забирали натощак из локтевой вены на 18–22-й день менструального цикла.
Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител (мАт), меченных флуоресцеин-изотиоцианатом (ФИТЦ) или фикоэритрином, против антигенов CD3, CD4, CD5, CD8, CD16, CD19, CD16, CD56, CD200 (Becton Dickinson и eBioscience, США). Оценивали содержание основных субпопуляций иммунокомпетентных T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56+, СD16+), а также содержание Трег (СD4+CD25highCD127low/-). Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45, меченных перидинин-хлорофилл протеином (Per-CP), (Dako, Дания). Для оценки процентного содержания Трег использовали набор, содержащий моноклональные антитела к антигенам CD4, меченые Per-CP (eBioscience, США), CD25, меченые ФИТЦ (Becton Dickinson, США) и СD127, меченые фикоэритрином (eBioscience, США). Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США).

Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее±ошибка среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием статистического пакета MedCalc12 для Windows 7. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007.
Для оценки диагностической значимости тестов фенотипирования лимфоцитов периферической крови женщин с привычным беременности выкидышем использовали ROC-анализ пакета MedCalc12 для Windows 7.
Результаты исследования
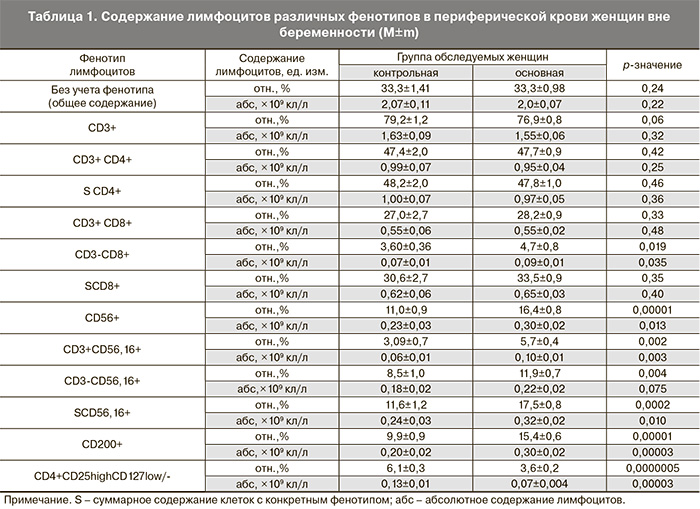
Результаты фенотипирования лимфоцитов периферической крови женщин с привычным выкидышем представлены в табл. 1.
Абсолютное и относительное содержание основных субпопуляций лимфоцитов с фенотипом СD3+, CD4+, CD8+ в периферической крови женщин с привычным выкидышем не отличается от содержания лимфоцитов с таким же фенотипом женщин контрольной группы, что позволяет положительно оценивать последствия проведенного лечения сопутствующих хронических воспалительных заболеваний у обследованных пациенток с привычным выкидышем. Однако содержание субпопуляций клеток врожденного иммунитета с естественной киллерной активностью и фенотипом CD56+, фенотипом CD56+,16+ фенотипом CD3-CD56,16+, достоверно превышает аналогичный показатель у женщин контрольной группы. Также достоверно выше, чем в контроле, содержание субпопуляции клеток адаптивного иммунитета с цитотоксической функцией CD3+CD56,16+.
В то же время существенно ниже, чем в контроле было содержание Трег-клеток у женщин с привычным выкидышем, а клеток с фенотипом CD200+ – достоверно выше, чем у фертильных женщин. При этом соотношение клеток с фенотипом CD200+ и клеток с фенотипом CD4+CD25highCD127low- было значимо выше у женщин с привычным выкидышем по сравнению с контролем (4,70±2,71 и 1,80±0,33, соответственно, р=0,00000003).
Для субпопуляций лимфоцитов периферической крови женщин с привычным выкидышем, содержание которых значимо отличается от содержания субпопуляций лимфоцитов крови контрольной группы женщин, проведена оценка диагностической значимости тестов, представленная в табл. 2.
Известно, что чувствительность теста – это вероятность того, что тест будет положительным, если пациент действительно болен, а специфичность теста – вероятность того, что тест будет отрицательным, если пациент здоров. Идеальный тест обладает 100% чувствительностью и 100% специфичностью. В данной работе показано, что лучшими характеристиками диагностической значимости с высокой чувствительностью и специфичностью обладает тест определения в периферической крови и относительного и абсолютного содержания Трег-клеток, а также соотношения относительного содержания клеток с фенотипом CD200+ и CD4+CD25highCD127low-.
Обсуждение
Считается, что реакции материнской иммунной системы, направленные против фетальных тканей, обусловлены нарушением формирования толерантности к аллоантигенам плода [13]. Однако исследования фундаментальных механизмов развития толерантности и поиски факторов, способствующих нарушениям этого процесса, по-прежнему актуальны [3, 14].
В основе реализации механизмов толерантности к антигенам плода отцовского происхождения рассматривалось участие различных типов клеток. Так, выявленное в нашем исследовании преобладание среди лимфоцитов периферической крови пациенток с привычным выкидышем субпопуляций клеток с киллерной активностью согласуется с данными, полученными другими авторами и является отражением тенденции к провоспалительному ответу, которое, по-видимому, способствует наступлению беременности, но не ее прогрессированию [4, 15–17].
Однако ведущая роль в формировании толерантности, по всей видимости, принадлежит Т-клеткам с фенотипом CD4+CD25+ и внутриклеточной экспрессией фактора Foхр3+ – Трег-клеткам [18, 19]. Это уникальная субпопуляция клеток, обладающих специфической супрессорной активностью. Трег-клетки играют критическую роль в периферической толерантности, в подавлении аутоиммунитета и реакции отторжения трансплантанта [15, 16].
Показано, что во время беременности увеличивается доля Tрег-клеток среди CD4+-клеток периферической крови и децидуальной оболочки матки в течение раннего периода и во втором триместре и уменьшается в послеродовом периоде [20, 21].
Многие авторы дефицит Трег-клеток связывают с развитием привычного выкидыша [7]. Согласно полученным нами результатам, уже вне беременности в дни предполагаемой, потенциально возможной имплантации у женщин с привычным выкидышем существует достоверно значимый низкий уровень Трег-клеток по отношению к фертильным женщинам. Этот результат позволяет предположить нарушение процесса толерантности, которое может быть диагностировано вне беременности с последующей возможностью коррекции. В свете последних данных по исследованию роли естественных регуляторных клеток высказано мнение, что иммунотерапия привычного выкидыша, скорее, должна иметь целью не иммуносупрессию, а повышение толерантности [7]. Полученные нами данные о низком содержании Трег-клеток у женщин с привычным выкидышем позволяют согласиться с высказанным мнением.
Более высокие значения чувствительности и специфичности теста определения Трег-клеток по сравнению с тестами определения содержания клеток с киллерной активностью у пациенток с привычным выкидышем также косвенно подтверждают последнее предположение. Как упоминалось выше, существует функциональная связь между экспрессией толерогенной молекулы CD200 и индукцией Трег, опосредованная натуральными киллерами и/или дендритными клетками [8–10]. Высокая специфичность и чувствительность теста оценки соотношения относительного содержания клеток с фенотипом CD200+ и CD4+CD25highCD127low- также позволяет предположить наличие связи этих параметров с патогенезом привычного выкидыша.
Возможно, дальнейшие исследования клеток с фенотипом CD200+ и CD4+CD25highCD127low-, а также их соотношения при динамическом наблюдении пациенток с привычным выкидышем в течение первого триместра беременности и на фоне проведения иммунотерапии будут перспективными для поиска маркеров эффективности иммунокоррекции при лечении привычного выкидыша.
Заключение
Супружеские пары с привычными потерями аллоиммунного генеза составляют 21,9% всех пациентов с привычным выкидышем. Для пациенток с привычным выкидышем аллоиммунного генеза вне беременности характерны достоверные изменения субпопуляций лимфоцитов киллерных клеток с различным фенотипом, содержания естественных Трег-клеток и лимфоцитов с фенотипом CD200+ по сравнению с фертильными женщинами. Тесты определения содержания Трег и соотношения субпопуляций клеток с фенотипом CD200+ и Трег обладают самой высокой специфичностью (92,9%) и чувствительностью (86,6 и 90,9% соответственно). Для выяснения возможности использования данных тестов в контроле за эффективностью проводимой иммунотерапии требуются дальнейшие исследования.



