Petrov National Medical Research Center of Oncology of Minzdrav of Russia, St. Petersburg, Russia
Aim. To investigate the effectiveness of the ICG fluorescence technique in the detection of sentinel lymph nodes (SLN) in patients with endometrial cancer (EC).
Materials and methods. The study comprised 100 patients with morphologically and clinically verified stage T1a-1bNxM0 EC, who were managed at the Petrov National Medical Research Center of Oncology of Minzdrav of Russia from September 2015 to September 2017.
Results. The use of ICG resulted in the detection of 220 SLNs in the whole study cohort (n = 100). Ninety (90%) patients were found to have bilateral SLNs. In 9/100 (9%), staining was detected only on one side. Only in one case, no SLNs were identified. The sensitivity, specificity, and accuracy of the method were 100%, 93%, and 93%, respectively. Numerous studies confirm the fact that in patients with EC, intraoperative detection, biopsy and morphological examination of SLNs contribute to a better assessment of regional lymphatic collectors, more accurate staging of the disease, and a patient-tailored surgery, which in turn can increase the overall survival of patients with EC.
Conclusion. The use of the ICG fluorescence technique for the detection of SLNs in patients with EC allows effective and safe staging of the disease.
corpus uteri cancer
sentinel lymph node
ICG
fluorescence
Рак эндометрия (РЭ) находится на 1-м месте в структуре онкогинекологических заболеваний в мире. Стадирование заболевания до настоящего времени остается главным предиктором к рациональной лечебной тактике. Существует несколько методик оценки состояния регионарных лимфатических узлов (ЛУ) при РЭ до операции.
Магнитно-резонансная томография (МРТ) становится все более доступным методом лучевой диагностики. Однако из-за относительно низкой чувствительности лучевых методов патоморфологическая оценка остается наиболее точной для выявления метастазов в лимфатических коллекторах. Особенно важной является возможность непосредственной визуализации и оценки состояния ЛУ в ходе хирургического вмешательства с целью выявления лимфогенного метастазирования [1, 2]. Однако профилактическая лимфаденэктомия себя не оправдала, поскольку данная методика показала улучшение выживаемости только в группах пациентов, у которых были выявлены метастатически измененные ЛУ [3, 4]. Более чем у 80% пациенток с РЭ с выполненной лимфаденэктомией метастатическое поражение ЛУ при гистологическом исследовании не подтверждается, из чего следует, что этим пациенткам объем хирургического вмешательства расширялся неоправданно. Таким образом, сохраняется необходимость в менее инвазивном и более точном методе стадирования.
Исходя из вышеизложенного, концепция выявления сигнальных лимфатических узлов (СЛУ) приобретает широкое признание, используется при многих локализациях злокачественных опухолей и входит в стандарты хирургического лечения [5, 6]. В наши дни биопсия СЛУ является одним из базовых методов выявления пораженных регионарных ЛУ и рекомендуется NCCN, ESMO в качестве стандартного метода при определении стадии РЭ.
Цель исследования – оценить эффективность флуоресцентного метода с использованием ICG в детекции СЛУ у больных РЭ.
Материалы и методы
В исследование вошли 100 больных морфологически верифицированным РЭ с клинически установленными стадиями Т1a-1bNxМ0, проходивших лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России с сентября 2015 г. по сентябрь 2017 г. (табл. 1).

Вся выборка пациенток была разделена на 3 группы относительно риска метастазирования первичной опухоли в регионарные ЛУ: высокий, промежуточный и низкий – по рекомендациям Европейского общества онкогинекологов (ESGO,2017). В группу высокого риска вошли пациентки с агрессивным гистологическим типом опухоли (серозная и светлоклеточная карциномы), аденокарцинома с низкой дифференцировкой опухоли, большими размерами и глубокой инвазией опухоли в миометрий. К промежуточному риску отнесли пациенток, у которых наблюдался эндометриоидный тип опухоли с умеренной дифференцировкой, а также расположение опухоли в верхней трети полости матки и глубокая инвазия в миометрий. Пациентки, входящие в группу низкого риска, имели высокую или умеренную дифференцировку опухоли с поверхностной инвазией в миометрий
Результаты
 В исследовании у 100 больных РЭ были установлены 220 СЛУ. У 99/100 (99%) пациенток, вошедших в исследование, произошло окрашивание СЛУ красителем ICG. У каждой пациентки определяли от 1 до 3 СЛУ, среднее количество 2,2. Билатерально окрасились ICG ЛУ у 90/100 (90%) пациенток. У 9/100 (9%) окрашивание отмечено только с одной стороны (табл. 2). В одном случае СЛУ не был выявлен.
В исследовании у 100 больных РЭ были установлены 220 СЛУ. У 99/100 (99%) пациенток, вошедших в исследование, произошло окрашивание СЛУ красителем ICG. У каждой пациентки определяли от 1 до 3 СЛУ, среднее количество 2,2. Билатерально окрасились ICG ЛУ у 90/100 (90%) пациенток. У 9/100 (9%) окрашивание отмечено только с одной стороны (табл. 2). В одном случае СЛУ не был выявлен.
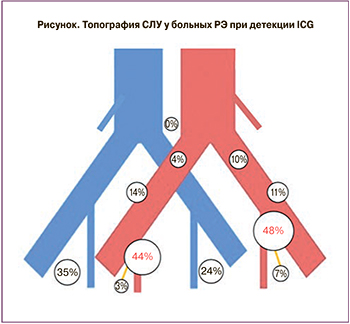
Наиболее часто СЛУ у пациенток располагались в области бифуркации наружной и внутренней подвздошной артерии: 101/220 (46%) (рис. 1, табл. 3).
По результатам интраоперационного и послеоперационного гистологических исследований в 11/99 (11%) случаях были выявлены метастазы в СЛУ у пациенток РЭ (табл. 4). При этом все случаи обнаружения метастатического поражения СЛУ при срочном интраоперационном исследовании были подтверждены при окончательном послеоперационном исследовании.
Важно отметить, что при послеоперационной гистологической оценке СЛУ, расцененного как непораженный по результатам интраоперационной оценки, не было выявлено дополнительно ни одного случая метастатического поражения СЛУ. При отсутствии метастазов в СЛУ в остальных удаленных тазовых ЛУ (неСЛУ) метастазов также не было выявлено. Таким образом, ни одного слу чая ложноположительного или ложноотрицательного результата при сравнении результатов срочной и окончательноой морфологической оценки СЛУ в нашем исследовании не установлено.
Многие источники литературы указывали на то, что в отдельных случаях присутствие опухолевых клеток в лимфатических сосудах, которые несут лимфу от опухоли, может привести к полной блокировке этих сосудов и неудаче в маркировке СЛУ (ложные отрицательные результаты) или к маркировке других ЛУ, кроме сигнальных (ложные положительные результаты).
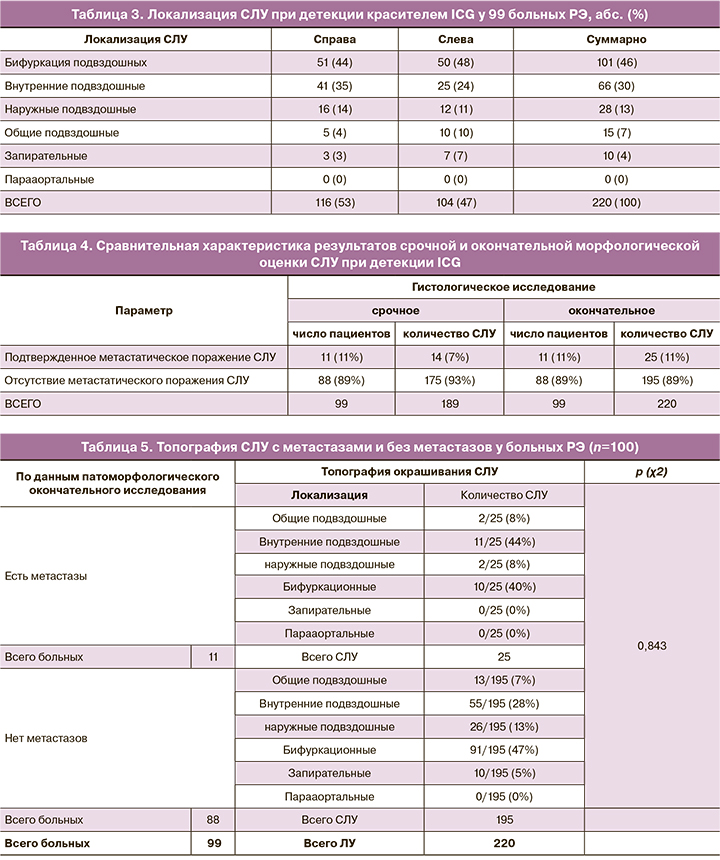
Было изучено, каким образом изменялась топография СЛУ у больных РЭ при поражении СЛУ метастазом опухоли. В настоящем исследовании достоверной разницы в топографии СЛУ в группе пациенток с метастатическим поражением и группе больных без метастазов не обнаружено. Общие подвздошные СЛУ определены в группе с метастазами у 2/25 (8%) против 13/195 (7%) в группе без метастазов, внутренние подвздошные СЛУ определены в группе с метастазами у 11/25 (44%) против 55/195 (28%) в группе без метастазов; наружные подвздошные СЛУ обнаружены в группе с метастазами у 2/25 (8%) против 26/195 (13%) в группе без метастазов; бифуркационные СЛУ определены в группе с метастазами у 10/25 (40%) против 91/195 (47%) в группе без метастазов; запирательные СЛУ обнаружены в группе с метастазами у 0/25 (0%) против 10/195 (5%) в группе без метастазов, р=0,843 (табл. 5).
Важной задачей настоящего исследования стало изучение частоты метастазирования в регионарные ЛУ в выделенных клинических группах риска метастазирования у больных РЭ. Мы проанализировали 11/99 (11%) больных РЭ, у которых были обнаружены метастазы в СЛУ (табл. 6).
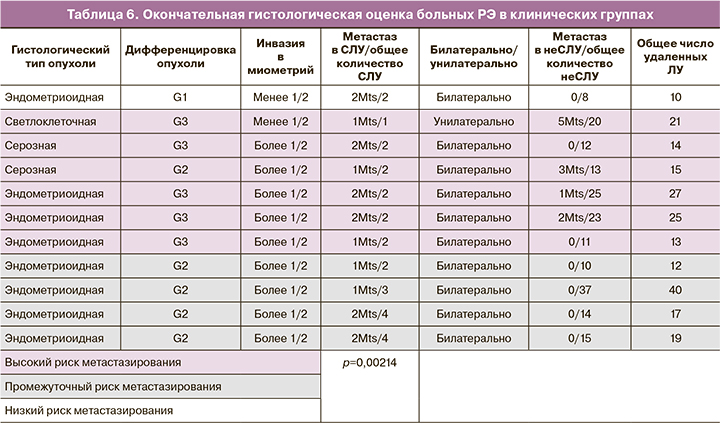
Наличие метастазов в СЛУ у больных РЭ достоверно коррелирует с клиническими группами риска: в группе высокого риска метастаз обнаружен у каждой четвертой пациентки в 6/24 (25%) случаях, в группе промежуточного риска у каждой десятой – в 4/39 (10%), в группе низкого риска – в 1/37 (3%) (р=0,02). Помимо метастазов в СЛУ, были выявлены метастазы в неСЛУ у 4/6 (66%) пациенток – в группе высокого риска. В группах промежуточного и низкого риска у пациенток с пораженными СЛУ метастазов в неСЛУ выявлено не было.
Диагностическую эффективность метода детекции СЛУ при помощи ICG рассчитывали по стандартным критериям: чувствительность, специфичность, точность в соответствии с рекомендациями научной группы ВОЗ (Женева, 1992).
Важно отметить, что при расчете параметров специфичности и точности метода биопсии СЛУ с использованием красителя ICG, а именно частоты ложноположительных случаев, не учитывались некоторые особенности самой методики. Действительно, при обнаружении в СЛУ метастаза (при выполнении срочного гистологического исследования) вероятность поражения неСЛУ высока. Однако сам факт отсутствия метастатического поражения неСЛУ при подтвержденном метастазе в СЛУ расценивается по стандартным критериям как ложный результат. В данной методике этот случай неправильно считать ложным, так как это укладывается в определение СЛУ, и первый «сторожевой» ЛУ может быть поражен изолированно, без распространения по дальнейшему лимфатическому пути метастазирования. В нашем исследовании биопсия СЛУ с использованием красителя ICG является высокоэффективной методикой: чувствительность метода составила 100%, специфичность – 93%, точность – 93%, частота успешного картирования – 99%, частота ложноотрицательных результатов – 0%.
Обсуждение
Детекция СЛУ является на сегодняшний день актуальной проблемой в онкологии. Работы по изучению СЛУ при РЭ малочисленны и разноречивы по результатам различных исследователей, что требует дальнейшего изучения [7]. Индоцианин зеленый благодаря мощному поглощению в ближней ИК-области спектра стал незаменимым красителем для детекции СЛУ. ICG уже много лет используется и разрешен FDA (Food and Drugs Administration) для определения фракции сердечного выброса, функции кровотока паренхиматозных органов (печень, селезенка), но не включен специально для картирования СЛУ в США [8, 9].
В нашем исследовании всем больным непосредственно перед установкой маточного манипулятора в шейку матки вводился ICG (25 мг препарата, разведенного в 10 мл воды для инъекций). Окрашивание происходило достаточно интенсивно, равномерно, без затекания препарата в окружающие ткани, с четкими, границами лимфатических протоков. Оптимальным для диагностики СЛУ является интервал 5±3 мин от начала инъекции красителя. При изучении результатов детекции СЛУ препаратом ICG у 95% больных было выявлено билатеральное окрашивание ЛУ, у 5% больных произошло монолатеральное окрашивание. При изучении топографии наиболее частая локализация СЛУ определялась в области бифуркации общей подвздошной артерии – 46%, в области внутренних подвздошных сосудов – у 28%, в области наружных подвздошных сосудов – у 13% и в запирательном пространстве – в 5%.
Заключение
Применение флуоресцентного метода детекции СЛУ с применением ICG позволяет эффективно и безопасно проводить стадирование заболевания у больных РЭ. В нашем исследовании этот метод позволил выявить СЛУ у 99% (99/100) больных РЭ. Наличие метастазов в СЛУ у больных РЭ достоверно коррелирует с клиническими группами риска: в группе высокого риска метастаз обнаружен у каждой четвертой пациентки, в группе промежуточного риска – у каждой десятой, в группе низкого риска – в 1/37 (3%) случае (р=0,02). При этом достоверной разницы в топографии СЛУ в группе пациенток с метастатическим поражением и группе больных без метастазов не обнаружено.
- Берлев И.В., Ульрих Е.А., Ибрагимов З.Н., и др. Возможности детекции сигнальных лимфатических узлов при раке эндометрия радиоизотопным и флуоресцентным (ICG) методами. Вопросы онкологии. 2017; 2: 304–8. [Berlev I.V., Ulrikh E.A., Ibragimov Z.N. Possibilities of detection of sentinel lymph nodes in endometrial cancer by radioisotope and fluorescent (ICG) methods. Voprosy onkologii.2017; 2: 304–8. (In Russ.)]. eLIBRARY ID: 29114517
- Shepherd E.S., Lowe D.A. Targeted selective trachelo-colpectomy for preservation of fertility in a young woman with vaginal clear cell carcinoma. J Obstet Gynaecol. 2010; 30(4): 420–1. doi: 10.3109/01443611003681428.
- Vidal F., et al. Evaluation of the sentinel lymph node algorithm with blue dye labeling for early- stage endometrial cancer in a multicentric setting. Int. J. Gynecol. Cancer. 2013: 23: 1237–43. doi: 10.1097/IGC.0b013e31829b1b98
- Morton D.L., et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch. Surg. 1992; 127: 392–9. doi: 10.1001/archsurg.1992.01420040034005
- Kadkhodayan S., et al. Lymphatic mapping and sentinel node biopsy in endometrial cancer a feasibility study using cervical injection of radiotracer and blue dye. Nucl Med Rev Cent East Eur. 2014; 17: 55–8. doi: 10.5603/NMR.2014.0017
- Krag D.N., et al. Technical outcomes of sentinel lymph-node resection and conventional axillary- lymph-node dissection in patients with clinically node-negative breast cancer: results from the NSABP B-32 randomised phase III trial. Lancet Oncol. 2007; 8: 881–8. doi: 10.1016/S1470-2045(07)70278-4
- Zavagno G., et al. A randomized clinical trial on sentinel lymph node biopsy versus axillary lymph node dissection in breast cancer: results of the Sentinella. GIVOM trial. Ann. Surg. 2008; 247: 207–10. doi: 10.1097/SLA.0b013e31812e6a73
- Kim C.H., Soslow R.A., Park K.J. Pathologic ultrastaging improves micrometastasis detection in sentinel lymph nodes during endometrial cancer staging. Gynecol Cancer. 2013; 23(5): 964–70. doi: 10.1097/IGC.0000000000000159
- Bosquet G.J., et al. Cytokeratin staining of resected lymph nodes may improve the sensitivity of surgical staging for endometrial cancer. Gynecol. Oncol. 2003; 91: 518–25. doi: 10.1016/j.ygyno.2003.08.026
Received 20.12.2019
Accepted 26.12.2019
Zaur N. Ibragimov, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Pesochny-2, St.-Petersburg,
197758, Russia. Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru; SPIN-код: 1566-1789, AuthorID: 919303.
Nikolay A. Mikaya, Oncologist, PhD, Head of department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47, E-mail:
nmikaya@mail.ru; AuthorID: 383329. Pesochny-2, St.-Petersburg, 197758, Russia.
Yuri N. Trifanov, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Pesochny-2, St.-Petersburg,
197758, Russia. Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru
Tatiana V. Gorodnova, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
t.gorodnova@mail.ru; SPIN-код автора в РИНЦ: 2661-9106; ORCID: 0000-0003-1719-7498. Pesochny-2, St.-Petersburg, 197758, Russia.
Khristina B. Kotiv, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru. Pesochny-2, St.-Petersburg, 197758, Russia.
Maria G. Yakovleva, Resident at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Pesochny-2, St.-Petersburg,
197758, Russia. Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47. E-mail:
mersend@mail.ru; ORCID: 0000-0002-1593-6771
Olga E. Lavrinovich, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47, E-mail:
olgalav1973@mail.ru; SPIN-код: 7239-5933, AuthorID: 854658. Pesochny-2, St.-Petersburg, 197758, Russia.
Nikolay E. Bondarev, ncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru; SPIN-код: 4788-1510, AuthorID: 277962. Pesochny-2, St.-Petersburg, 197758, Russia.
Anna A. Sidoruk, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
sidoruk_ann@mail.ru; SPIN-код: 5191-8792, AuthorID: 203398. Pesochny-2, St.-Petersburg, 197758, Russia.
Olga A. Smirnova, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47.E-mail:
ssmirnova.oa@gmail.com; SPIN-код: 9309-7703; AuthorID: 1019011. Pesochny-2, St.-Petersburg, 197758, Russia.
Konstantin Dz. Guseynov, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru. Pesochny-2, St.-Petersburg, 197758, Russia.
Elena V. Bakhidze, Oncologist, MD, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru; SPIN-код: 5191-8792, AuthorID: 203398. Pesochny-2, St.-Petersburg, 197758, Russia.
Iryna E. Meshkova, Oncologist, PhD, Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47.E-mail:
meshkova.62@bk.ru. Pesochny-2, St.-Petersburg, 197758, Russia.
Elvina K. Bakaeva, Resident at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru. Pesochny-2, St.-Petersburg, 197758, Russia.
Marianna G. Shikhzadaeva, Resident at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21,
Fax: (007)-(812)-596-89-47. E-mail:
oncl@rion.spb.ru. Pesochny-2, St.-Petersburg, 197758, Russia.
Elena A. Ulrikh, M.D., Ph.D., Leading Researcher at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology;
Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Professor at the Department of Oncology of North-Western State Medical University na I.I. Mechnikov,
St.-Petersburg. E-mail:
elenaulrikh@yandex.ru; SPIN-код: 1110-1844, AuthorID: 668989. Pesochny-2, St.-Petersburg, 197758, Russia.
Adel F. Urmancheeva, M.D., Ph.D., Professor, Leading Researcher at the Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology;
Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Professor at the Department of Oncology of North-Western State Medical University na I.I. Mechnikov,
St.-Petersburg E-mail:
adaurm@mail.ru; SPIN-код: 4169-6011, AuthorID: 668976. Pesochny-2, St.-Petersburg, 197758, Russia.
Igor V. Berlev, M.D., Ph.D., Professor, Нead of Department of Gynecological Oncology in the N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Нead of Department of Gynecology of North-Western State Medical University na I.I. Mechnikov, St.-Petersburg. E-mail:
iberlev@gmail.com; AuthorID: 274121; ORCID: 0000-0001-6937-2740. Pesochny-2, St.-Petersburg, 197758, Russia.
Alexey M. Belyaev Professor, M.D., Ph.D., Нead of N.N.Petrov Research Institute of Oncology; Tel.: (007)-(812)-596-84-21, Fax: (007)-(812)-596-89-47, Нead of Department of Oncology of North-Western State Medical University na I.I. Mechnikov, St.-Petersburg. E-mail:
oncl@rion.spb.ru; SPIN-код: 9445-9473, AuthorID: 273109
Pesochny-2, St.-Petersburg, 197758, Russia.
For citation: Ibragimov Z.N., Mikaya N.A., Trifanov Yu.N., Gorodnova T.V., Kotiv Kh.B., Yakovleva M.G., Lavrinovich O.E., Bondarev N.E., Sidoruk A.A., Smirnova O.A., Guseinov K.D., Bakhidze E.V., Meshkova I.E., Bakaeva E.Kh., Shikhzadaeva M.G., Ul’rikh E.A., Urmancheeva A.F., Berlev I.V., Belyaev A.M. Indocyanine green (icg) for the detection of sentinel lymph nodes in patients with endometrial cancer.
Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2020; 1(Suppl): 105-11 (in Russian)
https://dx.doi.org/10.18565/aig.2020.1suppl.105-111

 В исследовании у 100 больных РЭ были установлены 220 СЛУ. У 99/100 (99%) пациенток, вошедших в исследование, произошло окрашивание СЛУ красителем ICG. У каждой пациентки определяли от 1 до 3 СЛУ, среднее количество 2,2. Билатерально окрасились ICG ЛУ у 90/100 (90%) пациенток. У 9/100 (9%) окрашивание отмечено только с одной стороны (табл. 2). В одном случае СЛУ не был выявлен.
В исследовании у 100 больных РЭ были установлены 220 СЛУ. У 99/100 (99%) пациенток, вошедших в исследование, произошло окрашивание СЛУ красителем ICG. У каждой пациентки определяли от 1 до 3 СЛУ, среднее количество 2,2. Билатерально окрасились ICG ЛУ у 90/100 (90%) пациенток. У 9/100 (9%) окрашивание отмечено только с одной стороны (табл. 2). В одном случае СЛУ не был выявлен.




