С середины 80-х годов прошлого века вопросам различных инфекционных заболеваний вульвы, влагалища, шейки матки стали уделять повышенное внимание. Прежде всего это было связано с ростом частоты цервицитов, вагинитов и главным образом – бактериального вагиноза (БВ), частота которого среди представителей некоторых возрастных групп, жителей городских и сельских поселений, разных профессий женской популяции в нашей стране колебалась в широких пределах: от 16 до 87%. С другой стороны важность изучения данного вопроса определялась теми последствиями, к которым приводили БВ и некоторые другие инфекции нижнего отдела женских половых путей: бесплодию, тяжелым инфекциям после гинекологических операций, родов, невынашиванию беременности и др.
Проведенные ранее фундаментальные исследования [1–4] показали, что содержимое влагалища есть не что иное, как биологическая жидкость строго определенного вида со своими четкими параметрами в норме и при патологии. Впервые было сформулировано, что БВ является дисбактериозом влагалища с совершенно определенным симптомокомплексом, характеризующимся дисбалансом функционирования составных частей микроэкосистемы влагалища.
Микроэкосистема влагалища – это сложная многокомпонентная система, которая включает: 1) анатомическое строение влагалища, шейки матки и промежности; 2) гистологическую структуру вагинального эпителия; 3) биохимические и биофизические параметры влагалищной жидкости (ВЖ); 4) состав микробиоты влагалища с обязательным присутствием протективных ацидофильных микроорганизмов. Целостность и единство функционирования биологического гомеостаза данной системы обеспечивается каскадом взаимодействия нейроэндокринной и иммунной систем, влиянием эндогенных и экзогенных факторов. В результате нарушений на любом уровне микроэкосистемы изменяются биологические свойства влагалищной среды, проявляющиеся угнетением роста и снижением функции лактобактерий и на этом фоне – гиперколонизацией ассоциированной с БВ микрофлорой.
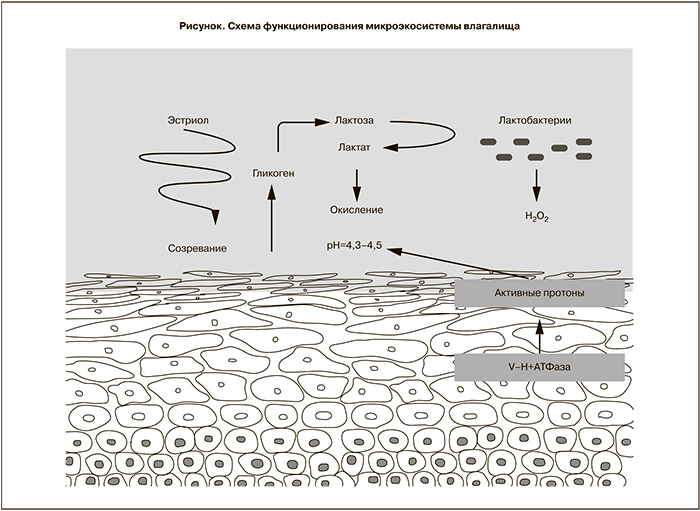
Известно, что клетки поверхностного слоя эпителия влагалища богаты гликогеном, который под действием амилазы ВЖ гидролизуется до декстринов и дисахарида мальтозы. Мальтоза поглощается микроорганизмами и в дальнейшем расщепляется на две молекулы глюкозы. Молочнокислые микроорганизмы утилизируют глюкозу в соответствующих видах брожения.
В физиологических условиях во ВЖ превалирует гомоферментный тип молочнокислого брожения при участии группы Lactobacillus acidophilus, конечным продуктом которого является молочная кислота и в меньшей степени другие кислоты (уксусная, пировиноградная).
В результате каскада ферментативных реакций из одного моля глюкозы образуется два моля АТФ. Энергии 1 моля АТФ достаточно для синтеза 11 г биомассы микроорганизмов. Таким образом, в результате молочнокислого брожения из 1 моля глюкозы образуется энергия, необходимая для синтеза 22 г ацидофильной флоры [3].
 Таким образом, ацидофильные микроорганизмы можно рассматривать как своеобразную ферментативную фабрику, способствующую образованию молочной кислоты в качестве продукта энергообеспечения их генеративной функции.
Таким образом, ацидофильные микроорганизмы можно рассматривать как своеобразную ферментативную фабрику, способствующую образованию молочной кислоты в качестве продукта энергообеспечения их генеративной функции.
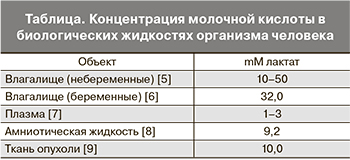
Молочная кислота (МК) – это нормальное промежуточное звено в брожении (окисление, метаболизм) сахара. В природе она образуется в результате молочнокислого брожения и является одним из важнейших метаболитов организма человека – субстратом анаэробного энергетического обеспечения практически всех биореакций. Соли и эфиры МК – лактаты. В организме человека обнаружены D- и L-изомеры МК, которые присутствуют во многих биологических жидкостях и тканях (таблица).
У женщин репродуктивного возраста наибольшее количество МК аккумулируется в просвете влагалища [10, 11, 12]. Она образуется при взаимодействии между слизистой оболочкой влагалища и молочнокислыми бактериями, главным образом лактобактериями. МК во влагалищной жидкости имеет два способа образования: эпителиальное и/или бактериальное. По первому механизму в слое промежуточных вагинальных эпителиальных клеток под влиянием эстрогенов глюкоза метаболизирует при анаэробных условиях до пировиноградной и L-молочной кислот. L-молочная кислота диффузно проникает наружу и скапливается в просвете влагалища.
Второй механизм образования МК заключается в том, что лактобактерии во влагалище метаболизируют экстрацеллюлярный гликоген в молочную кислоту посредством анаэробного гликолиза. При этом бактерии ферментируют оба изомера: L- и D-молочную кислоту [12, 13]. Доказательство продукции МК бактериями убедительно представлено в работе E.R. Boskey и соавт. (1999). Они изучали in vitro кислотность питательной среды при культивировании лактобактерий – L. gasseri, L. vaginalis, L. crispatus и L. jensenii. рН среды окислился до 3,2–4,8. Когда же культивировали БВ-ассоциированные микроорганизмы – Gardnerella vaginalis, Prevotella bivia и Peptostreptococcus anaerobius, среда окислилась только до 4,7–6,0. Этот факт является убедительным доказательством роли уровня кислотности влагалища в патогенезе БВ или аэробного вагинита.
Важно отметить, что помимо лактобацилл и другие бактерии – Atopobium, Megasphaera, Leptotrichia, молочнокислые стрептококки, бифидобактерии и даже E. coli также могут продуцировать МК во влагалище. Так, например, K. McCabe и соавт. (1998) показали, что изоляты Escherichia coli различных адгезионных фенотипов продуцируют различное количество D-лактата. Изменения условий культуры не влияли на количество произведенного D-лактата.
E.R. Boskey и соавт. (2001) установили, что при доминировании во влагалище лактобактерий молочная кислота представлена L- и D-изомерами примерно в одинаковой концентрации – 0,58 mM. Однако когда во влагалищном пуле нет преобладания лактобактерий, во влагалище преобладает L-молочная кислота (0,9 mM) по сравнению с D-изомером 0,03 mM, p=0,0024) [14].
Понимание сложных механизмов регуляции микроэкосистемы влагалища были заложены фундаментальными работами Р. Шредера и А.А. Лёзера о «латентном микробизме», А. Додедерлейном «о самоочищении влагалища», А.И. Замшиным «о самозаражении влагалища» и др. В современной трактовке схема данного процесса (упрощенный вариант) в контексте метаболизма глюкозы и молочной кислоты представлена на рисунке.
G.I. Gorodeski и соавт. (2005) изучали клеточные механизмы, которые способствуют поддержанию кислого рН в просвете влагалища. В качестве изучаемых субстратов были выбраны человеческие цервико-эпителиальные и эндоцервикальные клеточные культуры. Авторы пришли к заключению, что цервико-вагинальные клетки окисляют просвет влагалища с помощью механизма секреции активных протонов, который частично обусловлен V–H +АТФазы, расположенной в апикальной плазматической мембране, и что секреция активных чистых базовых протонов происходит на протяжении всей жизни и это окисление регулируется эстрогенами [11]. Недавно было показано, как системная и топическая гормональная терапия уменьшает плотность иннервации влагалища у женщин в постменопаузе, что приводит к относительному снижению кислотности [15].
На сегодняшний день доказано, что защитная роль МК реализуется прежде всего ее антимикробным действием и иммунологическими свойствами. При рН<4,5 L-молочная кислота подавляет БВ-ассоциированные бактерии, но не влияет на лактобациллы. В случаях, когда рН=7,0, этот эффект отсутствует, что, по-видимому, объясняется низкой концентрацией МК.
У МК описан специфический антисептический механизм действия (разрушение бактериальной мембраны), который отсутствует у аскорбиновой и уксусной кислот. Недавно J.J. Schellenberg и соавт. (2012) установили, что вагинальные молочнокислые бактерии производят анти-ВИЧ-факторы, такие как органические кислоты и перекись водорода (Н2О2), которые могут связывать и инактивировать частицы ВИЧ. Вероятно, поэтому МК относят к классу легких природных антисептиков [16].
Существует мнение, что МК при достаточно кислом рН является мощным микробицидом. D.E. O’Hanlon и соавт. (2013) высказали мнение, что предыдущие исследования, вероятно, недооценивали вагинальную кислотность и концентрацию всего лактата среди здоровых женщин, поскольку многие из них не исключали из своих исследований пациенток со сниженной концентрацией лактобацилл, которые не доминировали во влагалищной микробиоте, и также не учитывали высокие концентрации двуокиси углерода и низкое содержание кислорода среды влагалища. Авторы в минимальных аэробных условиях изучили 64 образца цервико-вагинальной жидкости (ЦВЖ), полученной от здоровых женщин (0–3 балла по Нугенту) с доминированием лактобацилл во влагалищной микробиоте. рH образцов измерялась микроэлектродом сразу же после отбора образца под физиологической концентрации СО2 во влагалище. Средняя величина pH (среднее ± SD) образцов ЦВЖ составила 3,5±0,3 (диапазон 2,8–4,2). Средний общий лактат был равен 1,0±0,2% w/v. Это в пять раз выше средней концентрации водородных ионов (низкий pH) и в пять раз выше концентрации всего лактата, чем описано в предыдущей литературе. Бактерицидные формы молочной кислоты (протонированная молочная кислота) были одиннадцатикратно более концентрированными и заметно более мощным микробицидом, чем указано в предыдущих исследованиях. Полученные данные свидетельствует, что когда лактобактерии доминируют в микрофлоре влагалища, женщины имеют значительно больше молочной кислоты, защищающей от инфекций, чем считают в настоящее время [17]. Эти результаты предполагают изучение в дальнейшем эффективности профилактического и терапевтического действия индигенной молочной кислоты, вырабатываемой индигенными лактобациллами, или применения экзогенных пробиотических лактобацилл и/или других продуктов, таких как молочная кислота (фемилекс), которые способны повысить концентрацию МК во влагалище.
Кроме того, что лактобациллы окисляют влагалище молочной кислотой, некоторые из них могут также производить перекись водорода (Н2О2) в естественных и искусственных лабораторных условиях [18]. Эти «пероксид-производители» ассоциированы с сокращением заболеваемости БВ [19, 20] и некоторых инфекций репродуктивного тракта 21, 22], по сравнению с «непроизводящими Н2О2» лактобациллами. При оптимальных условиях in vitro Н2О2-производительные лактобациллы также подавляют некоторые патогены репродуктивного тракта [23–26]. Сообща эти наблюдения привели к общему убеждению, что продукция Н2О2 вагинальными лактобациллами обеспечивает существенную защиту от БВ-ассоциированных бактерий и других патогенов полового тракта.
Однако недавно было показано, что производство Н2О2 вагинальными лактобациллами маловероятно в качестве механизма защиты в естественных условиях (in vivo), так как: 1) гипоксическое состояние во влагалище препятствует бактериальной продукции Н2О2, 2) высокая антиоксидантная способность ЦВЖ блокирует бактерицидную активность Н2О2, 3) Н2О2 является более токсичной для вагинальных лактобацилл, чем для семнадцати протестированных видов БВ-ассоциированных бактерий [27, 28].
Вместо Н2О2 авторы придают более широкий спектр бактерицидной защиты молочной кислоте, ассоциированной с доминированием в микробиоте влагалища лактобацилл, способных к ее производству. Кроме того, было доказано, что во время эпизодов БВ количество лактобацилл и вагинальной молочной кислоты заметно уменьшалось [29–31]. В ранее проведенных нами исследованиях также было показано, что в норме концентрация молочной кислоты у здоровых небеременных женщин во влагалище составляла 4,88±0,005 мкмоль/л, а при БВ снижалась до 3,32±0,16 мкмоль/л [3].
В отличие от Н2О2: 1) молочная кислота производится при гипоксических условиях во влагалище [13, 14], 2) ЦВЖ не блокирует бактерицидную активность молочной кислоты [28] и 3) in vitro вагинальные лактобациллы не влияют на концентрацию молочной кислоты, которая полностью инактивирует все БВ-ассоциированные бактерии, которые мы протестировали [27]. Было показано, что молочная кислота инактивирует широкий спектр других возбудителей половых путей, включая ВПГ-2 [32], N. gonorrhoeae [33] и уропатогенную Escherichia coli [34]. Помимо прямой инактивации патогенных микроорганизмов, вагинальная кислотность потенцирует замедление и захват ВИЧ-1 вирионов в цервиковагинальной слизи [35, 36]. Как и ожидалось, степень защитного эффекта, наблюдаемого в этих исследованиях, зависит от концентрации присутствующей молочной кислоты.
Недавно группой авторитетных исследователей было доказано, что МК увеличивает образование селективных медиаторов вагинальных эпителиальных клеток и стимулирует противовирусные иммунные реакции [37]. Кроме того, у МК выявлена избирательная стимуляция IL-23/IL-17, T-лимфоцитарного звена [38, 39] и активация лимфоцитов [40]; обнаружена индукция провоспалительных цитокинов вагинальными эпителиальными клетками в присутствии агонистов Toll-подобных рецепторов [37], а также индукция опухолевого ангиогенеза [41]. Результаты этих исследований показывают значимую роль МК в обеспечении не только противобактериальной защиты в качестве природного антисептика, но и как селективного иммуномодулятора.
В ранее выполненных нами исследованиях [1, 3] было показано, что поддержание нормальных параметров ВЖ также обеспечивают и метаболически активные слои эпителия влагалища.
Во влагалищном эпителии так же, как и в эпителии почечных канальцев, обнаружена высокая активность карбоангидразы – фермента, ответственного за регуляцию кислотно-основного равновесия и осмолярности биологической жидкости. Этот факт свидетельствует, что эпителий влагалища и почечный эпителий имеют похожие характеристики метаболической и функциональной активности. Учитывая, что мочеполовая система в процессе эмбрионального развития имеет один источник – первичную почку, возникает предположение, что эпителий влагалища может выполнять некоторые функции, аналогичные функциям эпителия почечных канальцев, а именно регулировать водно-электролитный обмен и кислотно-основное состояние ВЖ. Доказательством является тот факт, что при пероральном назначении аскорбиновой кислоты она одновременно дозозависимо определяется как в моче, так и во ВЖ (предварительные результаты). Однако во ВЖ аскорбиновая кислота не влияет на кислотность.
Метаболическая активность эпителия влагалища обеспечивает не только энергетические и пластические потребности ацидофильных микроорганизмов, но и является основой для поддержания кислотности ВЖ в физиологически детерминированных пределах 3,5–4,5. Подобные значения рН биофизически обеспечивают оптимальные условия для адгезивной активности и нормального уровня ацидофильной микробиоты влагалища.
При БВ в первую очередь происходит дисбаланс регулирующих нормальный метаболизм механизмов. Результатом этого является главный фактор формирования патологического процесса – повышение рН влагалищной жидкости и, уже как следствие, соответствующее нарушение микробного пейзажа. Оптимум активности протеолитических ферментов сиалазы, муциназы, пролинаминопептидазы (маркеры БВ) находится в характерном для БВ нейтральном диапазоне рН. Активация данных протеиназ приводит к деградации белков соединительнотканной основы, нарушению целостности клеточных слоев эпителия влагалища, что ведет к цитолизу и негативно влияет на функциональную и метаболическую активность эпителия влаглища. Вследствие этих процессов в клетках вагинального эпителия нарушается синтез и накопление гликогена. Ферментируемый ацидофильной микрофлорой лактат превращается под влиянием лактатдегидрогеназы в пировиноградную кислоту (ПВК), которая в свою очередь используется ассоциированными с БВ анаэробными микроорганизми в энергообеспечивающей реакции образования ацетил-СоА, а не поступает в клетки эпителия влагалища для ресинтеза глюкозы. В результате в клетках вагинального эпителия истощаются запасы гликогена.
Исходя из вышеизложенного и учитывая малоэффективность монотерапии БВ антибактериальными препаратами (метронидазол, клиндамицин), важно определение места и роли МК, ориентированной по механизму своего действия на ключевые биохимические звенья патогенеза БВ и влияющей на метаболизм всей микроэкосистемы влагалища в целом – эпителий, влагалищную жидкость, микрофлору.
Большим достижением последних лет стала разработка и внедрение в клиническую практику единственного в России фармакологического препарата, содержащего 100 мг молочной кислоты – фемилекса.
В недавних исследованиях [42–44] была не только объяснена биологическая роль МК для поддержания нормального микробиоценоза влагалища и его коррекции при патологических изменениях, но и доказана высокая эффективность применения фемилекса для лечения БВ. Авторами установлено, что использование влагалищных суппозиториев фемилекс именно в дозе 100 мг дает положительный эффект в отношении коррекции микрофлоры. Наилучшие результаты были достигнуты при сочетании фемилекса с гексиконом.
В заключение можно констатировать, что МК является важнейшим биологическим субстратом, поддерживающим оптимум биологического гомеостаза микроэкосистемы влагалища, а лекарственное средство фемилекс восстанавливает рН, способствует накоплению гликогена, обладает микробицидным, иммунокоррегирующим свойствами и предназначено для лечения гипо- и анацидных нарушений во влагалищной среде.



