Одним из критических периодов жизни женщины является климактерий, что связано с изменением гормональных взаимоотношений в организме при дефиците половых стероидов. У большинства женщин данного возраста имеет место климактерический синдром (КС), осложняющий физиологическое течение климактерия [1]. Одним из ведущих признаков нейровегетативных изменений у женщин во время и после наступления менопаузы являются нарушения сна, встречающиеся у 25–54% пациенток [2]. Согласно данным литературы, неполноценный сон может быть причиной развития в организме окислительного стресса, представляющего собой результат усиления свободно-радикальных процессов и снижения буферной емкости системы антиоксидантной защиты (АОЗ), являясь при этом одним из звеньев патогенеза многих заболеваний, таких как сердечно-сосудистые [3], эндокринные [4], онкологические [5] и многие другие. Результатом накопления высокотоксичных продуктов перекисного окисления липидов (ПОЛ) являются глубокие изменения в метаболизме белков, жиров, углеводов, нуклеиновых кислот и в водно-электролитном обмене, вызывающие тяжелые поражения тканей и снижающие адаптационные возможности организма [6, 7].
В настоящее время в литературе имеется ряд исследований по проблеме взаимосвязи нарушений сна с развитием окислительного стресса. При этом большинство работ о влиянии депривации сна на свободно-радикальные процессы являются экспериментальными [8–10]. Основная часть исследований на человеке посвящена ассоциации окислительного стресса с синдромом обструктивного апноэ сна [11–14] и совсем мало работ, касающихся влияния инсомнии на процессы ПОЛ [15–17]. Результаты таких исследований представляются актуальными и могут быть использованы для разработки рекомендаций профилактических и лечебных мероприятий с целью повышения качества жизни пациенток с КС.
 Материал и методы исследования
Материал и методы исследования
Обследованы 57 женщин постменопаузального периода (средний возраст – 57,2±0,41 года). Критериями включения женщин в группу постменопаузы были: возраст 56–60 лет; уровень ФСГ>20 мЕд/мл, индекс ЛГ/ФСГ<1; отсутствие менструальной функции более 24 месяцев; ультразвуковые критерии (тонкий нефункциональный эндометрий, М-эхо 0,5 см или меньше, отсутствие фолликулярного аппарата яичников). Анкетирование женщин было проведено с помощью специальных опросников: специализированный опросник сна (Стэнфордский центр изучения сна, США), тест для оценки субъективной тяжести инсомнии (Insomnia Severity Index, ISI), анкета для скрининга апноэ во время сна для количественной оценки риска наличия синдрома обструктивного апноэ сна (СОАС), шкала оценки дневной сонливости Эпворта (Epworth Sleeppiness Scale, ESS) для количественной оценки степени дневной сонливости. Для количественной оценки выраженности КС использовали модифицированный менопаузальный индекс (ММИ) Куппермана (1959) в модификации Е.В. Уваровой (1983).
По результатам анкетирования были сформированы две группы: основная – с нарушениями сна (n=34, средний возраст – 57,51±0,52 года, индекс массы тела 28,0±2,35 кг/м2) и контроль –без нарушений сна (n=23, средний возраст – 56,96±0,54 года, индекс массы тела 34,15±1,5 кг/м2).
Основная группа была разделена на две подгруппы: пациентки с инсомнией (n=18, индекс массы тела 26,37±2,68 кг/м2) и пациентки с инсомнией и храпом (n=16, индекс массы тела 31,74±3,89 кг/м2).
Дополнительными критериями для отбора женщин в основную группу были: жалобы на нарушение сна в течение 6 и более месяцев, повторяющиеся не менее 4 и более ночей в неделю, в виде затрудненного засыпания (более 20 минут от момента выключения света) и частых ночных пробуждений (не менее 2–3 эпизодов за ночь). Критерии исключения пациенток были: применение заместительной гормональной терапии; декомпенсированные психические, неврологические, сердечно-сосудистые, эндокринные заболевания; обострение хронических заболеваний; наличие хронических нарушений сна в анамнезе; применение гипнотиков в течение последних двух недель; хирургическая менопауза; работа по сменам. Исследования на пациентках выполнены с информированного согласия испытуемых и соответствуют этическим нормам Хельсинской декларации Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki, 1964, 2000 ред.).
Интенсивность процесса ПОЛ и АОЗ оценивали по содержанию их отдельных компонентов в сыворотке крови и гемолизате. Содержание субстратов и продуктов ПОЛ-соединений с сопряженными двойными связями (Дв.св.), диеновых конъюгатов (ДК), кетодиенов и сопряженных триенов (КД и СТ) определяли спектрофотометрическим методом В.Б. Гаврилова, М.И. Мишкорудной (1983). Содержание продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-активных продуктов – ТБК-АП), ПОЛ определяли в реакции с тиобарбитуровой кислотой по методу В.Б. Гаврилова с соавт. (1987). Об активности системы АОЗ судили по содержанию α-токоферола и ретинола, используя метод Р.Ч. Черняускене с соавт. (1984); восстановленного и окисленного глутатионов (GSH и GSSG), используя метод P.J. Hisin, R. Hilf (1976). Измерение активности супероксиддисмутазы (СОД) проводили по динамике аутоокисления адреналина по методу H.P. Misra, I. Fridovich (1976). Измерения проводили на спектрофлюорофотометре «SHIMADZU RF-1501» (Япония).
Коэффициент окислительного стресса (КОС) рассчитывался по следующей формуле, где все показатели были разделены на две группы – в одну вошли прооксиданты, а в другой – показатели, характеризующие систему АОЗ [18]:
КОС = (ДВ.СВ.i/ДВ,СВ.n)*(ДКi/ДКn)*(КД-СТi/КД-СТn)*(ТБК-АПi/ТБК-АПn)
(СОДi/СОДn)*(GSHi/GSHn)*(Аi/An)*(Еi/En),
где i – показатели обследуемого пациента, n – среднегрупповые показатели контрольной группы.
Для анализа полученных данных использовали статистический пакет – Statistica 6.1, Stat-Soft Inc, США (правообладатель лицензии – ФГБНУ НЦ проблем здоровья семьи и репродукции человека). При анализе межгрупповых различий для независимых выборок использовали непараметрический критерий Манна–Уитни. Критический уровень значимости принимался за 5% (0,05).
Результаты исследования и обсуждение
При детальном анализе данных анкетирования женщин основной группы 11 женщин указывали на трудности засыпания, 10 женщин – на трудности утренних пробуждений. Частые ночные пробуждения отмечены у 19 женщин. Более того, 16 женщин основной группы предъявляли жалобы на храп и остановки дыхания во время сна – апноэ (со слов окружающих), то есть набирали 4 балла и более по анкете для первичной диагностики СОАС (рисунок).
При анализе данных анкетирования по шкале оценки дневной сонливости Epworth выявлено, что суммарный балл у пациенток с инсомническими расстройствами составил 24,8±0,31, а в группе женщин с инсомнией и храпом – 19,93±0,78, что в обоих случаях соответствует выраженным нарушениям сна.

При оценке тяжести КС у обследуемых женщин на основании ММИ было выявлено, что у женщин контрольной группы слабая и средняя степень выраженности климактерических расстройств отмечалась в равных долях. У женщин с нарушениями сна в обеих подгруппах чаще диагностировали среднюю степень тяжести КС. Более того, у 3 женщин из подгруппы с инсомнией и храпом был диагностирован КС тяжелой степени тяжести (табл. 1).
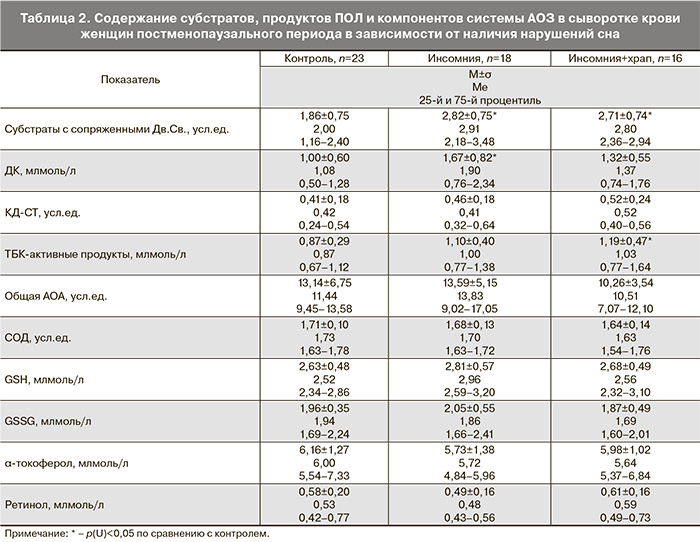
Результаты исследований, характеризующие процессы ПОЛ-АОЗ у женщин исследуемых групп, представлены в табл. 2. В подгруппе пациенток с инсомническими расстройствами отмечено повышение субстратного обеспечения процессов ПОЛ в 1,5 раза (р<0,05), а также первичных продуктов ПОЛ – ДК в 1,7 раза (р<0,05) по сравнению с контрольной группой. В подгруппе пациенток с инсомническими расстройствами и храпом отмечено повышение субстратного обеспечения процессов ПОЛ в 1,5 раза (р<0,05) и высокотоксичных ТБК-АП в 1,4 раза (р<0,05) по сравнению с контролем. При оценке показателей системы АОЗ отмечено, что данные значения в обеих подгруппах находятся на контрольном уровне (табл. 2).
Следующим этапом нашего исследования стал расчет КОС с целью индивидуальной оценки окислительного стресса у женщин в исследуемых группах. Полученное значение сравнивалось с контролем, принятым за единицу. Значение КОС>1 рассматривалось как нарастание степени окислительного стресса. Чем больше величина КОС, тем более интенсивны процессы ПОЛ и менее эффективна система АОЗ у обследуемого пациента. Данная формула разработана строго для индивидуальной оценки состояния системы ПОЛ-АОЗ у конкретного пациента и позволяет оценить изменения, происходящие в его организме на каждом этапе процесса ПОЛ.
У большинства пациенток обеих подгрупп с нарушениями сна (76% случаев в подгруппе с инсомнией и 84% случаев в подгруппе с инсомнией и храпом) значения пораскиданного звена были выше 1, а значения системы АОЗ меньше 1, что свидетельствует об активации пораскиданного и истощении антиоксидантного звеньев у пациенток с нарушениями сна. В 11% случаев в подгруппе с инсомнией и в 5% случаев в подгруппе с инсомнией и храпом значения КОС соответствовали контролю, а у 13% пациенток с инсомнией и 11% пациенток с инсомнией и храпом значение КОС было меньше 1 в связи с повышенной активностью системы АОЗ. Среднее значение величины КОС в подгруппе женщин с инсомнией составило 3,2, в подгруппе женщин с инсомнией и храпом – 4,7.
Таким образом, результаты нашего исследования демонстрируют развитие выраженного окислительного стресса у женщин постменопаузального периода с нарушениями сна.
В настоящее время менопауза рассматривается как фактор риска развития окислительного стресса, что связывают с гипоэстрогенией, приводящей к атерогенным нарушениям в сыворотке крови и как следствие этого, интенсификации процессов ПОЛ [19, 20]. Проведенными к настоящему времени исследованиями показано, что окислительный стресс обладает патогенетический значимостью в развитии нарушений и угасания репродуктивной функции женщины и более выражен у женщин в постменопаузе, чем в перименопаузальном периоде [21, 22]. При физиологическом течении климакса активность ПОЛ находится в пределах возрастной нормы благодаря тому, что процессы ПОЛ и система АОЗ уравновешены между собой. При патологическом течении климактерий наблюдается значительная активация процессов ПОЛ, являющаяся результатом, с одной стороны, повышения истинного уровня продуктов ПОЛ, а с другой – снижения общей антиоксидантной активности.
Согласно теории E. Reimund (1994), свободные радикалы, аккумулирующие в организме во время бодрствования, инактивируются во время сна. В связи с этим инсомния, являющаяся одним из наиболее распространенных нарушений у женщин в климактерий, приводит к накоплению свободных радикалов в организме [23]. Так, результаты исследований M. Gulec и сова. (2012) показали, что у пациентов с инсомнией снижена активность глутатионпероксидазы и повышены уровни конечных продуктов ПОЛ [16]. Увеличение уровня ТБК-активных продуктов у пациенток с инсомнией в постменопаузе показано и в работе D.E. Hachul и сова. (2006) [15]. B. Liang и сова. (2013) в своем исследовании показали снижение общего антиоксидантного статуса и повышение оксидантного звена и коэффициента окислительного стресса, что по их предположению может быть связано со снижением активности антиоксидантного фермента – порассказаны [17]. В отличие от нашей работы, их исследуемые группы не были разделены по гнетенному признаку, хотя в литературе есть данные, свидетельствующие о гендерных различиях в процессах ПОЛ и активности системы АОЗ [24].
Развитие окислительного стресса у женщин с нарушениями сна в постменопаузе может быть связано и со снижением уровня мелатонина в их организме, который помимо многообразия биологических регулярных эффектов, обладает и антиоксидантной активностью. Помимо прямого действия на свободные радикалы, мелатонин играет важную роль в активации ферментов системы АОЗ, таких как СОД, катализа, глутатионпероксидаза, глутатионредуктаза и глюкозо-6-фосфатдегидрогеназа и его недостаток в организме играет важную роль в развитии окислительного стресса [25].
К настоящему времени известно, что данный гормон является одним из основных регуляторов церковных биоритмов и нарушение его секреции при наступлении и развитии менопаузы у женщин приводит к изменению метаболических процессов и формированию различных заболеваний, в том числе и нарушений сна [26, 27].
Согласно литературным данным, окислительный стресс отмечается и при СОАС. Гипоксия, возникающая при данном патологическом состоянии и являющаяся стрессовом, вызывает изменения свободно-радикального гомеостаз, проявляющиеся дефицитом активных форм кислорода и активацией процессов ПОЛ [11, 27, 28], что может играть определенную роль в развитии окислительного стресса в подгруппе пациенток с инсомнией и храпом.
Заключение
По результатам нашего исследования, у женщин постменопаузального периода нарушения сна чаще представлены интрасомническими расстройствами (частые ночные пробуждения, жалобы на храп) и связаны с развитием окислительного стресса, о чем свидетельствует величина интегрального показателя сбалансированности системы ПОЛ-АОЗ. Факт развития окислительного стресса в данном исследовании согласуется с гипотезой E. Reimund, (1994) о защитной функции сна от окислительных повреждений [23] и является патогенетический обоснованием для включения в комплексную терапию женщин с нарушениями сна в данный период климактерий препаратов, игнорирующих активацию процессов ПОЛ.



