В организме девушек и женщин детородного возраста мужские половые гормоны вырабатываются в бóльших количествах, чем в детстве и постменопаузе, но их продукция существенно уступает таковой у мужчин. Вместе с тем, даже в таких минимальных концентрациях уровень андрогенов у женщин намного выше содержания эстрогенов (микро-/наномоли [10–6–10–9] в литре крови против пикомолей [10–12]), и при этом они играют весьма значимую роль в поддержании женского здоровья [1]. К важнейшим физиологическим эффектам андрогенов у женщин относят:
- их функцию сырьевого субстрата-прогормона для последующей ароматизации в эстрогены,
- стимуляцию в любом возрасте кожных единиц «волосяной фолликул-сальной железы», а в пубертате – инициацию пубархе и аксиллархе, регуляцию линейного роста, зон роста, формирование фигуры и др.,
- остеоанаболические свойства и регуляцию костного ремоделирования,
- миоанаболическое влияние (в том числе на уровне кардиоваскулярной системы),
- участие в формировании и поддержании женской сексуальности, либидо, поведенческих реакций, настроения, некоторых когнитивных и других функций головного мозга,
- регуляцию белкового, углеводного, липидного и пуринового обмена,
- стимулирующее воздействие на эритропоэз, гемокоагуляционные свойства крови и пр.
 Признается, что полный спектр иных позитивных влияний андрогенов на женский метаболизм в норме нам еще предстоит распознать в будущем. В то же время сегодня в практике гинекологов, эндокринологов, дерматологов, косметологов и других врачей накопились намного более обширные сведения о клинических состояниях, связанных с негативными последствиями их избытка. Эти состояния известны под собирательным названием «синдром гиперандрогении» и подразумевают наличие специфического симптомокомплекса, возникающего по разным причинам: а) при избытке синтеза и секреции андрогенов (гиперпродукции яичниками, надпочечниками, но чаще – комбинированного характера), и/или б) при их нормальной выработке – периферическими нарушениями транспорта к тканям-мишеням, и/или на уровне последних – в) особенностями локальной конверсии или рецепции андрогенов.
Признается, что полный спектр иных позитивных влияний андрогенов на женский метаболизм в норме нам еще предстоит распознать в будущем. В то же время сегодня в практике гинекологов, эндокринологов, дерматологов, косметологов и других врачей накопились намного более обширные сведения о клинических состояниях, связанных с негативными последствиями их избытка. Эти состояния известны под собирательным названием «синдром гиперандрогении» и подразумевают наличие специфического симптомокомплекса, возникающего по разным причинам: а) при избытке синтеза и секреции андрогенов (гиперпродукции яичниками, надпочечниками, но чаще – комбинированного характера), и/или б) при их нормальной выработке – периферическими нарушениями транспорта к тканям-мишеням, и/или на уровне последних – в) особенностями локальной конверсии или рецепции андрогенов.
Симптомы гиперандрогении давно известны и хорошо описаны [2]. В зависимости от тяжести андрогенизации, а также возраста дебюта и стажа процесса выделяют 3 группы признаков: 1) со стороны кожи и ее придатков (гиперандрогенная дермопатия) – жирная себорея, андрогенные угри – acne androgenica, гирсутизм; 2) со стороны вторичных половых признаков (вирилизация наружных гениталий, гортани, скальпа) – клиторомегалия, барифония, ларингомегалия, андрогенная алопеция; 3) со стороны третичных половых признаков (андроидный морфотип) – маскулинизация скелета, абдоминальное ожирение.
Двумя основными и самыми частыми категориями пациенток, нуждающимися в подборе антиандрогенной терапии, являются, с одной стороны, практически здоровые женщины с эстетическими проблемами кожи и придатков (их доля в раннем и среднем репродуктивном возрасте достигает 11–25% (рис. 1)), а с другой – больные с разнообразными репродуктивными нарушениями на фоне патологической андрогенизации неопухолевого генеза, обычно в рамках синдрома поликистозных яичников, популяционная частота которого также очень высока (5–10%) [3].
В обеих ситуациях основной задачей для врача становится выбор лечебного препарата, который должен максимально отвечать следующим современным требованиям: 1) обладать доказанной терапевтической эффективностью, 2) отличаться метаболической инертностью у здоровых и дополнительными лечебными свойствами при исходных обменных нарушениях у больных, 3) быть безопасным, 4) иметь невысокую стоимость, 5) не снижать качество жизни, обеспечивать комфортность лечения за счет простоты и удобства режима приема.
И затруднения при решении этой задачи в последнее время возникают не из-за отсутствия подобных средств, а наоборот, из-за широты их выбора в условиях недостаточной информированности клиницистов в области преимуществ и недостатков конкретных препаратов [4, 5]. Настоящая публикация имеет целью восполнить эту брешь с особым фокусом на расширение возможностей терапии гиперандрогенных состояний применением комбинированного низкодозированного гормонального контрацептива, содержащего антиандрогенный гестаген – хлормадинона ацетат (ХМА) [6–29].
 К важнейшим особенностям современной фармакотерапии гиперандрогенных состояний, в отличие от практики прошлого столетия, следует отнести, во-первых, практически полный отказ от глюкокортикоидных препаратов (за исключением редких случаев врожденной дисфункции коры надпочечников), и во-вторых, значительное пополнение группы антиандрогенных средств. До недавнего времени наши ресурсы были ограничены практически двумя соединениями – ципротероном ацетатом (ЦПА) и спиронолактоном. Каждый из них обладает высоким терапевтическим потенциалом, но по мере накопления мирового опыта оба столкнулись с ограничениями для дальнейшего применения – в связи с нежелательными явлениями при использовании первого (атерогенный и тромбоэмболический риск) и высокой курсовой стоимостью второго. Ближайшие перспективы повсеместного внедрения в отечественную практику ряда антиандрогенных соединений (флутамида, финастерида, эфлорнитина) пока сомнительны в связи с теми же или особыми причинами. Поэтому в качестве максимально привлекательной остается давно зарекомендовавшая себя технология применения эстроген-содержащих контрацептивов с особым составом, в который включены прогестагены с доказанной антиандрогенной активностью и безопасностью [16]. Сегодня их стало уже 5 из почти трех десятков прогестагенов [10] (табл. 1).
К важнейшим особенностям современной фармакотерапии гиперандрогенных состояний, в отличие от практики прошлого столетия, следует отнести, во-первых, практически полный отказ от глюкокортикоидных препаратов (за исключением редких случаев врожденной дисфункции коры надпочечников), и во-вторых, значительное пополнение группы антиандрогенных средств. До недавнего времени наши ресурсы были ограничены практически двумя соединениями – ципротероном ацетатом (ЦПА) и спиронолактоном. Каждый из них обладает высоким терапевтическим потенциалом, но по мере накопления мирового опыта оба столкнулись с ограничениями для дальнейшего применения – в связи с нежелательными явлениями при использовании первого (атерогенный и тромбоэмболический риск) и высокой курсовой стоимостью второго. Ближайшие перспективы повсеместного внедрения в отечественную практику ряда антиандрогенных соединений (флутамида, финастерида, эфлорнитина) пока сомнительны в связи с теми же или особыми причинами. Поэтому в качестве максимально привлекательной остается давно зарекомендовавшая себя технология применения эстроген-содержащих контрацептивов с особым составом, в который включены прогестагены с доказанной антиандрогенной активностью и безопасностью [16]. Сегодня их стало уже 5 из почти трех десятков прогестагенов [10] (табл. 1).
Один из них, ХМА, впервые синтезирован полвека назад (1961) [30] и за эти годы был подвергнут всестороннему изучению. По данным Национальной медицинской библиотеки США, к 2013 г. о ХМА опубликовано более полутора тысяч статей. Максимальный «бум» наблюдался в первой декаде, с 1972 г. на 25 лет интерес отчасти спал из-за запрета FDA в США, но и в последние полтора десятка лет он остается стабильным, причем исключительно клиническим. Во врачебной практике ряда стран он использовался в комбинации с синтетическими эстрогенами как с контрацептивной целью, так и для заместительной гормональной терапии, а также в качестве антиандрогенной монотерапии большими дозами.
Популярность ХМА в последнем десятилетии резко возросла в связи с регистрацией новой лекарственной формы в виде монофазного контрацептива для перорального приема, в состав каждой из 21 таблеток которого входят малые дозы этого прогестагена (2 мг) и этинилэстрадиола (ЭЭ, 30 мкг) для ежедневного приема с 7-дневными перерывами (белара). К настоящему времени он используется почти в сорока странах мира.
Крупными клиническими испытаниями установлена его высокая контрацептивная эффективность, отчетливые лечебно-профилактические свойства в отношении альгодисменореи и предменструальных дисфорических расстройств, надежный профиль безопасности (в том числе по влиянию на гемостаз и тромбофилический риск) [9, 12, 22, 27, 29]. Но особый интерес вызывают антиандрогенные свойства препарата, на которых следует остановиться подробнее.
 Уникальность структуры ХМА связана, прежде всего, с химическим подобием молекуле природного прогестерона: все тот же прегнановый каркас из 21 атома углерода, но более стабильный. Поэтому даже в малых дозах ХМА обладает антигонадотропной активностью (тормозит выработку гипофизом ЛГ, ФСГ, не влияя на ПРЛ) – причем настолько высокой, чтобы обеспечить подавление всех ЛГ-зависимых процессов в яичниках, в итоге: блокировать не только овуляцию (контрацептивный эффект), но и продукцию андрогенов (лечебный эффект) [25].
Уникальность структуры ХМА связана, прежде всего, с химическим подобием молекуле природного прогестерона: все тот же прегнановый каркас из 21 атома углерода, но более стабильный. Поэтому даже в малых дозах ХМА обладает антигонадотропной активностью (тормозит выработку гипофизом ЛГ, ФСГ, не влияя на ПРЛ) – причем настолько высокой, чтобы обеспечить подавление всех ЛГ-зависимых процессов в яичниках, в итоге: блокировать не только овуляцию (контрацептивный эффект), но и продукцию андрогенов (лечебный эффект) [25].
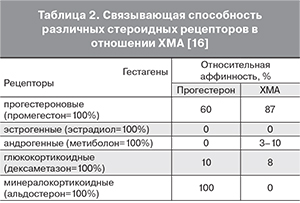
Тщательная экспертиза взаимодействий ХМА со всеми известными стероидными рецепторами позволила наряду с его высокой прогестагенной активностью обнаружить умеренные антиандрогенные эффекты (клинически значимые) и легкие глюкокортикоидные (клинически незначимые). Кроме того, ХМА лишен эстрогеноподобных и антиэстрогенных эффектов, андрогеноподобных, про- и антиминералокортикоидных свойств [16] (табл. 2). ХМА блокирует чувствительность андрогенных рецепторов [8].
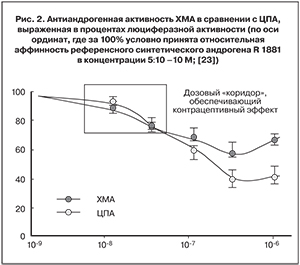
Названные особенности строения ХМА придают ему еще более высокую степень аналогии с молекулой ЦПА (единственное отличие ЦПА – дополнительный метиленовый радикал в положении С1/С2). Вот почему как на уровне стероид-рецепторного взаимодействия, так и на уровне биологического эффекта ХМА проявляет значимое антиандрогенное влияние, близкое по силе ЦПА. Так, экспериментальными исследованиями in vitro продемонстрировано, что оба прогестагена в равной степени проявляют практически одинаковую антиандрогенную способность в тех сравнительно небольших дозах, которые используются с контрацептивной целью для подавления овуляции [23] (рис. 2). А различия наступают лишь в диапазоне высоких доз, когда ХМА начинает уступать ЦПА. В совокупности, сведения о сходном молекулярном эффекте двух соединений с близким химическим строением позволяют предполагать эквивалентность клинического эффекта малых доз обоих антиандрогенов, традиционно включаемых в состав комбинированных оральных контрацептивов (КОК).
После перорального приема ХМА в составе белары он полностью и очень быстро всасывается: начинает расти в циркуляции через 17 мин, а в течение 1–2 ч уже достигает максимального уровня. Поступая из кишечника в кровь, ХМА (так же, как и ЭЭ) почти полностью (на 97–99%) связывается с альбумином. Принципиально важно подчеркнуть: ХМА, в отличие от всех иных прогестагенов (не относящихся к классу антиандрогенов), не взаимодействует с глобулином, связывающим половые гормоны (ГСПГ), не вытесняет из связи с ним тестостерон и тем самым не повышает в системном кровотоке концентрацию его свободной, биологической активной фракции. Наряду с этим ХМА не препятствует реализации стимулирующего эффекта эстрогенов на продукцию печенью самого транспортного белка, ГСПГ. В итоге синхронных эффектов ХМА и ЭЭ в общей циркуляции содержание свободного тестостерона существенно снижается, уровень связанного и потому биологического инертного андрогена увеличивается. Итак, вместе с ЭЭ ХМА «прячет» тестостерон от тканей. Кроме того, у ХМА отсутствует аффинность к глобулину, связывающему кортизол [10].
 Поскольку ХМА обладает липофильными свойствами, он распределяется и отчасти депонируется в жировой ткани, откуда способен вновь поступать в циркуляцию, при этом не аккумулирует в плазме крови.
Поскольку ХМА обладает липофильными свойствами, он распределяется и отчасти депонируется в жировой ткани, откуда способен вновь поступать в циркуляцию, при этом не аккумулирует в плазме крови.
В печени происходят основные этапы дезактивации и деградации ХМА с превращением его главным образом в 3α- и 3ß-OH-дериваты. Важно, что они проявляют самостоятельную антиандрогенную активность (возможно, в связи с их способностью к обратной трансформации в ХМА). Кроме того, основной печеночный метаболит 3ß-OH-ХМА экскретируется с желчью и по механизму энтеро-гепатической рециркуляции способен вернуться в кровь.
В отличие от гестагенов – производных нортестостерона ХМА не имеет этинильную группу у С17. Поэтому сам ХМА не подвергается воздействию 5α-редуктазы, но он ингибирует активацию этим ферментом молекулы тестостерона (плюс к прочим антиандрогенным эффектам). Тем самым ХМА блокирует конверсию последнего в 5α-дигидротестостерон, который и оказывает итоговый андрогенный эффект на ткани. Итак, ХМА «защищает» тестостерон от 5α-редуктазы и перехода в более агрессивную финальную форму [10, 18].
Поскольку ХМА в значительных количествах распределяется в жировом депо, то и выводится из организма замедленно (с периодом полувыведения 36–39 ч, то есть до полутора суток, почти в равной мере с мочой и калом).
Таким образом, многопрофильный антиандрогенный спектр действия ХМА реализуется практически на всех этапах обмена мужских гормонов в женском организме: от места выработки и процесса доставки к тканям-мишеням – до уровня периферической рецепции и активации. С учетом большого шлейфа метаболических влияний на андрогенный статус женщины, совершенно неслучайно ХМА-содержащий КОК белара стал широко применяться в последнем десятилетии не только с противозачаточной целью, но и для коррекции гиперандрогенных нарушений у девушек-подростков и взрослых женщин [9, 11–14, 17, 22, 24]: у здоровых – с косметической, при патологии – с терапевтической. Накоплен достаточный опыт как в медицинской практике, так и в научной оценке эффективности такого лечения.
Наиболее полная палитра динамики практически всех основных эндокринных параметров в процессе полугодовой терапии гиперандрогении представлена недавно в итальянском исследовании 2008 г. В группе из 25 женщин 18–28 лет установлено, что ХМА в комбинации с ЭЭ наряду с существенным клиническим эффектом приводит к значимому (p<0,01) снижению концентрации всех изученных андрогенов: как преимущественно яичниковых – андростендиона и тестостерона (на 39 и 42%), так и преимущественно надпочечникового дегидроэпиандростерона сульфата (на 23%). При этом содержание в крови ГСПГ возросло на 410%, за счет чего индекс свободных андрогенов снизился на 89% [14].
Данная отчетливая динамика не может объясняться естественной краткосрочной эволюцией или случайными спонтанными колебаниями, поскольку на большой когорте пациенток доказано обратное – как через 3, так и через 6 мес наблюдения почти пятикратное увеличение уровня ГСПГ крови произошло только в группе женщин, получавших терапию активным препаратом, содержащим ХМА [15]. В контроле на фоне приема плацебо средние значения глобулина не отличались от стартовых на любом этапе.
В рандомизированном исследовании при сравнительной оценке двух монофазных КОК «ЭЭ/ХМА против ЭЭ/дезогестрел» никаких различий в положительных сдвигах лабораторных маркеров андрогенизации у 45 здоровых женщин 18–40 лет в течение 6 мес не обнаружено. В группе получавших белару достоверно снизился уровень свободного тестостерона – на 46%, андростендиона – на 18%, ДЭАС – на 32%, тогда как ГСПГ возрос на 270%. При этом, несмотря на существенное подавление «надпочечникового» ДЭАС (практически на треть по отношению к исходному уровню), его значения оставались в пределах нормы, а подавления глюкокортикоидной функции надпочечников, судя по реакции кортизола, не установлено даже в условиях оценки их функционального резерва при стимуляционной пробе с АКТГ [25].
Таким образом, наиболее современные данные лабораторного мониторинга овариальной и адреналовой продукции различных мужских половых гормонов и их транспорта у женщин на фоне терапии ХМА свидетельствуют об однонаправленных позитивных сдвигах со стороны андрогенного статуса, которые не только согласуются между собой в рамках одного испытания, но и совпадают в разных работах и наряду с этим полностью соответствуют таким же благоприятным клиническим наблюдениям.
Наиболее многочисленные и разносторонние сведения касаются лечебной активности [6, 7] ХМА в составе белары при угревой болезни умеренной и легкой степени.
В наблюдательном испытании III фазы среди 326 пациенток с угревой болезнью (комедональная сыпь, папуло-пустулезные элементы, конглобатные угри), получавших более 13 циклов ЭЭ/ХМА, к концу первого года терапии существенное улучшение угрей на лице и шее отмечено у 64%, а полное исчезновение – у 54% [28].
В крупнейшем постмаркетинговом исследовании, в котором приняли участие около 1600 гинекологов Германии, из их 11 638 пациенток, не удовлетворенных приемом других КОК по поводу акне/себореи и поэтому перешедших на ХМА-содержащий препарат, через 4 цикла у 46% симптомы полностью исчезли, а еще у 37% наблюдалось значительное улучшение [19]. Итак, при явлениях гиперандрогенной дермопатии, резистентной к другим гормональным контрацептивам (содержащим в основном дериваты нортестостерона), абсолютное большинство женщин (83%) находят удовлетворение, только перейдя на прием белары.
Среди женщин, пользовавшихся беларой более 2 лет, к концу 4-го года наблюдалось сокращение доли случаев угрей легкой-умеренной степени более чем вдвое (с 14 до 6%) [29].
В последнем проспективном наблюдательном исследовании на базе 303 клиник Германии установлено, что из 915 женщин с акне умеренной и тяжелой степени через 6 циклов у 93% отмечалось улучшение [12].
В 1997 г. два американских исследования, посвященных лечению акне, впервые сообщили о серьезном «подводном камне», который необходимо учитывать при анализе эффекта любых противоугревых средств. Оказалось, что известный по другим медицинским моделям «феномен плацебо» представлен при угревой болезни случаями «улучшения без лечения» чрезвычайно широко – с частотой около 40% . Предполагаемые причины (спонтанное выздоровление, инсоляция, диета, лучший гигиенический уход за кожей или улучшение настроения при участии в клиническом испытании) или совсем другие еще предстоит установить. Но уже теперь стало очевидным – невозможно обсуждать достоинства ни одного из «самых лучших» средств от угрей, если не представлены результаты апробации с соответствующим контролем и рандомизацией (согласно требованиям медицины, основанной на доказательствах).
С этих позиций сегодня следует критически переоценить недоказанность эффектов ЦПА; подчеркнуть доказанные преимущества (по отношению к пассивному наблюдению) терапии норгестиматом (1997), норэтиндрона ацетатом (2001) и дроспиреноном (2008); учитывать доказанную неэффективность дезогестрела (2000) [4]. И с этих же позиций прокомментируем самые последние сведения подобной жесткой оценки эффективности ХМА.
Так, в крупное двойное слепое рандомизированное ПКИ были включены 377 пациентки с акне умеренной степени: 2/3 из них получали активную терапию ХМА, а 1/3 – плацебо (251:126). По итогам полугодовой терапии четко продемонстрирована высокая эффективность и явные преимущества терапии беларой против плацебо «со счетом 2:1» в пользу ХМА [15]: отношение шансов успеха составило 2,3 с 95% доверительным интервалом 1,3–3,7 при относительном риске 1,5 [1,2–1,8] (p=0,0002). При этом число больных, нуждающихся в лечении для достижения улучшения, действительно вызванного терапией ХМА, составляет всего 4,9, и это – очень оптимистичный предиктор из области доказательной медицины.
В сравнительном годичном испытании III фазы в параллельных группах [26] 101 пациентка получала ЭЭ/ХМА, а 98 – ЭЭ/левоноргестрел. В итоге значимо более выраженный лечебный эффект выявлен у ХМА: по частоте случаев существенного улучшения (уменьшение числа папул и пустул на лице на ≥50%) в 1,3 раза (p=0,02) и полной медикаментозной ремиссии – в 3,8 раза. Преимущества ХМА касались как женщин, впервые применявших КОК, так и перешедших на новый препарат из-за неэффективности предыдущего (в 1,7 раза; p=0,01). В целом, доля успешно ответивших на лечение ХМА составила 59% среди имевших угри на лице, 46% – на груди и 42% – на спине.
В одном из ранних испытаний женщин с жирной себореей уже было установлено ее улучшение у 68% из 131 пациенток, а исчезновение – у 58% [28], а в другом к концу 12-го цикла приема ЭЭ/ХМА излечение зафиксировано у 80% женщин из 25 [26].
В 2 постмаркетинговых исследованиях на практике подтверждено улучшение со стороны гиперандрогенной симптоматики на фоне контрацепции беларой. Так, в одном из них через 6 мес приема гиперандрогенная дермопатия улучшилась у 87%, исчезла у 29% [20].
В другом доля пациенток с сальными и очень сальными волосами на голове сократилась на 70% через 6 мес [20] и на 76% через 12 мес [21].
Даже вскоре после старта лечения беларой (после 6 циклов приема препарата) средний показатель гирсутизма по шкале Ферримена-Голлвея снизился у 25 пациенток на треть (с 15 до 10 баллов) в сравнении с исходной величиной [14]. А его полное исчезновение при приеме ЭЭ/ХМА установлено у 36% женщин уже к концу первого года терапии [26].
Регресс андрогенной алопеции к концу 12-го цикла приема ЭЭ/ХМА зарегистрирован в 86% случаев [26].
Заключение
Публикациями последних лет представлены новейшие клинические и параклинические сведения в отношении высокой терапевтической эффективности белары при синдроме неопухолевой гиперандрогении в подростковом и репродуктивном возрасте. По своему качеству обобщенный материал этих исследований отвечает самым современным требованиям медицины, основанной на доказательствах. Крупные предрегистрационные и постмаркетинговые наблюдательные исследования дополнены углубленными рандомизированными контролируемыми испытаниями – как в сравнении с плацебо, так и в параллельных группах активной терапии – по отношению к другим гормональным контрацептивам III поколения.
Итак, белара существенно расширяет возможности современного выбора терапии при большинстве гиперандрогенных состояний функционального характера (в первую очередь при акне и жирной себорее). А с учетом доказанной безопасности, дополнительных позитивных эффектов на иные показатели женского здоровья, а также низкой стоимости может рекомендоваться любым здоровым женщинам, имеющим эстетические проблемы кожи, волосистой части головы, избыточное оволосение и заинтересованным в надежной контрацепции.



