Гипертензивные расстройства при беременности наблюдаются у 10–21% всех беременных и остаются основной причиной материнской и перинатальной заболеваемости и смертности. Наиболее тяжелые осложнения при преэклампсии связаны с развитием эклампсии, HELLР-синдрома, преждевременной отслойки плаценты, перинатальной патологии. Около 15% причин преждевременных родов составляют родоразрешения в связи с преэклампсией. В настоящее время нет единого взгляда на место наследственной тромбофилии в развитии преэклампсии [1–5], что может быть связано с различной этнической принадлежностью, различной методикой определения степени тяжести преэклампсии, а также той разновидностью генных полиморфизмов, исследование которых проводилось. По данным А.Д. Макацария (2003), тромбофилия того или иного генеза выявляется у 80% пациенток с тяжелым гестозом и гестозом средней степени тяжести, а наличие тромбофилических дефектов увеличивает риск развития осложнений при беременности в 3–8 раз [6, 7]. Следует отметить, что не всегда существование преэклампсии приводит к развитию таких осложнений, как отслойка плаценты, антенатальная гибель плода, задержка развития плода (ЗРП), преждевременные роды, то есть имеет место относительно благоприятное течение заболевания. Можно предположить существование факторов или их комбинаций, при которых возникают акушерские и перинатальные осложнения. Такими факторами, по нашему мнению, могут стать различные сочетания полиморфных генов, а синергизм их воздействия может объяснить развитие акушерских осложнений и неблагоприятные исходы для матери и плода у беременных с преэклампсией.
Цель исследования: разработка дифференцированного подхода к определению риска развития акушерских и перинатальных осложнений в зависимости от результатов обследования на наследственные и приобретенные формы тромбофилии у беременных с преэклампсией.
Материалы и методы исследования
Для реализации поставленной цели были обследованы 133 женщины в третьем триместре беременности. 46 беременных с гипертензивными нарушениями и акушерскими осложнениями составили основную группу исследования. Группу сравнения сформировали 87 беременных с гипертензивными расстройствами при беременности, но без акушерских и перинатальных осложнений. Осложнения со стороны матери и плода были следующими: преждевременная отслойка нормально расположенной плаценты – 4 (8,7±4,2%), эклампсия – 1 (2,17±2,15%), HELLP-синдром – 1 (2,17±2,15%), ЗРП – 23 (50,0±7,37%), антенатальная гибель плода – 6 (13,04±4,96%), ранняя неонатальная смерть плода – 4 (8,7±4,12%), дистресс-синдром плода – 21 (45,65±7,34%). Беременные были включены в исследуемую и группу сравнения на основании величины артериального давления, уровня протеинурии, дополнительных осложнений и в соответствии с клиническим протоколом МОЗ Украины № 676. Средний гестационный возраст на момент родов в основной группе (33,50±0,57) был на 3,44 недели меньше, чем в группе сравнения (36,94±0,27, р<0,0001), что было связано с тяжестью преэклампсии и возникшими осложнениями и, в свою очередь, потребовало досрочного родоразрешения. В соответствии с клиническим протоколом МОЗ Украины № 676 преэклампсия в зависимости от степени тяжести подразделяется на легкую или гестационную артериальную гипертензию, преэклампсию средней и тяжелой степени. В основной группе гестационная гипертензия была диагностирована у 7 (15,22%) женщин, что достоверно меньше, чем в группе сравнения (57 (65,52%) (р<0,001), преэклампсия средней или тяжелой степени у 39 (84,78%) женщин, что значительно больше, чем в группе сравнения – 30 (34,48%) (р<0,001).
Во всех группах методом аллель-специфической полимеразной цепной реакции с последующей детекцией методом электрофореза в 3% агарозном геле проводили определение полиморфизмов в гене фактора V Leiden 1691 G→A, протромбина 20210 G→A, ингибитора активатора плазминогена 1-го типа (РАІ-1) 5G/4G, фибриногена β 455 G→A (FGB), параоксоназы-1 192 Q→R, метилентетрагидрофолатредуктазы (MTHFR) 677 C→T и полиморфизм 235 M→T в гене ангиотензиногена ІІ (AGT). Использовался комплект реагентов «SNP-экспресс» производства НПФ «Литех» (Россия). Геномная ДНК выделялась из лейкоцитов цельной крови с помощью реагента «ДНК-экспресс-кровь» (НПФ «Литех», Россия).
Определение приобретенных форм тромбофилии включало определение количества антифосфолипидных антител и уровня гомоцистеина. Определение суммарных антител к кардиолипину проводили с помощью иммуноферментной тест-системы производства «Гранум» (Украина). Определение IgM и IgG к β2-гликопротеину 1, протромбину и анексину V проводили методом непрямого твердофазного иммуноферментного анализа (ELISA) в сыворотке крови с помощью реагентов производства «Orgentec Diagnostica GmbH» (Германия). Повышенным уровень антител к кардиолипину считали, если индекс реакции был более 2. Количество антител IgM и IgG к анексину V, суммарных антител классов IgM, IgG, IgA к β2–гликопротеину 1 было повышенным если превышало 8 Ед/мл., а уровень суммарных антител классов IgM, IgG, IgA к протромбину было более 20 Ед/мл. Исследование выполнялось на иммуноферментном анализаторе «Stat-Fax» (США).
Определение концентрации гомоцистеина в плазме крови проводили иммуноферментным методом с использованием реактивов Axis, производства «Axis – Shield AS» (Норвегия) на приборе «Stat-Fax» (США).
Статистический анализ осуществлялся с помощью программного обеспечения Microsoft Excel 2010 и Graph Pad Prism 5 for Windows. Для сравнения качественных показателей использовали критерий χ2. Для удобства расчетов каждому генотипу (нормальная гомозигота, гетерозигота и патологическая гомозигота) присваивали номер 1, 2 и 3 соответственно. Для сравнения количественных величин использовали непарный критерий t. Для оценки силы связи между явлениями рассчитывали коэффициент корреляции Спирмена. Для оценки влияния изучаемых факторов на развитие осложнения – показатель отношения шансов (ОШ), приводя 95% доверительный интервал (ДИ). За значимый принимали уровень достоверности р<0,05.
Результаты исследования
Анализ результатов тестирования генов регуляторов системы гемостаза, «эндотелиальной системы» и генов, регулирующих уровень артериального давления, показал высокую частоту патологических полиморфизмов у пациенток обеих групп. Патологические полиморфизмы и мутации генов были обнаружены у 46 (100%) женщин основной группы и у 84 (96,5%) группы сравнения.
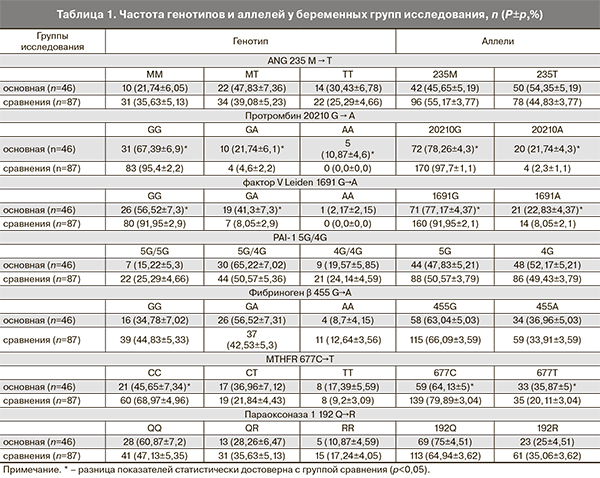
При сравнительном анализе частот генотипов и аллелей фактора V Leiden 1691 G→A (табл. 1) в изучаемых группах выявлено снижение частоты нормальных гомозигот 1691 GG в 1,62 раза в основной группе (р<0,001) и повышение количества гетерозигот 1691 GА в основной группе в 5,13 раза против группы сравнения (р<0,0001). Расчет показателя отношения шансов показал, что у носителей гетерозиготной формы 1691 GА риск развития осложнений при преэклампсии увеличен в 7,61 раза (ОШ 7,61, ДИ 95%: 2,95–19,6). Частота патологической аллели А в основной группе была достоверно выше, чем в группе сравнения (р<0,001), что увеличивает риск развития осложнений при преэклампсии в 3,33 раза (ОШ 3,33; ДИ 95%: 1,61–6,85).
Мутации в гене протромбина имели место только в группе с преэклампсией и осложнениями (табл. 1). В основной группе частота гетерозиготных форм превышала в 4,73 раза показатель группы сравнения (р=0,007), а их наличие увеличивает риск развития осложнений в 5,2 раза (ОШ 5,2; ДИ 95%: 1,6–16,7). Частота нормальных гомозигот GG в основной группе меньше в 1,42 раза (рС<0,001). В основной группе частота мутантной аллели 20210А превышала в 9,45 раза частоту в группе сравнения (р<0,001), а риск развития осложнений при наличии этой аллели выше в 10,71 раза (ОШ 10,71, ДИ 95%: 3,72-30,8). О том, что существующие мутации по гену протромбина 20210 G→A и фактора V Leiden оказывают влияние на развитие осложнений, свидетельствует наличие между ними и весом плода корреляционной связи -0,422 и -0,410 соответственно (р<0,05). Кроме того, была установлена прямая корреляционная связь степени тяжести преэклампсии и мутации в гене протромбина 20210 G→A 0,405 (р<0,05).
Анализ частот аллелей и генотипов MTHFR 677 С→T (табл. 1) выявил снижение частоты нормального генотипа СС в основной группе в 1,5 раза против группы сравнения (р=0,015). Показатель отношения шансов показал снижение риска развития осложнений у носителей генотипа 677 СС MTHFR (ОШ 0,38, ДИ 95% 0,18–0,79). Аллель Т в группе с преэклампсией и осложнениями встречалась в 1,78 раза чаще, чем в группе без осложнений (р=0,008), что увеличивает риск развития осложнений в 2,22 раза (ОШ 2,22; ДИ 95%: 1,26–3,88).
Результаты тестирования на наличие полиморфизмов в генах ангиотензиногена ІІ 235 М→Т, PAI-1 5G/4G, фибриногена β 455 G→A, параоксоназы 1 192 Q→R не выявили достоверных отличий между группами (табл. 1).
Так как преэклампсия является многофакторным заболеванием, важную роль играет сочетанное воздействие нескольких патологических генов или полиморфизмов, при котором их патологический эффект суммируется. В качестве неблагоприятных генотипов рассматривались: гомо- и гетерозиготные полиморфизмы в генах протромбина 20210 GA, АА, FV Leiden 1691 GA, АА, PAI – 1 5G/4G, 4G/4G, FGB 455 GA, AA, монозиготные полиморфизмы PON – 1 192RR, ANG 235 TT, MTHFR 677 TT. При анализе распределения сочетаний патологических генотипов установлено, что они одинаково часто встречались у беременных вне зависимости от наличия осложнений: у 36 (78,26%) в группе с осложнениями и у 66 (75,9%) в группе без осложнений. Однако достоверные отличия обнаружены в количестве сочетанных полиморфизмов у одной женщины. Одновременное наличие трех и более патологических полиморфизмов установлено у большего количества представительниц основной группы – 25 (54,3%) против 17 (19,5%) женщин группы сравнения (р<0,001). Подобная комбинация увеличивает риск развития осложнений при преэклампсии в 4,78 раза (ОШ 4,78, ДИ 95%: 2,2–10,4). Какого-то определенного сочетания патологических полиморфизмов, характерного для беременных с преэклампсией и осложнениями, выявить не удалось.
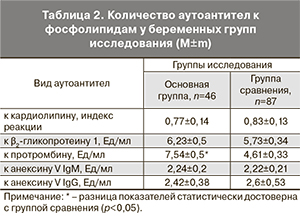
Повышенные титры антител к кардиолипину, протромбину, анексину V и β2-гликопротеину 1 чаще отмечались в группе беременных с преэклампсией и осложнениями. В основной группе повышенный титр антител был обнаружен у 21 (45,65%) женщины, в группе сравнения – у 21 (24,14%) (р<0,05). В структуре преобладали антитела к β2-гликопротеину 1: у 14 (30,4%) в основной группе против 12 (13,8%) в группе сравнения (р<0,05). Риск развития осложнений у беременных с преэклампсией при наличии повышенного титра суммарных антител к β2-гликопротеину 1 увеличен в 2,69 раза (ОШ 2,69, ДИ 95%: 1,14–6,37).
В количественном измерении только уровень аутоантител к протромбину (табл. 2) в основной группе превышал показатель группы сравнения в 1,64 раза (р<0,05). Другие количественные показатели антител между группами не отличались.
Комбинированные тромбофилии, то есть одновременное наличие патологического уровня антифосфолипидных антител и патологических генных полиморфизмов, у пациенток основной группы (21 (45,65%)) диагностировалось в 1,89 раза чаще, чем у представителей группы сравнения (21 (24,14%)) (р=0,019), что увеличивает риск развития акушерских и перинатальных осложнений при преэклампсии в 2,61 раза (ОШ 2,61, ДИ 95%: 1,23–5,53).
Анализ уровня гомоцистеина выявил достоверные отличия между группами. В основной группе (n=20) (19,41±1,42 мкмоль/л) уровень гомоцистеина был в 1,23 раза выше, чем в группе сравнения (n=30) (15,72±0,98 мкмоль/л) (р<0,05). Кроме того в основной группе у достоверно у большего количества женщин уровень гомоцистеина превышал 15 мкмоль/л – у 15 (75%), в группе сравнения – у 8 (26,67%) (р=0,002). Риск развития акушерских осложнений при уровне гомоцистеина более 15 мкмоль/л увеличивается в 7,46 раза (ДИ 95%: 2,13–26,10).
Выводы
 Наиболее значимыми в развитии акушерских и перинатальных осложнений у беременных с преэклампсией являются мутации по гену фактора V Leiden, по гену 20210 G→A протромбина, мультигенные и комбинированные формы тромбофилии.
Наиболее значимыми в развитии акушерских и перинатальных осложнений у беременных с преэклампсией являются мутации по гену фактора V Leiden, по гену 20210 G→A протромбина, мультигенные и комбинированные формы тромбофилии.
Генетическими маркерами склонности к развитию акушерских и перинатальных осложнений у беременных с преэклампсией являются: полиморфизм 1691 GА по гену фактора V Leiden – увеличивает риск в 7,61 раза (ДИ 95%: 2,95–19,6), полиморфизм 20210 GA по гену протромбина – увеличивает риск в 5,2 раза (ОШ 5,2; ДИ 95%: 1,6–16,7), комбинация из трех и более патологических полиморфизмов – увеличивает риск в 4,78 раза (ОШ 4,78, ДИ 95%: 2,2–10,4).
Обнаружение титра суммарных антител к β2-гликопротеину 1 более 8 Ед/мл увеличивает риск развития акушерских и перинатальных осложнений при преэклампсии в 2,69 раза (ДИ 95% 1,14–6,37).
Существование комбинированных форм тромбофилии увеличивает риск развития акушерских и перинатальных осложнений при преэклампсии в 2,61 раза (ОШ 2,61, ДИ 95%: 1,23–5,53).
При повышении уровня гомоцистеина более 15 мкмоль/л риск развития акушерских осложнений увеличивается в 7,46 раза (ДИ 95%: 2,13–26,10).
Использование вышеуказанных критериев позволяет сформировать группу риска развития акушерских и перинатальных осложнений при преэклампсии для пересмотра тактики ведения, определения возможности пролонгирования беременности, выбора срока и метода родоразрешения.