В современной онкологии рак шейки матки (РШМ) является, пожалуй, единственной локализацией, где сконцентрированы одновременно успехи (в изучении этиологии и патогенеза, ранней диагностике, лечении и профилактике) и множество сомнений [1]. Ежегодно в мире регистрируется 510 000 новых случаев цервикального рака, более половины женщин (288 000) умирают в течение первого года заболевания [2–5]. В последнее десятилетие сложились крайне неблагоприятные тенденции в эпидемиологии злокачественного поражения шейки матки: рост заболеваемости РШМ (с 15,1 до 17,3 на 100 тысяч населения в России), особенно в группе женщин до 40 лет (на 64,2%), в группе россиянок моложе 29 лет прирост составил 150% [6–14]. Это связано с высоким уровнем инфицированности папилломавирусной инфекцией (ПВИ), которой отводится ведущая роль в этиологии РШМ, и отсутствием программы общегосударственного скрининга. Известно, что РШМ развивается поэтапно, в связи с чем возникновение инвазивных форм может быть предупреждено. Не случайно в 1964 г. Ч. Камерон писал: «…если женщина умирает от рака шейки матки, то кто-то еще, кроме рака, повинен в ее смерти» [15]. Автор подчеркивал, что применение современных методов диагностики предраковых заболеваний, частота возникновения которых составляет 10,7–38,8% [16], должно свести на нет смертность от этой патологии.
В тех странах, где проводится организованный цитологический скрининг и адекватно лечат выявленные с его помощью предраковые изменения, заболеваемость РШМ существенно снижается [17]. В России, в отсутствие общегосударственной скрининговой программы, осуществляется оппортунистический скрининг, результаты которого следует признать неудовлетворительными: более чем в 40% случаев болезнь диагностируется на запущенных стадиях [18].
Что касается стандартных методов диагностики патологии шейки матки, то возможности их ограничены. В частности, около 30% случаев инвазивного РШМ являются результатом ошибок цервикального скрининга [19]. Одним из базовых методов диагностики является кольпоскопия (КС), проведение которой показано при выполнении прицельной биопсии и при динамическом наблюдении в ходе консервативного лечения. Однако выраженные патологические изменения, выявленные с помощью КС, не всегда соответствуют тяжелым гистологическим изменениям. Нередко обширные участки плоскоклеточной метаплазии или поражений слабой степени принимают за более тяжелые, а небольшие очаги поражений тяжелой степени пропускаются [20]. Также к трудностям для клинициста, выполняющего кольпоскопическое исследование, можно отнести сочетание элементов HSIL с компонентами LSIL, клетки которого могут доминировать и маскировать HSIL [21].
Неслучайно на долю ложноположительных и ложноотрицательных кольпоскопических заключений приходится 4–33% и 5–62% соответственно [19, 22, 23]. 52% цитогистологических расхождений вызваны ошибками при взятии биопсии под контролем КС, а 62,1% пациенток с окончательным диагнозом цервикальной интраэпителиальной неоплазии (ЦИН) III степени не имели этого диагноза в прицельном биоптате шейки матки [24, 25].
Бесспорно, золотым стандартом диагностики является гистологическое исследование, но иностранные авторы указывают, что в случае патологии шейки матки чувствительности 90–100% оно достигает лишь при наличии не менее трех биоптатов [26]. Неслучайно, даже сделав конизацию шейки матки, можно не диагностировать рак. Риск пропуска инвазивного процесса можно значительно снизить только с помощью многих диагностических приемов [27]. Поэтому некоторые отечественные и зарубежные онкогинекологи при диагностике начального этапа злокачественного процесса шейки матки рекомендуют подвергать тщательному гистологическому исследованию все зоны патологической трансформации, захватывая часть здоровых тканей, так как на фоне диспластических изменений или преинвазивного рака нередко уже имеются очаги инвазивного роста. При подобной тактике осуществляется диапевтический подход, когда в одной процедуре одномоментно реализуется решение диагностических и лечебных задач [1]. Особую трудность представляет ранняя диагностика начальных проявлений ЦИН, что связано с общей гетерогенностью проявлений патологии шейки матки, в том числе ПВИ, отсутствием единого алгоритма действий и недостатками базовых методов диагностики – онкоцитологии и кольпоскопии [28]. Данная проблема является одной из дискутабельных в акушерско-гинекологической аудитории.
В Нижегородской области статистические показатели по РШМ демонстрируют тревожные тенденции: общая заболеваемость РШМ на 100 тыс. женского населения составила в 2008 г. 16,16; в 2009 г. — 18,43; в 2010 г. – 20,55; в 2011 г. – 21 (по Российской Федерации в 2011 г. этот показатель равен 19,3).
Из 1341 зарегистрированного за 2008–2011 г. случая РШМ на 1–2-ю стадию приходилось 707 случаев (52,8%), на 3-ю стадию – 548 случаев (40,9%), на 4-ю стадию – 82 случая (6,3%). Следует отметить, что частота РШМ оказалась наиболее высокой в возрастной группе женщин от 30 до 45 лет [29].
Цель исследования состояла в проведении анализа совпадений клинических диагнозов и морфологических заключений при различных состояниях шейки матки среди жительниц Нижегородской области.
Материал и методы исследования
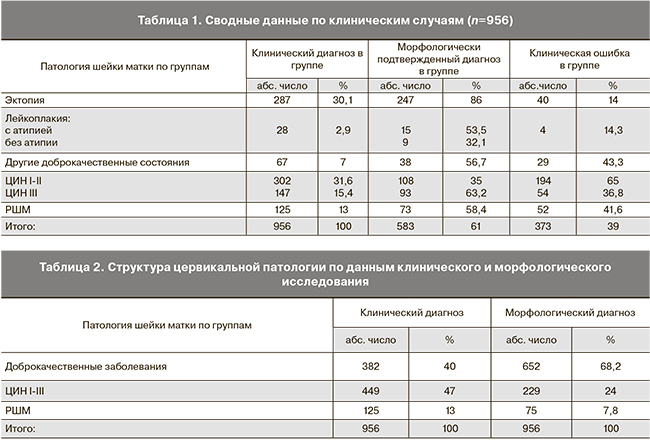
Нами было проанализировано 956 направлений на гистологическое исследование фрагментов шейки матки, полученных в результате эксцизий, проведенных пациенткам с цервикальной патологией в Областной клинической больнице им. Н.А. Семашко г. Нижнего Новгорода за период 2008–2011 г.; полученные данные сведены и представлены в виде таблиц (табл. 1 и 2).
Результаты исследования
При анализе полученных материалов было выявлено, что пациентки репродуктивного возраста составили 31% обследуемых.
По данным клинических диагнозов, указанных в направлениях, было сформировано 3 группы: 1-я группа (Т1) – доброкачественные заболевания шейки матки (382 случая); 2-я группа (Т2) – прединвазивные заболевания – ЦИН различной степени тяжести и carcinoma in situ (449 случаев); 3-я группа (Т3) – РШМ (125 случаев).
Группа Т1 была подразделена на 3 подгруппы:
- первая (287 случаев, 30,1%) – состояния, объединенные понятием «эктопия» (эктопия, эктропион и устаревший термин «эрозия», который, к сожалению, до настоящего времени используется врачами для обозначения цервикальных изменений при преимущественном несоответствии истинному значению данного понятия);
- вторая (67 случаев, 7%) включала другие доброкачественные заболевания шейки матки (кисты, гипертрофия, полип, эндометриоз, рубцовая деформация шейки матки);
- третья – лейкоплакии (28 случаев, 2,9%).
Следует отметить, что до сих пор основным термином, используемым для обозначения вида патологии шейки матки, остается термин «эрозия», который встретился в 201 случае. Несмотря на то что единственным показанием для гистологического исследования в группе Т1 являлась лейкоплакия, заведомо необоснованные эксцизии шейки матки были произведены всем пациенткам. По данным морфологии лишь в 19 случаях (5%) диагностирована ЦИН I–II, из них 10 случаев (2,6%) приходится на лейкоплакию с атипией ЦИН I–II; в 9 случаях (2,3%) выявлена ЦИН III, из них лейкоплакия с атипией ЦИН III – в 5 случаях (1,3%); в 2 случаях (0,5%) установлен РШМ (табл. 1). Из вышеизложенного следует, что злокачественная патология среди столь высокого процента эксцизий была обнаружена лишь в 2,9%.
Таким образом, только в отношении 30 из 382 пациенток группы Т1 (7,8%) была выбрана адекватная диагностическая тактика. Необоснованные эксцизии при клинической картине доброкачественных состояний шейки матки составили 92,2%.
В группу Т2 вошли 449 (47%) клинических случаев ЦИН различной степени тяжести, из них 302 (67,2%) – ЦИН I–II, 147 (32,8%) – ЦИН III. Клиническое и морфологическое совпадение диагнозов при ЦИН I–II составило 35% (108 случаев), при ЦИН III – 63,2% (93 случая). Соответственно, клиническая ошибка при ЦИН I–II составила 65%, при ЦИН III – 36,8%.
Группа Т3 представлена 125 клиническими случаями подозрения на инвазивный РШМ (13%). Морфологическое подтверждение диагноза получено в 73 случаях (58,4 %), в 20 случаях (16%) был выявлен цервицит, ассоциированный с вирусом папилломы человека (ВПЧ), в 14 случаях (11%) – ЦИН I. Таким образом, в данной группе 27% гистологических исследований оказались неоправданными.
Всего клинически было диагностировано 382 случая (40%) доброкачественных изменений шейки матки, 449 (47%) – ЦИН и 125 (13%) РШМ. По данным морфологического исследования структура заболеваний шейки матки оказалась следующей: доброкачественные заболевания выявлены в 652 случаях (68,2%), ЦИН – в 229 случаях (24%), РШМ – в 75 случаях (7,8%) (табл. 2).
Обсуждение
На основании проведенного анализа выявлено, что практикующие врачи при постановке клинических диагнозов используют устаревшую терминологию и не придерживаются МКБ-10.
Установлено также, что для верификации доброкачественной патологии шейки матки в 92,2% случаев была использована биопсия.
Чрезвычайно важно отметить, что в 68,2% случаев у пациенток с цервикальной патологией в Нижегородской области проведение биопсии оказалось необоснованным, особенно в группе женщин репродуктивного возраста.
Также выявлен высокий процент расхождения клинического и морфологического диагнозов при ЦИН и подозрении на РШМ: при ЦИН I–II – 65%, при ЦИН III – 36,8%, при подозрении на РШМ – 41,6%.
Таким образом, проведенный анализ убедительно показал, что в реальной клинической практике для более объективной неинвазивной верификации состояния шейки матки врачу необходимы дополнительные методы исследования, а диагностическая агрессия не повышает компетентности и не способствует более эффективной диагностике ЦИН и РШМ.
Коллектив авторов предлагает усовершенствованный диагностический алгоритм ведения пациенток с цервикальной патологией, состоящий из следующих этапов:
- кольпоскопия с комплементарным использованием оптической когерентной томографии (ОКТ) с целью исключения инвазивной цервикальной патологии, оценки интенсивности воспалительного процесса и морфофункциональных особенностей исследуемой ткани;
- оценка микробиоты нижнего отдела генитального тракта («Фемофлор» и качественный ПЦР-анализ на абсолютные патогены) с назначением при необходимости этиотропного лечения и восстановлением лактофлоры;
- ВПЧ-тестирование, типирование, определение вирусной нагрузки – ПЦР в реальном времени;
- повторная ОКТ-кольпоскопия, которая при условии адекватной кольпоскопической картины позволяет осуществлять динамический контроль за изменениями в эпителии и строме после проведенного этиотропного лечения в сравнении с данными ОКТ-кольпоскопии на первом этапе; оценить состояние эпителия и субэпителиальных структур по всей поверхности эктоцервикса; определить границы поражения (для планирования светового пятна при фотодинамической терапии (ФДТ) или линии резекции); определить локусы максимальных аномальных изменений для оптимизации забора материала на цитологическое исследование; произвести точечное прицельное исследование аномальных кольпоскопических признаков с решением вопроса о необходимости и месте прицельной биопсии;
- жидкостная цитология, которая разработана с целью преодоления 5 основных недостатков традиционного цитологического исследования: неспособность исследовать весь взятый материал; недостаточная фиксация материала; неравномерное распределение патологически измененных клеток в препарате; присутствие примесей, мешающих исследованию; технически обусловленная вариабельность качества мазков;
- иммуноцитохимическое определение онкомаркеpа 16ink4a; определение онкобелка Е7 ВПЧ 16-го и 18-го типов как маркеров интегративной вирогении;
- заключительным диагностическим этапом является прицельная биопсия шейки матки и, при необходимости, выскабливание цервикального канала. Ввиду того, что прицельная биопсия для окончательной гистологической верификации является инвазивной, травматичной манипуляцией и может нарушить репродуктивные планы пациентки, ее проведение целесообразно по строгим показаниям:
-
- лейкоплакия шейки матки;
- LSIL без положительной динамики в течение 18–24 месяцев при проведении патогенетической терапии;
- наличие злокачественных ОКТ-локусов более чем при 2 явках динамического наблюдения;
- HSIL;
- невозможность дальнейшего контроля состояния пациентки.
ОКТ-кольпоскопия при этом оптимизирует выбор места биопсии, основываясь не только на визуализации, но и на оптических свойствах исследуемой ткани.
Следует отметить, что в зависимости от клинической ситуации, этапность данного диагностического алгоритма может быть изменена и/или сокращена.
Итак, недостаточная эффективность традиционного диагностического алгоритма для своевременного выявления неопластических состояний слизистой оболочки шейки матки приводит к широкому использованию инвазивных хирургических методов диагностики. Развитие новых визуализирующих и молекулярно-биологических технологий будет способствовать повышению качества неинвазивной диагностики заболеваний шейки матки. Разработанная нами схема позволит использовать индивидуальный подход к ведению и лечению молодых пациенток с цервикальной патологией, обеспечив тем самым эффективную профилактику инвазивных злокачественных новообразований шейки матки.



