Последние годы внимание ученых привлекает возможное участие жировой ткани, а именно маркеров ее гормональной активности (лептин, адипонектин и др.) в патогенезе различных заболеваний. Доказано, что действие лептина осуществляется посредством лептиновых рецепторов, которые широко представлены как в периферических тканях, так и в центральной нервной системе. Лептин является одним из центральных модуляторов энергетического обмена, посредником между жировой тканью и гипоталамо-гипофизарной системой [1, 2].
Установлено, что гипоталамус – центр энергетического баланса, в который поступают нейрогуморальные сигналы с периферии. В свою очередь гипоталамус управляет расходом энергии через вегетативную нервную систему, гормоны гипофиза, широко вовлекая в этот процесс всю эндокринную систему. Известно, что гипоталамо-гипофизарно-гонадная ось снабжена на всех уровнях механизмами реагирования на метаболические сигналы, поступающие в виде гормонов жировой ткани и поджелудочной железы [3, 4]. Рецепторы к лептину находятся преимущественно в нейронах гипоталамуса, которые ответственны за продукцию гипоталамических рилизинг-факторов. Предполагают, что лептин является основным периферическим сигналом, информирующим мозг об энергетических запасах организма; он модулирует синтез множества нейропептидов в гипоталамусе, которые играют ключевую роль в половом развитии и становлении менструальной функции. Уровень лептина является сигнальным маркером достаточного накопления жира и рассматривается в качестве одного из пусковых механизмов, инициирующих половое созревание. Таким образом, становление и функционирование репродуктивной системы тесным образом зависит от энергетического баланса, включающего пищевое поведение, депонирование и интенсивность энергетических затрат в процессе жизнедеятельности организма. Регуляция потребления и расходования энергии обеспечиваются каскадом прямых и обратных связей сложной нейрогуморальной системы [5, 6].
Экспериментальные исследования показали, что лептин, инсулин, инсулиноподобный фактор роста-1 (ИПФР-1) выступают в качестве связующего звена между показателями обмена веществ и репродуктивной системой, являются теми метаболическими факторами, которые сигнализируют гонадотропин-продуцирующим нейронам гипоталамуса о пищевом и энергетическом статусе организма [7, 8]. То есть механизмы, контролирующие энергетический баланс, должны быть тесно интегрированы с механизмами, обеспечивающими репродуктивную функцию [9].
В исследованиях на подростках обоего пола с различной массой тела были отмечены связанные со стадией полового созревания гендерные особенности колебаний базального уровня лептина и инсулина, а также чувствительности к ним рецепторов тканей-мишеней [4, 5, 10, 11]. Все эти факты указывают на то, что существуют множественные прямые и обратные связи между звеньями регуляции созревания репродуктивной системы и состоянием баланса энергии в организме подростка.
Целью настоящего исследования стало изучение влияния гормонов энергетического метаболизма на активность звеньев гипоталамо-гипофизарно-гонадной оси у девушек-подростков с аномальными маточными кровотечениями (АМК) с учетом различной массы тела.
Материал и методы исследования
Работа выполнена по результатам клинического и параклинического обследования 166 девушек-подростков 13–18 лет с АМК, которые находились на лечении в отделении детской гинекологии ГУ Институт охраны здоровья детей и подростков НАМН Украины. Больные с кровотечениями были разделены на группы в зависимости от индекса массы тела (ИМТ), оценка которого проводилась с помощью центильних таблиц. Для каждой пациентки в зависимости от возраста индивидуально определялся центильный промежуток ее ИМТ. ИМТ ниже 15-й центили расценивался как недостаточная масса тела; ИМТ в промежутке между 15-й и 85-й перцентилями – как физиологические колебания. При расположении ИМТ выше 85-й перцентили диагностировалась избыточная масса тела. У 34 пациенток был выявлен дефицит массы тела – ИМТ (16,46±0,16) – І группа; у 75 ИМТ колебался в пределах физиологической нормы (19,49±0,15), они вошли во ІІ группу; у 57 больных ИМТ был повышен (26,52±0,51), они составили ІІІ группу.
Оценка гормонального статуса проводилась на основании определения: концентраций ЛГ, ФСГ, лептина, ИПФР-1, глобулина, связывающего половые стероиды (ГСПС) в сыворотке крови методом иммуноферментного анализа на фотометре Humareader (Германия) с помощью стандартных коммерческих наборов фирмы Human и реактивов фирмы DRG Instruments GmbH (Германия). Уровни пролактина, эстрадиола (Е2), общего тестостерона (Т) и иммунореактивного инсулина (ИРИ) определяли в сыворотке крови радиоиммунологическим методом с использованием стандартных наборов фирмы Immunotech (Чехия) и «ХОПИБОХ» (Белорусь). Подсчет радиоактивности проводили на счетчике Гамма-800 «Наркотест». Группу сравнения составили 56 девочек подростков общеобразовательных школ сопоставимые по возрасту, без наличия хронических заболеваний с нормальным менструальным циклом, гормональный профиль определялся на 3–5-й день менструального цикла.
 Исследовательская работа была одобрена Этическим комитетом ГУ Институт охраны здоровья детей и подростков НАМН. Все пациенты или их родители подписали информированное письменное согласие для участия в клиническом исследовании.
Исследовательская работа была одобрена Этическим комитетом ГУ Институт охраны здоровья детей и подростков НАМН. Все пациенты или их родители подписали информированное письменное согласие для участия в клиническом исследовании.
Статистический анализ сводился к дисперсионному анализу базального уровня гормонов. Результаты представлены в виде таблиц средних значений и ошибки среднего (M±m). Системный анализ проводился с помощью дисперсионного и факторного анализов. Структура факторных моделей представлена в виде таблицы, содержащей сведения об информативности факторов и значениях коэффициентов факторных нагрузок (КФН). Дисперсионный и факторный анализы полученных данных выполнялись с помощью пакета прикладных программ Statgraphics Plus for Windows 5.0 (Manugistic Inc. USA).
Результаты исследования и обсуждение
Изучение влияния гормонов энергетического обмена на активность гипоталамо-гипофизарно-гонадной оси у девушек-подростков проводилось в два этапа.
На первом этапе был проведен дисперсионный анализ гормональных показателей в зависимости от ИМТ больных с АМК (табл. 1). У пациенток всех трех групп базальная концентрация ЛГ была выше, чем в группе сравнения (р<0,01). Причем у больных с избыточной массой тела значения ЛГ превышали аналогичные в двух других группах (р<0,01). У подростков с физиологическими параметрами и избыточной массой тела средние уровни ФСГ также превышали контрольные показатели (р<0,01). Средние уровни Е2 у девочек всех трех групп были значительно выше, чем в группе сравнения, то есть в современных условиях маточные кровотечения у больных всех трех групп чаще формировались на фоне повышенного содержания в сыворотке крови Е2 (р<0,01). Сопоставление концентраций Т не выявило достоверных различий, ни при сравнении групп между собой, ни с группой сравнения. Статистически значимых различий в зависимости от паспортного и менструального возраста внутри групп выявлено не было, поэтому данные приводятся по группам в целом.
По результатам дисперсионного анализа уровень лептина у больных ІІІ группы был наивысшим и значительно превосходил аналогичные показатели пациенток І, ІІ групп и референсные значения (р<0,01). У подростков с дефицитом массы тела содержание лептина в сыворотке крови было самым низким. Выявлена корреляционная связь между концентрацией лептина и ИМТ (r=+0,64; р<0,0001). Эти результаты полностью совпадают с данными литературы, свидетельствующими о том, что уровень лептина зависит от общего количества жира в организме [12].

Содержание инсулина в сыворотке крови у пациенток с избыточной массой тела превышало аналогичное у здоровых сверстниц (p<0,01), значения же ИРИ у больных с дефицитом массы тела хотя и были ниже, чем в других группах, но достоверно не отличались от референсных цифр. Нами не было выявлено корреляционной зависимости между уровнем ИРИ и ИМТ у больных с АМК. Средняя концентрация ИПФР-1 в сыворотке крови пациенток с АМК не имела существенных различий, как при сравнении групп между собой, так и с референсными значениями.
Анализ уровня ГСПС у больных с АМК показал, что у девушек-подростков ІІІ группы он был самым низким и имел достоверные отличия (р<0,01) как по отношению к пациенткам других групп, так и группы сравнения.
На втором этапе исследования был проведен системный анализ взаимосвязи лептина и инсулина с уровнем гонадотропинов, половых стероидов, ГСПС и ИПФР-1. Методом факторного анализа была построена модель ассоциации лептина и инсулина с ФСГ, ЛГ, Т, Е2, ИПФР-1 и ГСПС (табл. 2).
Первый фактор (Ф1), описывающий 25% дисперсии исходных данных, указывает на существование положительной ассоциации между уровнем циркулирующего лептина (КФН=0,8) и синтезом ФСГ (KФН=0,72) гипофизом. Этот фактор отражает механизм влияния энергетического и пищевого статуса на становления репродуктивной функции в пубертате на уровне центрального звена репродуктивной оси. Морфофункциональной структурой, получающей информацию о соматическом статусе организма, являются нейроны гипоталамуса, синтезирующие гонадотропин рилизинг факторы, имеющие рецепторы к лептину [7, 13]. Дисперсионный анализ собственных значений Ф1 выявил статистически значимые различия, зависящие от массы тела девушек – подростков. У пациенток с избыточной массой тела среднее значение Ф1 были выше (р<0,01) по сравнению с таковыми в группах девушек с нормальной и недостаточной (низкой) массой тела (рис. 1). Это подтверждает известные факты более раннего начала пубертата и появления менархе у девочек с избыточной массой тела и ожирением [14–17]. Еще в 70-е годы прошлого столетия в работах Розы Фриш (Rose E. Frisch) было показано, что чрезмерные физические упражнения или недостаточное питание могут отсрочить наступление пубертата. Она предположила, что достижение «критической массы» жировой ткани у молодых здоровых женщин является важнейшим триггером цикличности гипофизарно-овариальной функции, а необходимая масса жировой ткани определяет наступление первой менструации [18]. Однако этот процесс не является столь линейным, так как у части девушек менархе наступает до достижения указанных критических значений массы тела.
Второй фактор (Ф2), описывающий 23,9% вариабельности исходных данных, свидетельствует о существовании положительной ассоциации между уровнями инсулина (КФН=0,79) и ЛГ (KФН=0,73). Этот фактор, на наш взгляд, указывает на возможное объяснение причин ановуляторного менструального цикла у девушек в пубертатном возрасте. Как известно, период интенсивного физического развития и полового созревания характеризуется рядом метаболических перестроек, в числе которых снижение чувствительности к инсулинопосредованному усвоению глюкозы, причем оно характерно для подростков обоего пола [11]. Так как развитие умеренной инсулинорезистентности сопровождается и умеренной компенсаторной гиперинсулинемией, то сигнализация об этом состоянии поступает в гипоталамус и опосредована связыванием инсулина с мозговыми рецепторами, расположенными в клетках ядер гипоталамуса. Инсулин усиливает ЛГ зависимый синтез андрогенов и способствует формированию ановуляторных циклов [7, 13]. В связи с тем, что дисперсионный анализ собственных значений Ф2 не выявил статистически значимых отличий, связанных с различным ИМТ, можно сделать вывод, что данный механизм при АМК не зависит от массы тела девушек-подростков. Возможно, выявленная нами закономерность лежит в основе известных фактов формирования синдрома поликистозных яичников у женщин молодого возраста, в патогенезе которого большое значение отводится инсулинорезистености [19, 20].
Третий фактор (Ф3) описывает 17,2% вариабельности переменных и отображает существование положительной ассоциации между уровнем лептина (КФН=0,68) и половых стероидов: Т (КФН=0,65) и Е2 (KФН=0,75), а также отрицательную ассоциацию этих гормонов с уровнем ГСПС (KФН=–0,53) в организме девушек. Исходя их того, что лептиновые рецепторы были также обнаружены в периферических тканях: печени, поджелудочной железе, яичниках, эндометрии, этот фактор, по-нашему мнению, отражает влияние лептина на периферическое звено гипоталамо-гипофизарно-гонадной оси, которое состоит в согласовании секреторной активности гонад (стероидо- и фолликулогенез) и глобулин-продуцирующей функции печени, результатом чего является повышение биодоступности половых стероидов в тканях-мишенях у девушек с достаточным энергетическим потенциалом.
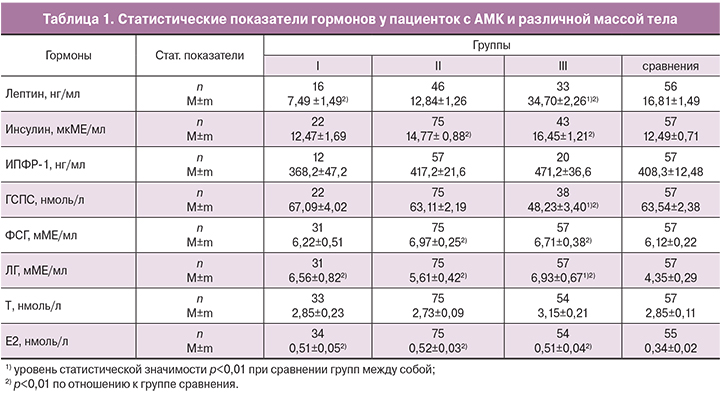
Дисперсионный анализ собственных значений Ф3 относительно массы тела указывает на градуальный (постепенный) рост средних значений этого фактора с ростом массы тела девушек (рис. 2). Статистически значимые различия обнаружены между группами с повышенным, физиологическим и сниженным ИМТ. Следует отметить, что эти межгрупповые особенности (р<0,01) в основном связаны с отличием в уровнях лептина и ГСПС.
Структура Ф3 указывает на то, что участие лептина в становлении репродуктивной системы подростков может быть опосредовано не только через гипоталамические центры, но также путем ингибирования синтеза ГСПС в печени, за счет чего увеличивается доля свободных половых стероидов в сыворотке крови.
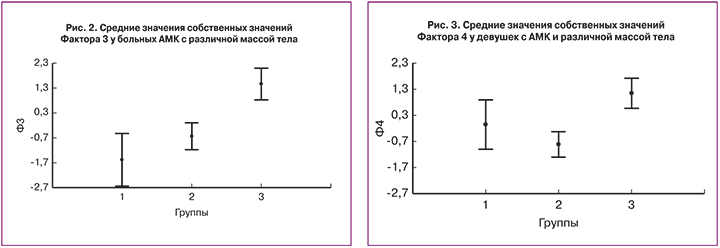
Четвертый фактор (Ф4), описывающий 15,6% дисперсии исходных данных, отражает наличие положительной ассоциации между уровнем инсулина (КФН=0,67) и ИПФР-1 (KФН=0,81), а также отрицательную ассоциацию этих гормонов с уровнем ГСПС (KФН=-0,4). Детальный анализ выявил отрицательную нелинейную ассоциацию между ИПФР-1 и ГСПС (r=–0,35; R2 =12,3%; P=0,001). Инсулин не только через свои рецепторы, но и через рецепторы ИПФР-1 подавляет синтез ГСПС, что приводит к повышению биодоступности стероидов (в основном Т). Эти эндокринно-метаболические изменения усугубляют нарушения овариальной функции. Проведение дисперсионного анализа выявило статистически значимые различия (р<0,01) между собственными значениями Ф4 у девушек с физиологической и избыточной массой тела (рис. 3). Более высокий средний уровень Ф4 у девушек ІІІ группы достигается за счет повышенных уровней инсулина и ИПФР-1.
Таким образом, проведенный системный анализ показал, что в подростковом возрасте у больных с АМК существует несколько путей взаимодействия между системами, отвечающими за баланс энергии в организме и продолжение рода (репродуктивной). Во-первых, это прежде всего участие метаболических гормонов лептина и инсулина в механизмах стимуляции синтеза гипофизарных гонадотропинов по системе обратной связи между периферическим звеном эндокринной системы и ее центральным звеном – гипоталамусом и гипофизом. Во-вторых, влияние на активность половых стероидов через регуляторные механизмы их биодоступности, то есть на синтез ГСПС в печени.
Заключение
Дальнейшее прикладное продолжение работы позволит более детально изучить особенности метаболического статуса (углеводного, липидного обменов) у девочек с АМК с последующей разработкой лечебно-профилактических мероприятий, направленных на коррекцию выявленных отклонений, что даст возможность избежать хронизации заболевания и формирования в будущем серьезных метаболических нарушений.



