В настоящее время обследование беременных на наличие инфекционной патологии стало неотъемлемой частью ведения пациенток, в том числе при нормальном течении беременности и отсутствии клинической картины заболевания [1]. Это связано с тем, что инфекционный процесс, в том числе и бессимптомный, может составить угрозу нормальному течению беременности и привести к развитию таких осложнений, как самопроизвольный аборт, преждевременные роды, преждевременный разрыв плодных оболочек, хориоамнионит, инфицирование новорожденного, послеродовый эндометрит [1–3].
В существующих нормативных документах (приказы Минздрава России № 50 [4], № 808 [5]), регламентирующих обследование беременных женщин, отсутствует детализация процедуры проведения исследований: не указаны ни инфекционные агенты, ни методы обследования, ни процедура получения биологического материала. В связи с этим практикующие врачи опираются на методические и/или клинические рекомендации, а также собственный опыт при проведении подобных исследований [2, 6].
Традиционно у беременных женщин при обследовании на хламидийную и гонококковую инфекцию материал получают из цервикального канала [7]. Выбор локуса забора материала связан с тем, что Chlamydia trachomatis, как и Neisseria gonorrhoeae, проявляют тропность к цилиндрическому эпителию, выстилающему канал шейки матки [2, 6]. Однако необходимо учитывать, что процедура получения цервикального соскоба при беременности достаточно травматична, а также может приводить к развитию восходящей инфекции, и, соответственно, осложнений, перечисленных выше. В то же время как в европейских [8], так и в американских [1] руководствах появились указания на достаточную информативность исследования вагинального мазка.
Целью данного исследования стала сравнительная оценка информативности исследования биологического материала из шейки матки и влагалища для диагностики вульвовагинальной и цервикальной инфекции у беременных.
Материал и методы исследования
В исследование были включены 677 беременных женщин, обратившихся в Клинику акушерства и гинекологии им. В.Ф. Снегирева с 14.02.2008 по 27.05.2010. После сбора анамнеза и осмотра беременных производили забор биологического материала из цервикального канала и влагалища для исследования методом полимеразной цепной реакции (ПЦР) с целью обнаружения N. gonorrhoeae, C. trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Ureaplasma parvum, Ureaplasma urealyticum, Mycoplasma hominis. Для проведения ПЦР использовали наборы реагентов серийного производства «АмплиСенс – NG/CT/MG/TV – Мультипрайм-FL» и «АмплиСенс – Флороценоз – Микоплазмы – FL» (Производство ФБУН ЦНИИ эпидемиологии, Москва). Важно отметить, что набор реагентов «АмплиСенс – Флороценоз – Микоплазмы – FL» позволяет оценить концентрацию β-глобинового гена человека в биологическом материале. β-глобиновый ген содержится во всех клетках человека, в том числе и клетках эпителия урогенитального тракта. Это означает, что концентрация данного гена отражает количество клеток эпителия (цервикального или вагинального), попавших в пробирку с биоматериалом. Другими словами, β-глобиновый ген позволяет оценить качество получения биологического материала, что особенно важно при работе с внутриклеточными и мембранными
микроорганизмами, например микоплазмами.
После проведения ПЦР сравнивали результаты, полученные при тестировании цервикальных и ваги‑
нальных образцов. Для статистического анализа применяли программное обеспечение GraphPad Prism
(версия 4.00).
Результаты исследования и обсуждение
В исследуемой группе пациенток C. trachomatis была выявлена у 8 (1,2%), M. genitalium – у 5 (0,7%),
Neisseria gonorrhoeae и Trichomonas vaginalis обнаружены не были.
Важно отметить, что C. trachomatis у всех 8 пациенток обнаруживалась как в цервикальном канале, так и во влагалищном отделяемом. В российских методических рекомендациях по лабораторной диагностике урогенитальной хламидийной инфекции (2009) [2] мазок из влагалища (в том числе полученный самостоятельно) приведен как возможный материал для анализа методом ПЦР, в то время как в европейских рекомендациях 2010 г. [8] вагинальный мазок признан предпочтительным типом биологического материала для выявления C. trachomatis. Полученные данные согласуются с рекомендациями последних лет и подтверждают отсутствие необходимости получения цервикального соскоба для диагностики хламидийной инфекции.
M. genitalium в проведенном нами исследовании во всех 5 случаях выявлялась только в вагинальном
отделяемом пациенток, и ни в одном случае возбудитель не определялся в цервикальном канале. Для
этих пациенток был проведен анализ содержания β-глобинового гена человека в биологическом материале. Оказалось, что число клеток, полученных в цервикальном соскобе и вагинальном мазке, практически совпало. Таким образом, низкая чувствительность при исследовании цервикального материала не может быть объяснена меньшим количеством материала, полученного из цервикального канала. Ингибирования реакции также не наблюдалось ни в одном из образцов. Отдельно стоит отметить, что тест, используемый в данном исследовании, имеет высокую специфичность (100%) [9], т.е. получение ложноположительных результатов в вагинальном отделяемом практически исключено. Интересно отметить, что в исследовании Wroblewski и соавт. [10] исследование вагинального мазка также обеспечивало более высокую диагностическую чувствительность (по сравнению с цервикальным соскобом и первой порцией мочи) для выявления M. genitalium. Пациентки, во влагалище которых обнаруживается M. genitalium, имеют потенциал для передачи данного возбудителя своему партнеру (партнерам), в то время как «классическое» исследование соскоба из цервикального канала не позволило бы выявить у них эту инфекцию.
Таким образом, в проведенном исследовании не было выявлено пациенток, у которых исследование
материала из цервикального канала повышало бы чувствительность метода при выявлении инфекций,
передаваемых половым путем (ИППП).
Очевидно, что распространенность ИППП в исследуемой группе невысока. В связи с этим информативность двух типов биологического материала сравнивалась также на условно-патогенных
генитальных микоплазмах, которые значительно чаще обнаруживаются в урогенитальном тракте
пациенток [11].
U. parvum была выявлена у 240 (35,4%) пациенток в цервикальном канале и у 268 (39,6%) пациенток
в вагинальном мазке. Только у одной пациентки (0,1%) U. parvum была обнаружена в цервикальном
канале, но не обнаружена во влагалище; концентрация в данном образце составила менее 102 ГЭ/мл
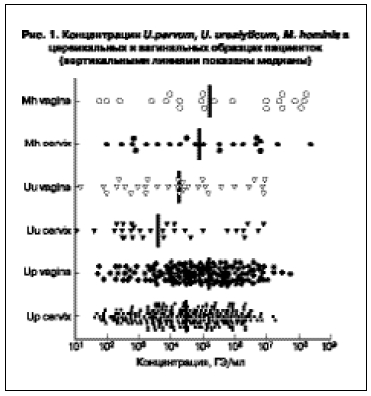
(геномных эквивалентов в миллилитре образца). Концентрации U. parvum, выявляемые в вагинальном отделяемом, были выше таковых в цервикальных соскобах (медиана составила 1,6×105 ГЭ/мл и
3,1×104 ГЭ/мл соответственно) (рис. 1).
Также стоит отметить, что концентрации, полученные в биологическом материале из двух локусов,
демонстрировали достоверную корреляцию между собой (p<0,0001) (рис. 2).
Рисунок 2. Соответствие концентрации генитальных микоплазм в цервикальных и вагинальных образцах пациенток в ГЭ/мл.
Отношение концентрации U. parvum во влагалище и цервикальном канале составило 3,78 (интерквартильный интервал 1,015–13,16).
U. urealyticum также чаще выявляли в вагинальных образцах (42 случая, 6,2%), чем в цервикальном материале (34, 5,0%). У 6 (0,9%) пациенток U. urealyticum выявлена только в цервикальном канале, из них у 5 (0,7%) концентрация не превышала 102 ГЭ/мл, у одной пациентки (0,1%) – 104 ГЭ/мл. Медианы концентраций составили 3,9×103 ГЭ/мл для материала из цервикального канала и 1,8×104 ГЭ/мл для материала из влагалища (рис. 1). M. hominis обнаруживали у 24 (3,5%) пациенток в
цервикальном соскобе и у 29 (4,3%) – в вагинальном отделяемом. Медиана выявляемых концентраций составила 7,95×104 ГЭ/мл для цервикального и 1,65×105 ГЭ/мл для вагинального материала (рис. 1).
Статистической достоверности при оценке корреляции получаемых значений концентрации во влагалище и цервикальном канале установлено не было (р=0,2878 для U. urealyticum; p=0,06 для M. hominis), что, вероятнее всего, связано с небольшим количеством положительных результатов (рис. 2).
Таким образом, в данной выборке исследование цервикального соскоба не позволяло выявить микроорганизмы, не обнаруживавшиеся во влагалищном отделяемом пациенток. Несмотря на то что как C. trachomatis, так и N. gonorrhoeae тропны к цилиндрическому эпителию, информативность вагинального мазка не уступает таковой для цервикального соскоба. Это связано с анатомоизиологической целостностью органов репродуктивного тракта женщины: эпителий цервикального канала с током слизи попадает во влагалище пациенток, в результате чего становится
возможным обнаружение цервикальных патогенов в вагинальном отделяемом (при использовании таких высокочувствительных методов, как ПЦР в реальном времени). Результаты проведенного исследования подтверждают это наблюдение для C. trachomatis. N. gonorrhoeae в данной работе не выявляли ни у одной из пациенток, однако мировой опыт позволяет говорить о том, что информативность исследования вагинального мазка достаточна для скринингового обследования беременных [12].
Как в нашей стране, так и во всем мире отсутствуют четкие рекомендации по выбору локуса для получения материала с целью выявления условно-патогенных генитальных микоплазм. Это связано с отсутствием выраженной тропности к определенному виду эпителия у данных микроорганизмов. Полученные результаты не только свидетельствуют о большей частоте выявления микоплазм во влагалище пациенток, но и показывают явную корреляцию концентраций, определяемых в цервикальном канале и влагалище пациенток. Это означает, что концентрация данных микроорганизмов во влагалищном отделяемом превышает концентрацию в цервикальном канале в 3,78 (1,015–13,16) раза. Другими словами, зная концентрацию микроорганизмов во влагалищном мазке, возможно рассчитать предположительную концентрацию выявляемых возбудителей в цервикальном канале.
Заключение
Полученные данные требуют расширенного изучения и подтверждения информативности биологического материала, полученного из влагалища, в группах беременных с более высокой распространенностью ИППП. Но уже на основании результатов проведенного исследования можно предположить, что со временем рутинное исследование материала из цервикального канала у беременных будет признано нецелесообразным, что позволит отказаться от данной инвазивной манипуляции при нормальном течении беременности.



