Урогенитальный кандидоз – одно из наиболее распространенных инфекционных заболеваний мочеполовых органов как у женщин, так и у мужчин, при этом у 12,8% женщин выявляется бессимптомное кандидоносительство. Интересен факт, что у 96,6% мужчин с урогенитальным кандидозом диагностируется баланопостит и только у 3,4% – уретрит. Candida albicans обнаруживают у 8,7% больных постгонорейным уретритом, простатитом, эпидидимитом, везикулитом. Дрожжеподобные грибы нередко выделяются в ассоциации с другими микроорганизмами [1–3].
 В литературе имеются противоречивые сообщения, касающиеся возможности передачи этой инфекции половым путем. Но в ряде случаев кандидоз развивается в результате полового контакта или им провоцируется. При этом многие женщины не живут половой жизнью, но страдают кандидозом. Экзогенное заражение от полового партнера не считается доказанным [4, 5]. Однако во время лечения пациентке рекомендуют воздержаться от половых контактов, пока по критериям излеченности не установлено выздоровление. За последние годы количество таких больных увеличилось. Появились стертые и атипичные формы заболевания, а также хронические процессы, резистентные ко многим лекарственным веществам. Важную роль отводят известным факторам риска [6, 7].
В литературе имеются противоречивые сообщения, касающиеся возможности передачи этой инфекции половым путем. Но в ряде случаев кандидоз развивается в результате полового контакта или им провоцируется. При этом многие женщины не живут половой жизнью, но страдают кандидозом. Экзогенное заражение от полового партнера не считается доказанным [4, 5]. Однако во время лечения пациентке рекомендуют воздержаться от половых контактов, пока по критериям излеченности не установлено выздоровление. За последние годы количество таких больных увеличилось. Появились стертые и атипичные формы заболевания, а также хронические процессы, резистентные ко многим лекарственным веществам. Важную роль отводят известным факторам риска [6, 7].
Инфекционный процесс чаще всего локализован в поверхностных слоях эпителия влагалища. На этом уровне инфекция может персистировать длительное время, поскольку между микроорганизмами возникает динамическое равновесие, и они не могут проникнуть в более глубокие слои слизистой оболочки. Макроорганизм сдерживает их экспансию, однако не способен полностью их элиминировать. Нарушение этого равновесия становится причиной обострения заболевания, ремиссии, либо выздоровления.
Изменению состава микрофлоры влагалища уделяют внимание многие авторы. В целом следует признать, что изменения аэробной и анаэробной микрофлоры влагалища при вульвагинальном кандидозе (ВВК) в большинстве случаев выражены слабо и не позволяют заявлять о наличии дисбиоза, требующего медикаментозной коррекции. Что касается половых гормонов, то эстрогены, как и прогестерон, повышают восприимчивость вагинального эпителия к Candida spp. Более того, клетки грибов имеют рецепторы, распознающие половые гормоны, что делает их пребывание в организме в определенной мере гормонозависимым [8, 9].
Причины хронизации кандидозов и хроническое течение ВВК объясняют по-разному. Некоторые исследования, посвященные генетическим дефектам человека, подтверждают повышенную восприимчивость отдельных индивидуумов к различным типам кандидозной инфекции; более того, у ряда лиц возможен врожденный дефект – пониженная способность нейтрофилов к фагоцитозу клеток гриба. В настоящее время подтверждено, что рецидивы ВВК, как правило, бывают вызваны одним штаммом гриба [10, 11].
Когда ВВК проявляется как острое воспаление, его легко диагностировать и лечить. У части больных могут иметь место периодические эпизоды, причина и симптоматика которых различны, что усложняет диагностику. Не всегда возможно связать появление жалоб у пациентки с дрожжевыми микроорганизмами, и наоборот, наличие грибов рода Candida не обязательно подтверждает факт вульвовагинита грибковой этиологии. Поэтому в литературе ВВК нередко рассматривают как синдром с хроническими проблемами вульвовагинального дискомфорта, при этом само заболевание становится только небольшой частью серьезной клинической проблемы микозов. В последние годы отмечают появление штаммов возбудителей, резистентных ко многим лекарственным веществам, а также короткий лечебный эффект [12].
Клиника генитального кандидоза
Генитальный кандидоз часто сопряжен с творожистыми выделениями белого цвета. Для острого или хронического в стадии обострения ВВК характерны один или несколько из следующих симптомов: бели, зуд, жжение или раздражение в области половых органов, невозможность совершить половой акт из-за резкой болезненности (диспареуния), неприятный запах.
Главное отличие поверхностных форм кандидозной инфекции – проникновение возбудителя не глубже базального слоя эпителия. По данным различных авторов, носительство грибов Candida на коже можно выявить у 30–50% населения – это варианты постоянной или транзиторной формы колонизации [13]. В отличие от кандидоза слизистых оболочек, при кандидозе кожи основным защитным фактором, препятствующим развитию инфекции, служит целостность эпителия. Для клинического течения кандидоза крупных складок, в том числе паховых, характерны мацерация, поверхностные трещины и эрозии, иногда пузырьки и лихенификация, зуд. Дифференциальную диагностику проводят с паховой дерматофитией, при которой нет мокнутия, в центральной части отсутствует эрозия. Оправдано назначение антимикотиков местного действия. Системные антимикотики используют в случае безуспешной местной терапии, при вовлечении фолликулов волос, присоединении воспалительных явлений [14, 15].
Хронический кандидоз вне обострения не имеет выраженной клинической картины. Присоединение сопутствующей бактериальной микрофлоры резко меняет клиническую картину – возникают жалобы на болезненность, жжение; при осмотре наблюдают выраженную отечность, гиперемию, иногда – поверхностные эрозии, в заднем своде влагалища обильное творожистое отделяемое. Хроническому ВBK присущи слабая гиперемия и инфильтрация слизистых оболочек, скудные беловатые пленки в виде вкраплений и островков, сухие без четких границ эрозии, лихенификация и сухость малых и больших половых губ, экскориации, трещины. Изменения наружных половых органов могут напоминать атрофический лишай: кожа и слизистые оболочки приобретают бурую окраску, становятся дряблыми и атрофичными, большие и малые половые губы сглажены или сморщены, отверстие влагалища сужено, имеются эпидермальные папулы, линейные экскориации и рубцы. Бессимптомный кандидоз влагалища сопровождается геморрагическими высыпаниями на нормальной или слегка синюшной слизистой оболочке.
 Диагностика
Диагностика
Правильно установленный клинический и этиологический диагноз позволяют определить объем и степень терапевтического вмешательства, а также провести этиологически направленную терапию. Предпочтителен микроскопический метод исследования нативного или окрашенного препарата, а также культуральный метод. Существующие молекулярно-биологические методы диагностики ВВК – полимеразная цепная реакция, в том числе в режиме реального времени, – позволяют выявить как C. аlbicans, так и другие виды дрожжеподобных грибов. Как и при любой инфекции, при ВВК очень важно соблюдать правила получения клинического образца для микроскопического исследования. Целесообразно обследование женщины в период овуляции, а также не ранее 5 дней после полового акта.
Условия обследования: отсутствие приема системных антибактериальных, противогрибковых, протистоцидных лекарственных препаратов в течение предшествующих 2 месяцев, отсутствие применения местных (влагалищных) форм в течение предыдущих 3 недель, отсутствие спринцеваний накануне и в день обследования, задержка мочеиспускания в течение 3–4 ч до момента получения биопробы. Должно быть исследовано отделяемое всех возможных отделов инфицирования, а именно мочеиспускательного канала, заднего бокового свода влагалища, цервикального канала, ампулы прямой кишки. Соблюдение требований получения клинического образца из мочеиспускательного канала для микроскопии повышает выявление лабораторных признаков воспаления почти в 3 раза и дрожжевых грибов рода Candida почти в 2 раза. Очевидно, что своевременное выявление и по возможности устранение факторов риска служит гарантом эффективности противогрибковой терапии, поэтому врач во время приема обязан уделить время для адекватной ревизии анамнеза.
Лечение
Тактика ведения больных ВВК в значительной степени зависит от формы течения и этиологической структуры инфекционно-воспалительного процесса. Ограниченный поверхностный кандидоз кожи и слизистых оболочек можно успешно лечить средствами для местного применения. На сегодняшний день оправдан поиск антимикотиков с широким спектром действия, которые охватывали бы все виды грибов рода Candida и другие патогенные дрожжевые грибы, грамотрицательные и грамположительные микроорганизмы, включая анаэробные, а также простейшие.
В связи с этим внимание привлекает антимикотик залаин (сертаконазол), ЗАО «Фармацевтический завод ЭГИС», Венгрия) в форме вагинальных суппозиториев. Сертаконазол – производное имидазола и бензотиофена, считается эффективным и безопасным средством для лечения ВВК. Азоловая группировка в составе молекулы сертаконазола обеспечивает фунгистатический механизм действия залаина, определяющийся наличием в структуре клеточной мембраны грибов молекулы эргостерола. Это соединение регулирует внутреннюю «подвижность» или «текучесть» мембраны. Сертаконазол нарушает синтез эргостерола клеточной мембраны грибов, чем вызывает нарушение устойчивости и плотности мембраны и тормозит развитие грибов. Новая противогрибковая молекулярная структура в составе сертаконазола – бензотиофен, обеспечивает его фунгицидную активность в низких концентрациях с прямым влиянием на плазматическую мембрану грибов. Действием бензотиофена также объясняется и активность сертаконазола в отношении штаммов грибов с перекрестной резистентностью к другим имидазолам. За счет структурного сходства бензотиофена с триптофаном, сертаконазол проникает в плазматическую мембрану гриба и разрывает ее, что приводит к дезорганизации мембраны, деструкции и гибели грибковой клетки в результате лизиса органелл. Благодаря высокой липофильности, бензотиафен глубоко проникает в кожу. Через 2–4 часа 59% нанесенной дозы сертаконазола достигает глубоких слоев эпидермиса, а через 24 часа 72% нанесенного препарата сохраняет активность в глубоких слоях эпидермиса, при этом его действие продолжается в течение 48 часов.
Сертаконазол при интравагинальном применении обладает нулевой биодоступностью, не обнаруживается в плазме и моче, в связи с чем важным преимуществом средства является возможность применения его во время беременности. Препарат также способен элиминировать широкий спектр колоний дрожжевых грибов из глубоких слоев тканей, что позволяет лечить устойчивые формы кандидоза, в том числе и у беременных. Практически не вызывает побочных явлений; длительно сохраняется в тканях и медленно выделяется из них, действует в течение длительного времени после однократного введения, чем обеспечивает профилактику рецидивов. Кроме выраженного антимикотического эффекта, залаин действует, в том числе и на неспецифическую флору (Streptococcus spp., Stahpillococcus spp., Bacteroides spp.), а также на Trichomonas vaginalis [16, 17].
Клинические испытания сертаконазола
По сравнению с другими антимикотическими препаратами минимальная фунгицидная концентрация (МФК) сертаконазола очень близка к минимальной ингибирующей концентрации (МИК). Высокая клиническая эффективность сертаконазола достаточно широко доказана в многоцентровых европейских и российских исследованиях, в том числе методом двойного слепого рандомизированного исследования [18–20]. Так, показано, что излечение ВВК при использовании залаина (сертаконазола) наступает чаще, чем при использовании клотримазола (рис. 1).
В другом исследовании в лечении ВВК продемонстрирована более высокая эффективность и безопасность залаина по сравнению с эконазолом (рис. 2, 3).
Отмечено, что при использовании залаина (1 свеча на курс лечения) рецидивы кандидоза были достоверно реже, чем при использовании эконазола (19,8 и 32,7% соответственно).
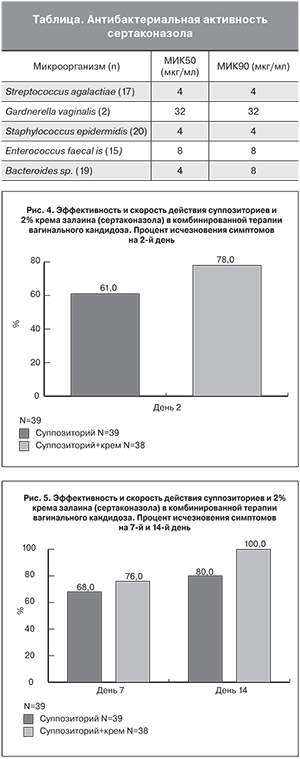
Результаты сравнительного исследования (2006), где изучалась эффективность терапии действия вагинальных суппозиториев залаина (сертаконазола) и 2% крема залаина (сертаконазола), показали высокие результаты в лечении ВВК обеих форм препарата, но при комбинации крема и суппозиториев результаты были лучше (рис. 4).
Антибактериальная активность сертаконазола в отношении возбудителей микст-инфекций также была доказана в данном исследовании (таблица).
Заключение
Таким образом, появление антимикотика для местного применения залаина (сертаконазола) расширило возможности выбора оптимального противогрибкового средства для лечения генитального кандидоза. Высокая клиническая эффективность данного препарата, короткий курс лечения (1 свеча для большинства пациенток), удобство применения, отсутствие побочных эффектов в ходе исследований позволяют считать этот препарат перспективным и современным.



