Эндометриоз характеризуется локализацией эндометриоидных желез и стромальной ткани за пределами полости матки; проявляется в 20–40% случаев бесплодием, в 70–80% случаев – дисменореей и/или хронической тазовой болью и до сих пор является медицинской проблемой, полностью не изученной как с патогенетических, так и с терапевтических позиций [1–4]. Лечение эндометриоза предполагает не только удаление очагов атипично расположенного эндометрия, снижение болевого синдрома, восстановление репродуктивной функции, но и профилактику рецидивов заболевания и повышение качества жизни женщины в целом [1, 2, 4–6]. Сложившаяся практика показывает, что основным методом лечения распространенных форм эндометриоза является удаление очагов с использованием различных способов и энергий: хирургическое иссечение, лазерная, крио- или ультразвуковая деструкция [1, 6]. В течение последних 5 лет в нашем отделении активно применяется аргоноплазменная коагуляция (АПК) для обеспечения эффективного гемостаза при различных гинекологических операциях, для девитализации эндометриоидных гетеротопий, в хирургии миомы матки.
Однако во время хирургического вмешательства удаляются лишь видимые очаги. Часть патологических гетеротопий может остаться в глубине тканей, и заболевание вновь проявится через некоторое время, поэтому целесообразно применение медикаментозной терапии на втором этапе лечения [1, 3, 7]. Для полного восстановления качества жизни необходим и третий этап, заключающийся в восстановлении нарушенной вследствие эндометриоза репродуктивной функции и последующей эффективной контрацепции [2, 5, 7].
Целью исследования стала оценка эффективности комплексной хирургической (с использованием АПК) и гормональной противорецидивной терапии тяжелого генитального эндометриоза.
Материал и методы исследования
Объектом исследования стали 59 пациенток отделения общей гинекологии МБУ ЦГБ № 7 Екатеринбурга в период с 2010 по 2012 г.
Критерии включения в исследуемые группы: возраст 25–40 лет, наличие наружного генитального эндометриоза III и IV степени по классификации Американского общества фертильности (AFS, 1998 г.), отсутствие тяжелой соматической патологии.
Критерии исключения: наличие наружного генитального эндометриоза I и II ст., миома матки, наличие сопутствующей соматической патологии.
Исследуемые пациентки разделены на три группы. 1-я группа – 33 женщины, прооперированных с использованием сочетания стандартных энергий с АПК, с последующей противорецидивной терапией диеногестом (визанна) – проспективное исследование.
Во 2-ю группу были включены 11 женщин, прооперированных с использованием сочетания стандартных энергий с АПК и последующей терапией агонистами гонадотропин-рилизинг гормона (ГнРГ).
В 3-ю группу были включены 15 пациенток, прооперированных ранее по поводу распространенных форм генитального эндометриоза с использованием стандартных методов воздействия на эндометриоидные гетеротопии (биполярная коагуляция и монополярная коагуляция и резание) и послеоперационной терапией агонистами ГнРГ (ретроспективное исследование).
Пациенткам всех групп проводили общепринятое клинико-лабораторное обследование, включающее ультразвуковое исследование (УЗИ) органов малого таза; при подозрении на позадишеечную локализацию процесса проводили трансректальное УЗИ и магнитно-резонансную томографию органов малого таза. Для выявления степени вовлеченности в инфильтративные процессы смежных органов выполняли ректороманоскопию и экскреторную урографию, УЗИ почек.
Лапароскопию и гистероскопию проводили в стандартных условиях на оборудовании «Фотек» (Россия) и «Karl Storz» (Германия). Оперативные вмешательства выполняли под эндотрахеальным наркозом. Во время диагностической гистероскопии оценивали наличие внутриматочной патологии, аденомиоза и гиперпластического процесса эндометрия.
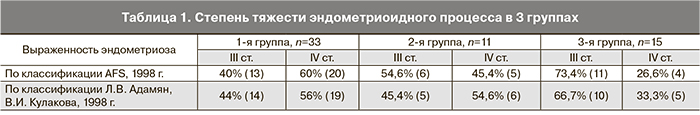
Во время лапароскопии проводили ревизию органов брюшной полости, визуальную и тактильную оценку эндометриоидного процесса с определением степени тяжести (по классификациям AFS, 1998 г., Л.В. Адамян, В.И. Кулаков, 1998 г.) с последующим его удалением. Также оценивали выраженность спаечного процесса в брюшной полости (по классификации J. Hulka, 1998 г.).
В 1-й и 2-й группе удаляли эндометриоидные кисты путем вылущивания по стандартной методике, эндометриоидные инфильтраты иссекали по технологии «Shaving» с применением монополярной и биполярной энергии. Ложе вылущенных кист и удаленного инфильтрата, а также поверхностные неинфильтративные очаги эндометриоза на брюшине, яичниках и кишечнике обрабатывали факелом аргоновой плазмы в режиме «Спрей». Использовали электрохирургический аппарат «ФОТЕК» ЕА-142 М. АПК подвергали стенку мочевого пузыря, стенку прямой и сигмовидной кишки при вовлечении их в эндометриоидный процесс, после удаления последнего, в том числе до и после наложения швов, восстанавливающих целостность поврежденного органа.
В 3-й группе иссекали эндометриоидные гетеротопии (эндометриоидных инфильтратов, кист яичников) «острым путем» и при помощи монополярной энергии, неинфильтративные гетеротопии коагулировали биполярными щипцами. При нарушении целостности смежных органов (мочевой пузырь, стенка прямой или сигмовидной кишки), в процессе удаления глубоких форм эндометриоза дефекты ушивали реабсорбируемой нитью.
В 1-й группе выполнено 6 повторных лапароскопий через 4–8 месяцев после медикаментозной терапии (одна из которых по неотложным показаниям).
В 2-й группе выполнено 9 повторных лапароскопических операций, через 4–8 месяцев (2 из которых по неотложным показаниям: апоплексия яичника на фоне отмены медикаментозной терапии). Показаниями для повторного оперативного лечения были: сохраняющийся болевой синдром, подготовка пациентки к ЭКО, диагностированный спаечный процесс органов малого таза (по данным УЗИ, гистеросальпингографии) и неотложные состояния (апоплексия яичника).
Все пациентки 3-й группы (n=15) подверглись повторной лапароскопии в период от 4 месяцев до 3 лет по различным показаниям, в том числе в связи с рецидивом эндометриоза.
Результаты исследования и обсуждение
Средний возраст пациенток (n=59) составил 30,6±1 год.
В 1-й группе болевой синдром наблюдался у 22 (66,6%) женщин, бесплодие как основная проблема – у 29 (87%), неоднократные оперативные вмешательства по поводу эндометриоза в анамнезе имели место у 9 (27%). Во 2-й группе болевой синдром наблюдался у 7 (63 %) женщин, бесплодие – у 8 (72%), неоднократные оперативные вмешательства по поводу рецидива эндометриоза в прошлом – у 7 (63%). В 3-й группе выраженный болевой синдром был у 9 (60,0%) женщин, бесплодие (первичное и вторичное) – у 7 (70,0 %), неоднократные операции по поводу эндометриоза – у 5 (33,3%).
Выраженность клинических проявлений эндометриоидного процесса была выше в 1-й группе, что подтвердилось данными, полученными во время оперативного вмешательства (табл. 1).
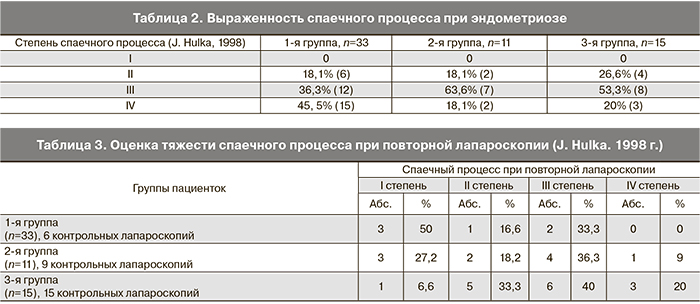
Для эндометриоза характерно формирование адгезивного процесса в малом тазу, тяжесть которого в 1-й группе также оказалась большей по классификации J. Hulka, 1998 г. (табл. 2).
В обеих группах выполнены оперативные вмешательства по удалению эндометриоза всех выявленных локализаций, в послеоперационном периоде назначалась противорецидивная терапия.
В качестве медикаментозной терапии выбирался препарат в зависимости от стадии и распространенности эндометриоидного процесса, также учитывалась заинтересованность пациентки в беременности в ближайшее время.
В 1-й группе исследуемых приоритет в медикаментозной терапии был отдан высокоселективному гестагену 4-го поколения – диеногест (2 мг) (курс терапии 4 месяца, ежедневно по 2 мг). Во 2-й группе всем женщинам в послеоперационном периоде были назначены агонисты ГнРГ (длительность 4–6 месяцев). В 3-й группе (ретроспективное исследование) у 15 женщин применялись агонисты ГнРГ (3–6 месяцев).
Клиническая оценка эффективности оперативного лечения в 1-й и 2-й группе проводилась через 5–7 месяцев после хирургического вмешательства, но не ранее чем через 1–2 месяца после окончания противорецидивной терапии. Эффективность лечения в 3-й группе исследуемых проанализирована в периоде от 6 месяцев до 2 лет после завершения противорецидивной терапии.
Эффективность комплексной терапии эндометриоза оценивалась на основании жалоб, бимануального и ректального исследования, УЗИ. Дополнительным аспектом в объективизации рецидива эндометриоза и эффективности противорецидивной терапии, а также выраженности послеоперационного спаечного процесса было повторное лапароскопическое вмешательство, выполненное у части пациенток во всех исследуемых группах.
В 1-й группе только у 1 пациентки (3%) зафиксирован рецидив (эндометриоидная киста); во 2-й группе у 1 пациентки (9%) отмечено прогрессирование эндометриоидной болезни. Клинические проявления и лапароскопическая картина эндометриоза при повторном обследовании зафиксирована у 5 (33.3%) пациенток 3-й группы, что у 2 (13,3%) расценено как рецидив, у 3 (20,0%) – как прогрессирование имевшегося ранее заболевания. Спаечный процесс у пациенток 1-й и 2-й групп был менее выражен, чем у пациенток 3-й группы (табл. 3).
В связи с тем, что у подавляющего большинства пациенток основными клиническими проявлениями были бесплодие и болевой синдром (хронические тазовые боли в сочетании с дисменореей, диспареуния), эффективность комплексного лечения с применением стандартных методик и АПК оценивали отсрочено. Наличие и степень выраженности болевого синдрома оценивали через 6–8 месяцев после операции, а восстановление фертильности – через 12–24 месяца.
К настоящему времени контрольный визит сделали 19 пациенток из 1-й группы и 9 пациенток из 2-й группы. В 1-й и 2-й группе болевой синдром отсутствовал у 12 (63,2%) и 6 (66,6%) пациенток соответственно. Незначительные боли сохранялись у 7 (38,8%) и 2 (11,1%) соответственно. Значительный болевой синдром сохранялся только у одной пациентки из 2-й группы. В 3-й группе исследуемых у 6 (40%) пациенток болевой синдром разной степени интенсивности сохранялся после оперативного лечения, только 5 (33,3%) пациенток указали на полное отсутствие болевого синдрома.
Из 19 отслеженных пациенток 1-й группы в течение 1 года после операции беременность наступила у 12 (63,2%) женщин, из них у 9 – спонтанная и у 3 – после ЭКО. Во 2-й группе беременность наступила у 4 (36,7%) женщин (2 после ЭКО). Остальные пациентки находятся на этапе прегравидарной подготовки и планирования беременности. В 3-й группе в течении 2 лет после операции спонтанная беременность наступила у 4 (26,6%). После повторного лапароскопического вмешательства по поводу рецидива эндометриоза, выполненного у 5 пациенток (все операции проведены с использованием АПК), беременность наступила у 3 женщин.
Представленные предварительные результаты показывают, что применение хирургического лечения с использованием АПК как первого этапа медицинской помощи и препаратов группы диеногеста (визанна 2 мг), так же как и агнонистов ГнРГ в качестве противорецидивной терапии пациенткам с тяжелыми формами генитального эндометриоза является оптимальным средством комплексной терапии данной патологии.
Выводы
Лечение тяжелого генитального эндометриоза предполагает сочетание хирургических и консервативных методов, направленных на одномоментную ликвидацию эндометриоидных очагов и подавление их прогрессивного роста; эффективность лечения зависит от полноценности удаления эндометриоидных инфильтратов в сочетании с противорецидивной терапией.
Применение препаратов группы диеногеста (визанна 2 мг) эффективно в качестве противорецидивной терапии после проведенного хирургического лечения тяжелых форм генитального эндометриоза.
Применение АПК на хирургическом этапе лечения эндометриоза обеспечивает эффективность оперативного лечения, минимизирует послеоперационный спаечный процесс, способствует успешной реализации репродуктивной функции и улучшает качество жизни пациенток.



