Синдром поликистозных яичников (СПКЯ) относится к числу наиболее распространенных эндокринных нарушений у женщин репродуктивного возраста. Традиционно для его диагностики используют Роттердамские критерии (2003 г.), согласно которым выделяют 4 репродуктивных фенотипа – три андрогенных (А, В и С) и один неандрогенный (Д). Целесообразность выделения неандрогенного фенотипа СПКЯ остается предметом научных дискуссий. Оптимизация критериев диагностики СПКЯ стала одной из ключевых тем конференции, организованной Национальным институтом здоровья США (2012). Роттердамские критерии были признаны как наиболее приемлемые для клинической практики и проведения научных исследований [1]. Частота фенотипа Д, согласно результатам популяционных исследований, варьирует от 15 до 23%, по обращаемости в лечебные учреждения – 40% [2]. По данным большинства исследований, частота инсулинорезистентности (ИР) и метаболического синдрома в 2–4 раза выше среди женщин с андрогенными фенотипами СПКЯ [3, 4]. Хотя в ряде работ не выявлено различий между фенотипами по индексу массы тела (ИМТ), частоте нарушения толерантности к глюкозе и других проявлений метаболического синдрома [5, 6]. Вопрос метаболических нарушений при различных фенотипах настолько неоднозначен, что можно найти данные и о более высокой частоте ИР при неандрогенном фенотипе СПКЯ [7, 8].
Считается, что ИР и гиперинсулинемия (ГИ) способствуют повышению продукции андрогенов клетками теки, снижению синтеза глобулина, связывающего половые стероиды (ПССГ), увеличению активных фракций андрогенов. Наряду с избытком андрогенов ГИ вносит существенный вклад в формирование нарушений фолликулогенеза как за счет усугубления гиперандрогении (ГА), так и путем стимуляции рецепторов к инсулину и инсулиноподобному фактору роста-1 [9].
Высокая частота ИР и ГИ, их роль в формировании СПКЯ послужила основанием для применения инсулиносенситайзеров. Наиболее изучено действие метформина (МФ), направленное на подавление глюконеогенеза в печени, снижение абсорбции глюкозы в кишечнике, увеличение ее доступности тканям, снижение секреции инсулина. Предполагают, что антиандрогенный эффект МФ достигается как опосредовано путем коррекции ГИ, так и напрямую путем подавления пролиферации клеток теки и снижения стероидогенеза в яичниках [10]. Механизмы коррекции овуляторной дисфункции МФ при СПКЯ рассматриваются не только с позиций уменьшения негативного влияния ГА на фолликулогенез, но и с позиций влияния на клетки гранулезы (восстановление чувствительности к ФСГ, повышение активности ароматазы) [11]. В связи с этим закономерно возникает вопрос о целесообразности назначения МФ не только при андрогенном, но и при неандрогенном фенотипе синдрома.
В связи с этим целью исследования стала оценка терапевтических эффектов МФ у пациенток с андрогенными и неандрогенным фенотипами СПКЯ.
Материал и методы исследования
Исследование, одобренное этическим комитетом, проводилось на базе отделения гинекологической эндокринологии ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Критериями включения были: возраст женщин от 18 до 35 лет, наличие СПКЯ (Роттердамские критерии, 2003 г.), незаинтересованность в гормональной контрацепции, отсутствие сопутствующей эндокринной и некомпенсированной экстрагенитальной патологии, отсутствие гормональной терапии в течение трех и более месяцев до вступления в исследование.
В исследование включены 143 женщины с СПКЯ (средний возраст 26,4±4,6 года, ИМТ 23,8±4,8 кг/м2). После клинико-лабораторного обследования были определены фенотипы синдрома. Фенотип А (ГА + олигоменорея (ОМ) + поликистозная трансформация яичников (ПКЯ) диагностирован у 90 (62,9%) женщин, фенотип В (ГА + ОМ) – у 4 (2,8 %), фенотип С (ГА + ПКЯ) – у 7 (4,9%), фенотип Д (ОМ + ПКЯ) – у 42 (29,4%). В соответствии с фенотипом СПКЯ участницы исследования были разделены на группы: 1-ю составила 101 (70,6%) пациентка с андрогенными фенотипами (А, В и С); 2-ю – 42 (29,4%) с неандрогенным фенотипом Д.
Исследование уровня ЛГ, ФСГ, общего и свободного тестостерона (Тобщ. и Тсв.), андростендиона (А), ПССГ, пролактина, ТТГ в сыворотке крови проводилось на 2–3-й день менструального цикла иммунохемилюминесцентным методом (анализатор Immulite 2000, Siemens, USA), уровня АМГ в сыворотке крови – методом ELISA (тест-система AMHGenIIELISA, BeckmanCoulter, USA). На 5–7-й день менструального цикла проводили ультразвуковое исследование органов малого таза с определением объема яичников (аппарат Toshiba SSA-240, Япония) трансвагинальным датчиком, частотой 7,5 Мгц. Контроль овуляции осуществлялся с помощью определения уровня прогестерона и/или ультразвукового исследования на 20–24-й день менструального цикла.
В рамках исследования проводили 2-часовой глюкозотолерантный тест (ГТТ) с 75 г глюкозы. Уровни глюкозы и иммунореактивного инсулина (ИРИ) определяли натощак, через 1 и 2 часа после нагрузки.
Всем пациенткам назначали МФ (глюкофаж лонг, MerckSante, Франция) в суточной дозе 1500 мг (с предварительным титрованием дозы). Все участницы исследования были проинформированы о возможности проведения альтернативной терапии.
Гормональное обследование, ГТТ и ультразвуковое исследование проводили исходно и через 6 месяцев терапии. Регуляцию менструального цикла (более 10 менструаций в год) или наступление самопроизвольной беременности расценивали, как полный эффект от терапии, положительную динамику в виде увеличения числа менструаций (менее 10 менструаций в год) – как частичный эффект, отсутствие регуляции цикла – как неэффективность терапии.
Эффективность терапии была оценена у 132 женщин (92,3%). Выбыли из исследования 11 женщин: 7 – исключены ввиду низкой комплаентности, 4 – в связи с нежелательными эффектами (в виде тошноты, диареи – 3 случая, в связи с обострением экземы – 1). В анализ влияния МФ на эндокринно-метаболические параметры не были включены 33 (23,1%) женщины, в связи с наступившей беременностью: 20 из 1-й группы и 13 из 2-й группы.
Статистический анализ проводили с помощью программы SPSS (IBM Statistical Package for the Social Sciences, 21-я версия). Количественные показатели представлены в виде средних, сравнение производилось с помощью t-критерия Стьюдента, t-критерия для парных выборок и с помощью U-теста Манна–Уитни. Метод Спирмена был использован для выявления корреляций. Cтатистически значимыми считали результаты при достижении уровня ошибки p<0,05.
Результаты исследования
Пациентки обеих групп были сопоставимы по возрасту: в 1-й группе он составил 25,9±3,9 года; во 2-й – 26,8±5,3 года (p>0,05). Не было различий и по массо-ростовым показателям: в 1-й группе ИМТ составил – 23,8±4,8 кг/м2; во 2-й – 22,9±6,1 кг/м2 (p>0,05). Частота избыточной массы тела или ожирения среди пациенток в 1-й группе составила 32,7%, во 2-й – 26,2% (p>0,05).
Избыточный рост волос отмечен у 75 (74,2%) пациенток с андрогенными фенотипами СПКЯ. Из числа заинтересованных в беременности женщин 1-й группы жалобы на бесплодие предъявляли 48 (77,4%) женщин, во 2-й – 17 (65,4%), p>0,05. Не установлены межгрупповые различия по среднему возрасту менархе и возрасту манифестации ОМ (p>0,05). В 1-й группе первичная ОМ была диагностирована у 83 (82,2%) пациенток, во 2-й группе – у 38 (90,4%, p>0,05). Частота вторичной ОМ составила 18 (17,8%) и 4 (9,5%) соответственно (p>0,05). Однако при андрогенных фенотипах реже наблюдались задержки менструаций до 1 месяца (10,9 и 26,2% соответственно, p<0,05) и чаще – задержки от 3 до 6 месяцев (36,6 и 16,7% соответственно, p<0,05).
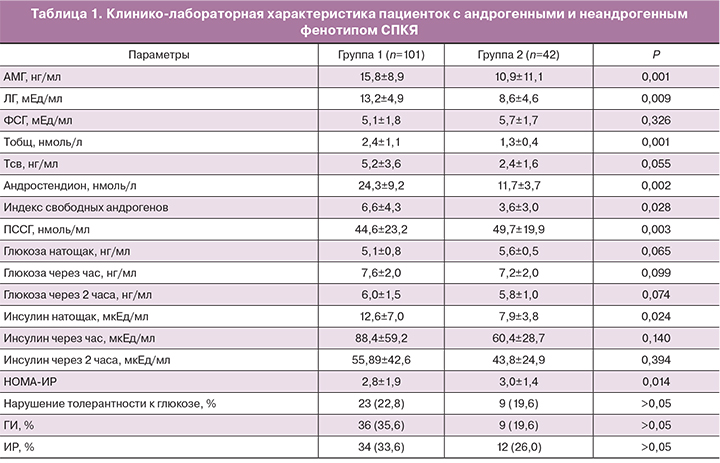
В группе с андрогенными фенотипами СПКЯ средние уровни ЛГ и андрогенов (Тобщ, Тсв, А) были выше (p<0,05), уровень ПССГ имел тенденцию к снижению, что отразилось на повышении индекса свободных андрогенов (p<0,05) (табл. 1). Средний уровень АМГ также оказался более высоким в группе с андрогенными фенотипами СПКЯ (p<0,05), хотя превышал пороговые значения в 97% случаев в 1-й группе и в 95,6% – во 2-й (p>0,05). Различий по объему яичников не получено (в 1-й группе: средний объем правого яичника – 16,8±6,6 см3, левого – 15,4±3,3 см3, во 2-й группе – 14,4±4,4 см3 и 13,8±3,8 см3 соответственно, p>0,05).
Группы были сопоставимы по среднему уровню глюкозы натощак и на фоне ГТТ (p>0,05). В группе с андрогенными фенотипами синдрома нарушение толерантности к глюкозе выявлено у 23 (22,8%) пациенток, в группе с неандрогенным фенотипом – у 9 (19,6%), р>0,05. Средние уровни инсулина натощак и через час после нагрузки были выше в 1-й группе, частота ГИ превышала таковую во 2-й группе в 2 раза (35,6 и 19,2%).
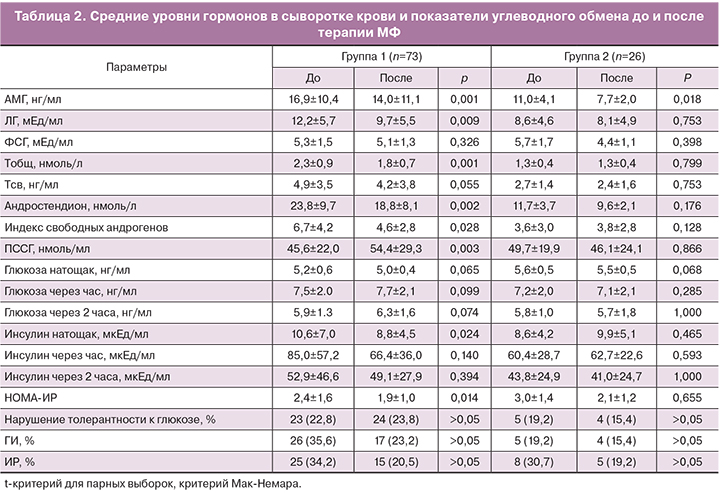
После 6 месяцев терапии выявлены различия между группами в динамике ряда гормональных показателей (табл. 2). В 1-й группе отмечено достоверное снижение ЛГ, Тобщ, А, индекса свободных андрогенов и повышение уровня ПССГ (p<0,05). К концу курса терапии уровень Тобщ не превышал нормативных значений у 72,6% пациенток, уровень А – у 53,4%. У 42,5% женщин наблюдалась полная коррекция биохимической ГА. Во 2-й группе существенной динамики указанных показателей не отмечено. Средний уровень АМГ достоверно снизился в обеих группах (р<0,05), хотя по-прежнему превышал пороговое значение у 67 (91,8%) женщин 1-й группы и у 26 (92,3%) 2-й группы.
После шестимесячного курса терапии МФ уровень глюкозы натощак и на фоне ГТТ в обеих группах существенно не изменился, частота нарушенной толерантности к глюкозе осталась без динамики (р>0,05) (табл. 2). Снижение среднего уровня инсулина натощак и индекса НОМА наблюдалось только в группе с андрогенными фенотипами. Частота ГИ снизилась с 35,6 до 23,2%, ИР – с 34,2 до 20,5%. При неандрогенном фенотипе СПКЯ эти показатели составили 19,2 и 15,4%, 30,7 и 19,2% соответственно. Снижение веса наблюдалось у 63,0% женщин 1-й группы (на 2,9±0,8 кг) и у 61,5% женщин 2-й группы (на 3,4±1,1 кг).
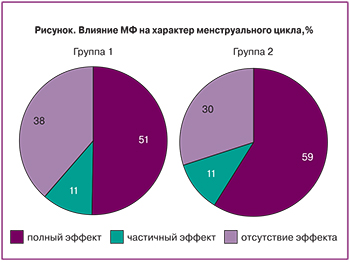
Восстановление регулярного ритма менструаций было достигнуто примерно у каждой 2-й пациентки, независимо от фенотипа СПКЯ, частичный эффект (увеличения числа менструаций) – у каждой десятой пациентки (рисунок). Терапия оказалась неэффективной у 38% пациенток 1-й группы и у 30% – 2-й (р>0,05).
В целом, на фоне терапии беременность наступила у 33 из 88 женщин, в ней заинтересованных, что составило 37,5%. В течение первых 3 месяцев терапии беременность наступила в 87,9% случаев. Из 62 женщин с ГА, заинтересованных в беременности, она наступила у 20 (32,3%), в группе с неандрогенным фенотипом СПКЯ – у 13 (50%) из 26, планирующих беременность (р>0,05).
В 15,1% случаев беременность закончилась самопроизвольным выкидышем до 12 недель гестации, в 3% – фармацевтическим абортом по желанию женщины, в 3% имела место трубная беременность. Закончились родами 22 беременности. Не установлено различий по частоте самопроизвольных выкидышей (в 1-й группе – 15,0%, во 2-й – 15,4%) и частоте живорождений (75,0 и 84,6%) (р>0,05).
Анализ гестационных осложнений показал, что у 4 (12,1%) женщин была диагностирована истмико-цервикальная недостаточность (3 случая в 1-й группе и 1 – во 2-й), потребовавшая хирургической коррекции. Гестационный сахарный диабет развился у 4 (12,1%) беременных, гестационная артериальная гипертензия – у 3 (9%), умеренная преэклампсия – у 2 (6%) беременных. Средняя прибавка массы тела за беременность в 1-й группе составила 12,4±5,9 кг, во 2-й – 9,1±4,2 кг (р>0,05). Роды через естественные родовые пути произошли у 15 (68,2%) женщин, путем операции кесарева сечения – у 7 (31,8%, 4 – в 1-й группе, 3 – во 2-й). Из них в 2 случаях – в связи с гипоксией плода в родах, в 2 – с рубцом на матке после предшествующего кесарева сечения, в 2 – с тазовым предлежанием плода, в 1 – с миопией высокой степени. Рождены 22 живых ребенка с оценкой по шкале Апгар 7–9 баллов, средним весом 3277,8±387 г, из них один – с массой тела 4140 г, один – 2246 г (рожден на 34-й неделе гестации). Осложнений в послеродовом и раннем неонатальном периоде не было, все дети выписаны домой на 5–7-е сутки в удовлетворительном состоянии.
Обсуждение
Гетерогенность клинических, биохимических и морфологических проявлений СПКЯ существенно затрудняет его диагностику и разработку оптимальных схем терапии. Хотя эксперты Международного общества гиперандрогенных состояний рассматривают ГА как обязательный признак СПКЯ, подавляющее большинство использует Роттердамские критерии 2003 года. Они позволяют диагностировать синдром на основе даже 2 признаков (при отсутствии овуляторной дисфункции или ГА). Исходя из этого принято выделять: классический (А), ановуляторный (В), овуляторный (С) и неандрогенный (Д) фенотипы СПКЯ. По сводным данным доля неандрогенного фенотипа варьирует от 13,0 до 38,7% [2], согласно результатам нашего исследования – 30%. Наиболее распространенным оказался фенотип А – 62,9%, фенотипы В и С встречались в 2,8 и 4,9% случаев. Эта закономерность прослеживается в ряде исследований, где показатели рассчитывались по обращаемости пациенток в клиники. Андрогенные фенотипы СПКЯ часто связывают с более выраженными репродуктивными и метаболическими нарушениями. Согласно полученным данным, пациентки с ГА имели более длительные задержки менструаций; различий по времени дебюта заболевания, частоте аменореи, длительности бесплодия не установлено (p>0,05). Для пациенток 1-й группы была характерна гиперсекреция ЛГ и закономерное повышение уровней андрогенов, как одни из механизмов формирования овуляторной дисфункции [12, 13]. Различие между фенотипами было выявлено и по среднему уровню АМГ. Он оказался достоверно более высоким в группе с ГА, хотя в обеих группах более 90% пациенток имели уровни АМГ, превышающие пороговый. В исследованиях R. Homburg (2017) и S.L. Jacob (2017) также приводятся данные о более высоком уровне АМГ при андрогенных фенотипах СПКЯ; вместе с тем по другим данным существенных различий не установлено [14, 15].
 Проведено много исследований по изучению метаболических особенностей различных фенотипов СПКЯ. По данным ряда исследований частота ИР, нарушенной толерантности к глюкозе и метаболического синдрома в 2–4 раза выше среди женщин с андрогенными фенотипами СПКЯ [3, 4, 16].
Проведено много исследований по изучению метаболических особенностей различных фенотипов СПКЯ. По данным ряда исследований частота ИР, нарушенной толерантности к глюкозе и метаболического синдрома в 2–4 раза выше среди женщин с андрогенными фенотипами СПКЯ [3, 4, 16].
В то же время в других работах указывается на отсутствие существенных различий [17] или даже на более высокий риск развития ИР при фенотипе Д [18, 19]. Согласно полученным данным, фенотип Д оказался метаболически более благоприятным, о чем свидетельствует более низкая частота ГИ и нарушений толерантности к глюкозе.
Учитывая важную роль ИР, ГИ в формировании СПКЯ, а также данные о положительном эффекте инсулинсинсетайзеров на репродуктивную функцию, закономерно возникает вопрос о разработке дифференцированного подхода к назначению МФ при разных фенотипах синдрома. С этой целью проведено исследование по оценке эффективности терапии МФ у больных с андрогенными и неандрогенным фенотипами СПКЯ. Снижение уровня ЛГ после 6 месяцев приема МФ наблюдалось только в группе с ГА. Считается, что эффект МФ на функциональное состояние гипофизарно-яичниковой системы может опосредоваться путем снижения амплитуды пиков ЛГ и секреции андрогенов, независимо от восстановления чувствительности тканей к инсулину [20, 21].
На фоне МФ содержание Тобщ снизилось на 21,7%, А – на 21,0%. У 43,2% пациенток 1-й группы наблюдалась полная коррекция биохимической ГА, а также уменьшение биодоступности андрогенов за счет повышения синтеза ПССГ. При фенотипе Д средние уровни ЛГ, Т, А, ПССГ существенно не менялись. Очевидно, это связано с отсутствием исходной ГА и более низким уровнем ЛГ. Особого внимания заслуживает динамика уровня АМГ. Его снижение наблюдалось в обеих группах. Однако при неандрогенном фенотипе СПКЯ уровень АМГ понизился в среднем на 30%, при андрогенных – лишь на 14,8% (р>0,05). К сожалению, нам не удалось найти данных других исследований о реакции АМГ на терапию МФ при разных фенотипах синдрома. К числу же первых публикаций о влиянии МФ на уровень АМГ при СПКЯ относится исследование Piltonen (2005). Значимое снижение АМГ наблюдалось вне зависимости от дозы МФ (1000 мг/сут или 1500 мг/сут). Схожие результаты представлены в ряде других работ, при назначении МФ в дозах 1700 мг в сутки (Falbo) и 2550 мг в сутки (Fleming). Есть публикации и об отсутствии влияния МФ на уровень АМГ [21, 22]. Полученные нами данные о снижении содержания АМГ можно объяснить ингибирующим эффектом МФ на активность клеток гранулезы, опосредованным нормализацией секреции инсулина [23]. Возможны и другие механизмы действия МФ на клетки гранулезы, в частности, за счет снижения продукции провоспалительных факторов через АМФК-зависимые пути. Не исключают также ткане-специфическое действие МФ, опосредованное избирательной нормализацией активности митохондрий в клетках гранулезы [24].
Влияние МФ на основные показатели углеводного обмена несколько различалось при андрогенных и неандрогенном фенотипах СПКЯ. Так, если уровень глюкозы (натощак и на фоне ГТТ) в обеих группах не изменился, то снижение инсулина наблюдалось только в группе с ГА. Это подтверждает роль ГИ и ИР в генезе андрогенемии при СПКЯ.
Наиболее интересными и важными с практической точки зрения представляются данные о возможности восстановления фертильности на фоне монотерапии МФ. Эффект оказался сопоставимым в обеих группах. Восстановление регулярного ритма менструаций при андрогенном фенотипе СПКЯ было достигнуто в 50,5% случаев, при неандрогенном – в 59%, несмотря на отсутствие ГА и меньшую частоту ГИ. Можно сделать предположение о различии механизмов действия МФ при разных фенотипах синдрома. При андрогенных формах коррекция функции репродуктивной системы, вероятно, происходит преимущественно за счет нормализации секреции гонадотропинов, инсулина и снижения андрогенной активности. При неандрогенном фенотипе терапевтический эффект, очевидно, достигается в основном за счет уменьшения активности клеток гранулезы, снижения высоких уровней АМГ и его негативного влияния на созревание фолликулов.
Частота наступления беременности на фоне монотерапии МФ составила 37,5% (при андрогенных фенотипах – 32,3%, при неандрогенном – 50%). Это сопоставимо с эффективностью непрямых индукторов овуляции (кломифена цитрата и летрозола) [25]. Анализ гестационных осложнений свидетельствует об осложненном течении беременности. Частота гестационного сахарного диабета составила 18,2%, что несколько превышает популяционные показатели (7–14%) [26] и соответствует показателям заболеваемости для женщин с СПКЯ – 20–40% [27]. Не установлено существенных различий по частоте преэклампсии (6%) и артериальной гипертензии (9%) по сравнению с данными европейских авторов – 8 и 12% соответственно [28].
Частота прерывания беременности на ранних сроках при СПКЯ по данным лонгитюдинального австралийского исследования здоровья женщин составляет 20%, согласно представленным данным – 15%. Не удалось установить значительных различий между фенотипами СПКЯ по частоте живорождений, неблагоприятных исходов и осложнений беременности. Возможно, это связано с относительно небольшим числом беременных женщин в каждой из анализируемых групп, поскольку в ряде зарубежных исследований представлены данные о более высокой частоте гестационных осложнений при андрогенных фенотипах [29].
Актуальным и нерешенным остается вопрос оптимальной длительности терапии МФ. Его решение во многом определяется репродуктивными планами. Почти в 90% случаев беременность наступает в первые 3 месяца приема препарата. При отсутствии эффекта целесообразно дополнительное назначение индукторов овуляции. У пациенток, не заинтересованных в беременности и нежелающих принимать комбинированные оральные контрацептивы, сохранение ГА после 6 месяцев МФ обосновывает проведение более длительных курсов терапии.
Заключение
На основании результатов проведенного исследования можно сделать заключение, что терапию МФ (1500 мг/сутки) можно рассматривать в качестве эффективного подхода к коррекции овуляторной дисфункции как у пациенток с андрогенными фенотипами СПКЯ, так и с неандрогенным. В результате лечения у каждой второй пациентки можно ожидать восстановление регулярного ритма менструаций, у каждой третьей – наступления беременности, как правило, в первые 3 месяца терапии. Для повышения эффективности и разработки дифференцированных подходов к терапии, представляется актуальным поиск клинико-лабораторных и молекулярно-генетических предикторов ответа на терапию МФ.



