Вирилизирующие опухоли яичников представляют собой редкую группу новообразований стромы и/или полового тяжа, которая включает стероидноклеточные опухоли, сертоли-стромальноклеточные опухоли, смешанные и неклассифицированные опухоли стромы полового тяжа. Вирилизирующие опухоли яичников встречаются у менее 1% больных с опухолями яичников, новообразования из клеток Сертоли–Лейдига развиваются еще реже: по данным разных авторов, они составляют менее 0,2–0,5% всех опухолей яичников и около 1% всех опухолей стромы и/или полового тяжа [1–6].
Важной клинической особенностью вирилизирующих новообразований яичников является способность данных опухолей секретировать андрогены, под воздействием которых происходит дефеминизация женского организма: нарушается менструальный цикл (в репродуктивном возрасте), развиваются гипертрофия клитора, атрофия молочных желез, гирсутизм, огрубение голоса, алопеция, акне. В то же время следует отметить, что при опухолях из клеток Сертоли–Лейдига вирильный синдром встречается только у трети пациенток, в 50% клинических наблюдений развитие эндокринной симптоматики не отмечено [7]. У некоторых пациенток наблюдается эстрогенная манифестация, проявляющаяся менометроррагией, постменопаузальными кровотечениями, гиперпластическими процессами эндометрия [8, 9]. Ввиду этого такие ранее принятые названия для опухолей из клеток Сертоли–Лейдига, как арренобластомы или андробластомы, целесообразнее не использовать [7].
По данным различных исследований, опухоли из клеток Сертоли–Лейдига могут встречаться как в молодом возрасте, так и в постменопаузе. В большинстве случаев (75%) заболевание развивается у молодых женщин до 30 лет (средний возраст 23–25 лет). Развитие опухолей у женщин старше 50 лет встречается в 10% наблюдений [5, 9–12]. Как сообщается в литературе, в постменопаузе диагностика вирильного синдрома затруднительна ввиду того, что клиническая симптоматика может быть обусловлена не только андрогенпродуцирующими опухолями яичников или надпочечников, но и естественными гормональными изменениями – снижением секреции эстрогенов, более медленным уменьшением продукции андрогенов, секреция которых сохраняется даже в постменопаузе [11, 13],
В большинстве наблюдений данный вид опухолей имеет одностороннюю локализацию, в редких случаях (2–3%) – двустороннее поражение яичников [5, 9]. Макроскопически опухоли из клеток Сертоли–Лейдига чаще всего являются солидными или кистозно-солидными, реже – кистозными [8, 14]. Средние размеры новообразований составляют 12–14 см, однако размеры опухоли могут варьировать от микроскопических до гигантских (35 см в диаметре) [8]. В 2002 г. R.H. Young и R.E. Scully предложили классификацию опухолей из клеток Сертоли–Лейдига, которая используется до настоящего времени и включает 6 подтипов новообразований: высоко-, умеренно- и низкодифференцированные, с гетерологическими компонентами, сетевидные (или ретиформные) и смешанные [8].
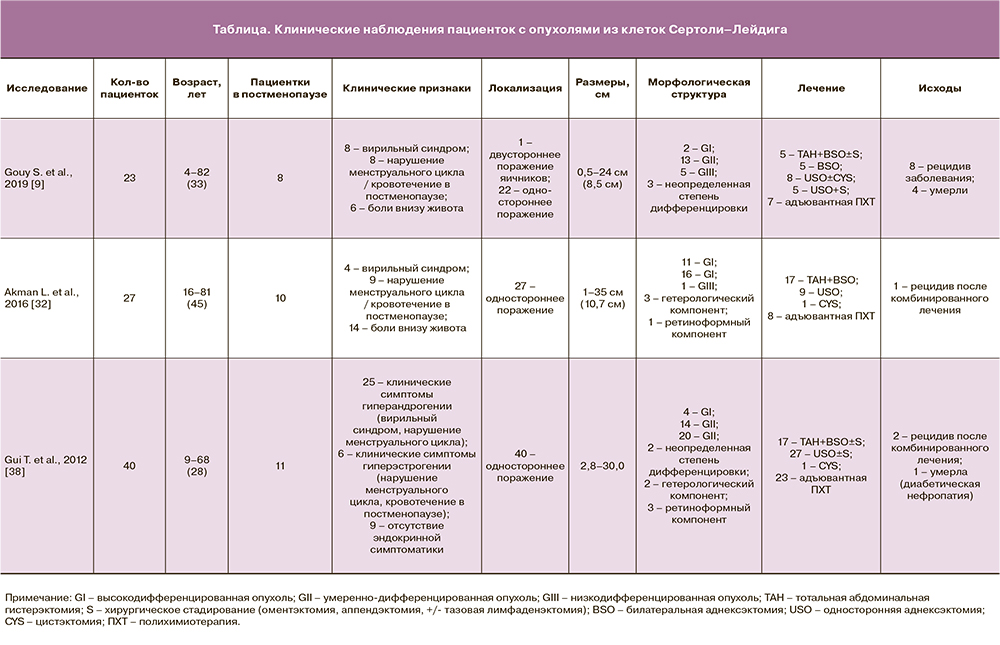
Редкое распространение данных опухолей из клеток Сертоли–Лейдига подтверждается клиническими исследованиями, представленными в зарубежной и отечественной литературе (таблица). В большинстве случаев публикации представляют клинические наблюдения (case report) [5, 11, 15–29], в том числе включающие пациенток в постменопаузе [5, 11, 16–20]. Реже встречаются публикации o небольшой когорте пациенток с опухолями из клеток Сертоли–Лейдига (от 7 до 54 наблюдений) [6, 9, 30–38].
Редкая встречаемость данных опухолей требует тщательного подхода к диагностическому поиску. Необходимо проводить дифференциальную диагностику с рядом заболеваний, имеющих сходные клинико-морфологические характеристики, в частности с опухолью желточного мешка, сертолиформной эндометриоидной аденокарциномой, злокачественной смешанной мезодермальной опухолью [8]. Для диагностики опухолей Сертоли–Лейдига показано проведение гормонального исследования: определение сывороточного уровня тестостерона, дегидроэпиандростерона, дегидроэпиандростерон-сульфата, 17-гидроксипрогестерона, кортизола [8]. Исследование онкомаркеров показано при любых опухолях яичников; для диагностики неэпителиальных новообразований целесообразно применять СА-125, Не4, ингибин В, α-фетопротеин, β-хорионический гонадотропин человека [8, 39]. Ультразвуковое исследование, компьютерная томография и магнитно-резонансная томография (МРТ) включены в спектр инструментальных методов обследования больных опухолями стромы и/или полового тяжа [8, 39]. Отличительными особенностями МРТ опухолей Сертоли–Лейдига являются такие характеристики, как солидная структура образований, наличие ровных четких контуров, возможное наличие кистозной трансформации, накопление контрастного препарата мягкотканным компонентом [39].
В большинстве наблюдений опухоли стромы полового тяжа являются доброкачественными новообразованиями, и только у 7% больных развиваются злокачественные формы опухолей [39]. Метастазирование опухоли чаще всего происходит имплантационным способом. Имеются редкие сообщения о лимфогенном и гематогенном метастазировании в отдаленные органы: легкие, печень, кожу головы и надключичные лимфатические узлы [8, 39]. Для оценки выживаемости пациенток с опухолями из клеток Сертоли–Лейдига используют такие параметры, как степень дифференцировки, стадия, митотическая активность, наличие разрывов капсулы опухоли и гетерологических мезенхимальных элементов. Сообщается, что 5-летняя выживаемость пациенток с опухолями из клеток Сертоли–Лейдига составляет около 70–90% [8].

Наиболее эффективным методом лечения опухолей стромы полового тяжа по-прежнему остается хирургический (рис. 1) [39]. При начальных стадиях заболевания, молодом возрасте пациенток и одностороннем поражении преимущество отдается органосохраняющему лечению: удалению придатков матки с сохранением контралатерального яичника и матки. Женщинам в постменопаузе и больным с распространенными стадиями заболевания показано выполнение гистерэктомии с придатками, удаление большого сальника, хирургическое стадирование. При одностороннем поражении яичника, сохранении целостности капсулы образования, отсутствии опухолевых клеток в асцитической жидкости или смывах из брюшной полости и сосочковых разрастаний по наружной поверхности опухоли (IA стадия) отмечается благоприятное течение заболевания, что не требует проведения послеоперационной химиотерапии.
При опухолях из клеток Сертоли–Лейдига с низкой степенью дифференцировки или с наличием гетерологичных элементов, начиная с I стадии, целесообразно проводить адъювантную химиотерапию. Рекомендуется определять митотический индекс опухоли, при высоких значениях показана химиотерапия.
Клиническое наблюдение
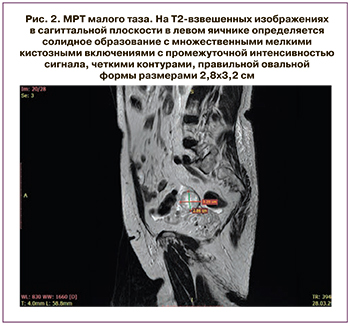 Пациентка Л., 80 лет, проходила комплексное обследование и лечение в ГБУЗ «Московский клинический научный центр имени А.С. Логинова» (МКНЦ). В 2018 г. в клинике женского здоровья МКНЦ имени А.С. Логинова у пациентки диагностирован рак правой молочной железы pT2(m)N0M0, IIA стадия, люминальный тип B, Her-2-негативный. В октябре 2018 г. выполнено хирургическое лечение в объеме радикальной мастэктомии справа по Маддену и проведена последующая гормональная терапия с использованием ингибитора ароматаз анастрозола. Гинекологом по данным ультразвукового исследования диагностирован гиперпластический процесс эндометрия, кистозное образование левого яичника. Учитывая высокий риск злокачественной патологии, было выполнено комплексное обследование. На первом этапе произведены гистероскопия, раздельное выскабливание цервикального канала и полости матки. По данным морфологического исследования: железисто-фиброзный полип эндометрия без атипии. Выполнена МРТ органов малого таза, при которой подтвердилось солидное образование левого яичника диаметром 33 мм, накапливающее контрастный препарат (рис. 2).
Пациентка Л., 80 лет, проходила комплексное обследование и лечение в ГБУЗ «Московский клинический научный центр имени А.С. Логинова» (МКНЦ). В 2018 г. в клинике женского здоровья МКНЦ имени А.С. Логинова у пациентки диагностирован рак правой молочной железы pT2(m)N0M0, IIA стадия, люминальный тип B, Her-2-негативный. В октябре 2018 г. выполнено хирургическое лечение в объеме радикальной мастэктомии справа по Маддену и проведена последующая гормональная терапия с использованием ингибитора ароматаз анастрозола. Гинекологом по данным ультразвукового исследования диагностирован гиперпластический процесс эндометрия, кистозное образование левого яичника. Учитывая высокий риск злокачественной патологии, было выполнено комплексное обследование. На первом этапе произведены гистероскопия, раздельное выскабливание цервикального канала и полости матки. По данным морфологического исследования: железисто-фиброзный полип эндометрия без атипии. Выполнена МРТ органов малого таза, при которой подтвердилось солидное образование левого яичника диаметром 33 мм, накапливающее контрастный препарат (рис. 2).
В динамике отмечено увеличение онкомаркеров: СА-125 – с 9,5 Ед/мл до 39,2 Ед/мл, Не4 – с 97,6 пмоль/л до 120,8 пмоль/л, индекса ROMA – c 15,7% до 41,1%. При компьютерной томографии брюшной полости и грудной клетки данных за вторичное поражение не выявлено.

При осмотре пациентки обращали на себя внимание клинические признаки вирилизации: гирсутизм, снижение тембра голоса, алопеция, увеличение клитора (рис. 3а, б). Клинические признаки вирилизации подтверждались повышенным уровнем тестостерона в крови до 10 нмоль/л (норма – до 1,24 нмоль/л). Со слов пациентки, увеличение роста волос на лице, груди, бедрах, облысение отмечала в течение последних 10 лет, однако у гинеколога длительно не наблюдалась.
Необходимо отметить, что у пациентки имел место отягощенный соматический анамнез: ишемическая болезнь сердца, атеросклеротический кардиосклероз, гипертоническая болезнь III стадии, персистирующая форма фибрилляций предсердий, в связи с которой проводилась постоянная антиаритмическая, антикоагулянтная терапия с использованием антикоагулянтного препарата непрямого типа действия варфарина.
 Учитывая данные комплексного клинико-инструментального обследования, которые не позволяли исключить злокачественную опухоль яичника, отягощенный соматический анамнез, был проведен онкологический консилиум. Принято решение выполнить хирургическое лечение по жизненным показаниям. На предоперационном этапе проведено тщательное дообследование пациентки (электрокардиография, эхокардиография, ультразвуковое исследование вен нижних конечностей, консультация сосудистого хирурга, кардиолога, клинико-лабораторный контроль, коррекция антикоагулянтной терапии). Выполнено хирургическое лечение в объеме лапароскопии, гистерэктомии с придатками с двух сторон, оментэктомии. Длительность операции составила 180 минут, кровопотеря – 150 мл. Послеоперационный период протекал без осложнений. Пациентка в удовлетворительном состоянии выписана под наблюдение врача женской консультации и онколога на 5-е сутки после операции.
Учитывая данные комплексного клинико-инструментального обследования, которые не позволяли исключить злокачественную опухоль яичника, отягощенный соматический анамнез, был проведен онкологический консилиум. Принято решение выполнить хирургическое лечение по жизненным показаниям. На предоперационном этапе проведено тщательное дообследование пациентки (электрокардиография, эхокардиография, ультразвуковое исследование вен нижних конечностей, консультация сосудистого хирурга, кардиолога, клинико-лабораторный контроль, коррекция антикоагулянтной терапии). Выполнено хирургическое лечение в объеме лапароскопии, гистерэктомии с придатками с двух сторон, оментэктомии. Длительность операции составила 180 минут, кровопотеря – 150 мл. Послеоперационный период протекал без осложнений. Пациентка в удовлетворительном состоянии выписана под наблюдение врача женской консультации и онколога на 5-е сутки после операции.
Интраоперационно левые придатки матки были направлены на срочное гистологическое исследование, при котором было установлено, что морфологическая картина наиболее всего соответствует опухоли стромы и полового тяжа, выраженной ядерной атипии и митозов не выявлено (рис. 4).
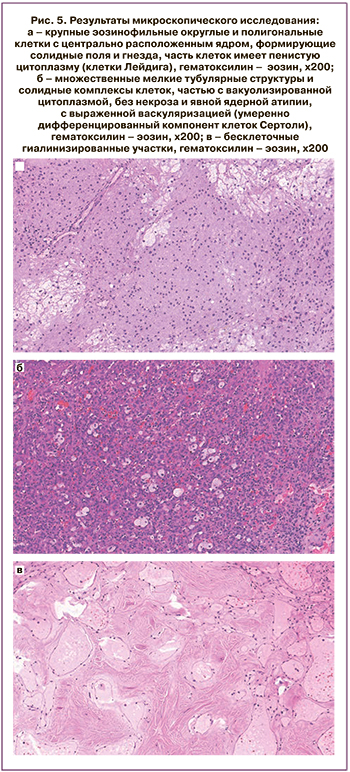 Для рутинного гистологического исследования материал был фиксирован 10% нейтральным формалином в течение 24 ч, парафином, далее готовили срезы толщиной 4–5 мкм, окрашивали гематоксилином и эозином. Результаты микроскопического исследования свидетельствовали о том, что опухоль представлена двумя компонентами. Первый компонент состоял из клеток, напоминающих клетки Лейдига, крупных эозинофильных округлых и полигональных клеток с центрально расположенным ядром, формирующих солидные поля и гнезда, часть клеток имела пенистую цитоплазму (рис. 5а). Второй компонент состоял из умеренно-дифференцированных структур клеток Сертоли, множественных мелких тубулярных структур и солидных комплексов клеток, частью с вакуолизированной цитоплазмой, без некроза и явной ядерной атипии, с выраженной васкуляризацией (рис. 5б). Также выявлены множественные бесклеточные гиалинизированные участки (рис. 5в). На основании клинических, макроскопических и микроскопических данных был поставлен гистологический диагноз опухоли из клеток Сертоли–Лейдига, умеренной дифференцировки (смешанной опухоли стромы и полового тяжа).
Для рутинного гистологического исследования материал был фиксирован 10% нейтральным формалином в течение 24 ч, парафином, далее готовили срезы толщиной 4–5 мкм, окрашивали гематоксилином и эозином. Результаты микроскопического исследования свидетельствовали о том, что опухоль представлена двумя компонентами. Первый компонент состоял из клеток, напоминающих клетки Лейдига, крупных эозинофильных округлых и полигональных клеток с центрально расположенным ядром, формирующих солидные поля и гнезда, часть клеток имела пенистую цитоплазму (рис. 5а). Второй компонент состоял из умеренно-дифференцированных структур клеток Сертоли, множественных мелких тубулярных структур и солидных комплексов клеток, частью с вакуолизированной цитоплазмой, без некроза и явной ядерной атипии, с выраженной васкуляризацией (рис. 5б). Также выявлены множественные бесклеточные гиалинизированные участки (рис. 5в). На основании клинических, макроскопических и микроскопических данных был поставлен гистологический диагноз опухоли из клеток Сертоли–Лейдига, умеренной дифференцировки (смешанной опухоли стромы и полового тяжа).
Пациентка продолжила наблюдение и лечение у онколога. При контрольном обследовании через 6 и 12 месяцев данных за рецидив заболевания не получено. При клинико-лабораторном контроле отмечена нормализация уровня тестостерона до 0,177 нг/мл (норма – 0,408 нг/мл).
Заключение
Таким образом, представленное клиническое наблюдение является особенно интересным ввиду крайне редкой распространенности опухолей из клеток Сертоли–Лейдига и еще более редкой встречаемости данных опухолей в пожилом возрасте и в сочетании со злокачественной опухолью молочной железы. В нашем наблюдении своевременная диагностика опухоли Сертоли–Лейдига была затруднительна ввиду совпадения симптомов вирилизации и клинических проявлений гипоэстрогенемии и гиперандрогении в постменопаузе. Мультидисциплинарный поход и тщательная предоперационная подготовка позволили успешно выполнить хирургическое лечение у пациентки 80 лет с отягощенным соматическим и онкологическим анамнезом.



