Среди множества эхографических маркеров хромосомной патологии плода, наибольшее прогностическое значение имеет увеличение толщины воротникового пространства – ТВП [1, 2]. Наличие этого маркера нельзя рассматривать как показание к прерыванию беременности, что нередко наблюдается в акушерской клинике. Это лишь основание для проведения инвазивной пренатальной диагностики кариотипа плода, который может быть как нормальным, так и патологическим [3]. Однако даже при нормальном хромосомном наборе (по данным цитогенетического анализа) возможно рождение ребенка с врожденной или наследственной патологией. Поэтому для повышения эффективности пренатальной диагностики назрела необходимость дополнительного использования арсенала современных методов, чтобы установить нарушения, которые не выявляют классические способы. В настоящее время разработана методика сравнительной геномной гибридизации на биочипах (aCGH), которая позволяет определять делеции или дупликации генетического материала размером от 400 тысяч пар нуклеотидов (п.н.), то есть изменения в 20 раз меньше, чем выявляемые стандартным кариотипированием [4]. Отмечено, однако, что изолированное увеличение ТВП плода при отсутствии у него пороков развития может не быть связанным с микрохромосомными аномалиями [5].
Целью настоящего исследования стало определение значения увеличенной толщины воротниковой области плода в диагностике анеуплоидий.
Материал и методы исследования
Безвыборочно обследованы 265 женщин с одноплодной беременностью. Критерием включения явилось наличие у плода ТВП 2 мм и более, изолированное или в сочетании с другими особенностями его фенотипа, выявленное при ультразвуковом исследовании (УЗИ) в I триместре беременности. Группу сравнения составила 21 беременная, в которой она или супруг являлись носителем хромосомных аномалий или генных мутаций. Обследование осуществляли с 11 недель беременности (рис. 1): скрининг I и II триместра беременности – эхография, исследование сывороточных маркеров, компьютерный и цитогенетический анализ; сравнительная геномная гибридизация и инвазивные внутриматочные вмешательства с целью получения хориона, плаценты, амниотической жидкости – в 11–14 недель (232 наблюдения) или в 17-20 (33 наблюдения) недель.
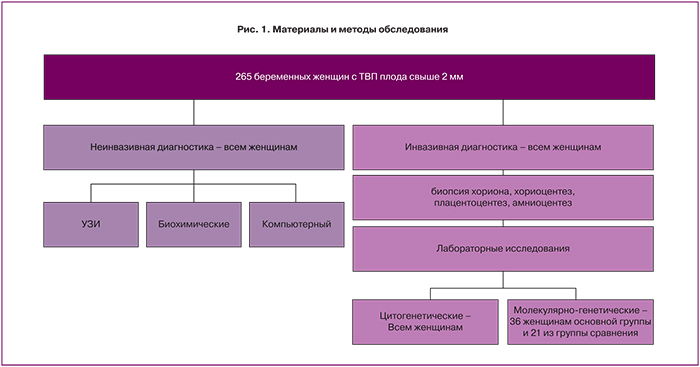
Внутриматочные вмешательства выполнили у всех беременных по технологиям, разработанным ранее [6, 7].
Цитогенетический анализ проведен во всех наблюдениях. Он включал исследование кариотипа по стандартной методике с использованием G-окрашивания хромосом [8].
 Методом aCGH в соответствии с протоколом производителя обследовано 57 женщин в сроке беременности 11–15 недель: 36 – основной группы и 21 – группы сравнения. Начинали с выделения ДНК из полученного материала с помощью набора Invitrogen PureLink® Genomic DNA MiniKit (США). В работе использовались биочипы производства компании Agilent (США) SurePrint G3 Human CGH 180K, оценивающие порядка 180 тысяч точек генома человека. Среднее расстояние между зондами составляет около 13 килобаз, в области генов порядка 11 килобаз. Результаты обрабатывали с помощью программы Cytogenomics (Agilent, США) и оценивались с учетом рекомендаций Американского колледжа медицинской генетики [9]. Согласно рекомендациям, обнаруженные вариации числа копий ДНК (copy number variation – CNV) интерпретировали как патогенные, с неопределенной клинической значимостью и доброкачественные. Поскольку каждая популяция имеет свои особенности генома, была создана и постоянно пополняется собственная база микрохромосомных изменений (CNV), на данный момент содержащая 247 клинически охарактеризованных образцов.
Методом aCGH в соответствии с протоколом производителя обследовано 57 женщин в сроке беременности 11–15 недель: 36 – основной группы и 21 – группы сравнения. Начинали с выделения ДНК из полученного материала с помощью набора Invitrogen PureLink® Genomic DNA MiniKit (США). В работе использовались биочипы производства компании Agilent (США) SurePrint G3 Human CGH 180K, оценивающие порядка 180 тысяч точек генома человека. Среднее расстояние между зондами составляет около 13 килобаз, в области генов порядка 11 килобаз. Результаты обрабатывали с помощью программы Cytogenomics (Agilent, США) и оценивались с учетом рекомендаций Американского колледжа медицинской генетики [9]. Согласно рекомендациям, обнаруженные вариации числа копий ДНК (copy number variation – CNV) интерпретировали как патогенные, с неопределенной клинической значимостью и доброкачественные. Поскольку каждая популяция имеет свои особенности генома, была создана и постоянно пополняется собственная база микрохромосомных изменений (CNV), на данный момент содержащая 247 клинически охарактеризованных образцов.
Статистическая обработка полученных данных проведена с использованием программного обеспечения Statistica10.0.
Результаты
Были проанализированы особенности анамнеза обследованных женщин и течения настоящей беременности. Наиболее часто у женщин отмечены: в анамнезе – нарушения репродуктивной функции – 43,8%; при настоящей беременности – угроза прерывания – 33,9% (табл. 1).
ТВП плода по данным УЗИ колебалась от 2,0 до 8,0 мм. Наиболее частыми величинами являлись 2,5–3,0 мм (27,2%), 3,6–4,0 мм (23,4%) (табл. 2).
По результатам компьютерного анализа риск хромосомной патологии плода был высоким во всех наблюдениях: 1:41 – 1:133 биохимический, 1:5 – 1:32 «возрастной». Однако нарушения кариотипа при цитогенетическом исследовании выявлены в 24,2% (табл. 3). Наиболее часто отмечены анеуплоидии, в большинстве случаев – трисомия 21 (57,8%). Помимо числовых нарушений диагностированы структурные перестройки хромосом, возникшие de nоvо.
Частота хромосомной патологии с учетом размера воротниковой области колебалась от 4,7% до 20,3% (табл. 2). Достаточно часто аномалии кариотипа выявляли у плодов с лимфангиомой шеи.
Четкой зависимости частоты хромосомных нарушений от ТВП плода не обнаружено, также как и от возраста женщины. Из 187 женщин в возрасте до 35 лет у 36 (19,2%) плод с увеличенной ТВП имел аномальный кариотип и у 151 (80,8%) – нормальный. Помимо увеличения ТВП, 10 (6,6%) плодов с нормальным кариотипом и 9(25%) плодов с патологическим кариотипом имели другие особенности фенотипа: гидроцефалия, атрезия пищевода, омфалоцеле, диафрагмальная грыжа, гидронефроз и др. При статистической обработке полученных данных значимых различий не выявлено (критерий χ2 р>0,05). При обследовании 78 женщин старшей возрастной группы (35–48 лет) патология кариотипа плода диагностирована в 28 наблюдениях (35,9%), в 50 (64,1%) он был нормальным. Сочетанные с увеличенной ТВП другие особенности фенотипа отмечены в 9 (47,3%) и 2 (4,0%) наблюдениях соответственно.
Корреляции между возрастом, ТВП и хромосомной патологией плода не выявлено. Например, нарушения кариотипа отмечены у 54,5% женщин 35-летнего возраста и отсутствовали у 43-летних; диагностированы при ТВП плода от 2,0 до 3,0 мм и не обнаружены при 4,0 мм и более, в том числе в сочетании с другими особенностями фенотипа.
Проведено сопоставление характера хромосомных аномалий с данными УЗИ, особенностями анамнеза и течения беременности. Какой-либо закономерности также не выявлено: отягощенный анамнез, представленный в основном нарушением репродуктивной функции и применением методов вспомогательных репродуктивных технологий; осложнения, среди которых наиболее часто была угроза прерывания, имели спорадический характер.
Из 201 женщины с нормальным кариотипом плода у 7 (3,4%) при динамическом контроле в течение беременности у плода на УЗИ диагностированы особенности фенотипа. Подробные сведения об этих наблюдениях представлены в табл. 4.
Из представленных в табл. 4 данных видно, что при динамическом УЗИ у плода выявляли преимущественно пороки развития костной и центральной нервной систем.
Для уточнения результатов цитогенетического анализа в 57 наблюдениях использован метод aCGH. С его помощью, безвыборочно, обследовано 16 беременных женщин с аномальным кариотипом плода, 20 – с нормальным кариотипом, и, в качестве группы сравнения – 21 пациентка из группы риска, обусловленного носительством одним из супругов хромосомных или генных нарушений (рис. 1).
В наблюдениях с хромосомной патологией плода результаты молекулярно – генетического и цитогенетического метода были идентичны.
В группе сравнения CNV были только доброкачественные и вероятно доброкачественные. У плода женщины-носительницы робертсоновской транслокации 45,ХХ,der(13;14);(q10;q10) диагностирован кариотип аналогичный материнскому, однако, с помощью метода aCGH хромосомная перестройка не была обнаружена, т.к. имелся сбалансированный кариотип.

Наибольший интерес представляли результаты обследования плодов с нормальным кариотипом по результатам цитогенетического исследования. У трех из них при молекулярно-генетической диагностике выявлены CNV, охарактеризованные как патогенные и вероятно патогенные (табл. 5).
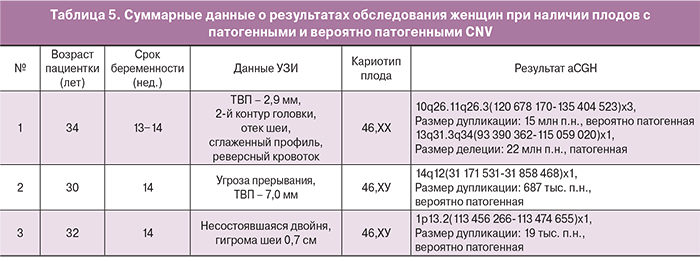
В наблюдении 1 табл. 5 при молекулярно-генетическом исследовании у плода с нормальным кариотипом обнаружена дупликация длинного плеча 10-й хромосомы размером 15 млн п.н. – вероятно патогенный вариант, и частичная моносомия размером 22 млн п.н. по длинному плечу 13-й хромосомы – редкий микроделеционный синдром 13q патогенный вариант (рис. 2, 3). При цитогенетическом обследовании супружеской пары у мужчины выявлена сбалансированная реципрокная транслокация между хромосомами 10 и 13 с точками разрыва 10q26 и 13q31.3 – 46,XY,t(10;13)(q26.1;q31.3).
У плода женщины 30 лет по результатам aCGH была выявлена делеция размером 687 тыс. п.н. в области длинного плеча 14-й хромосомы, охарактеризованная как вероятно патогенная. В область делеции включены гены, из которых один – сochlin (coch) ассоциирован с аутосомно–доминантной несиндромальной прогрессирующей нейросенсорной тугоухостью, обусловленной вестибулярной дисфункцией [10].
У женщины 32 лет с несостоявшейся двойней и оставшимся плодом с гигромой шеи диаметром 0,7 см по УЗИ, при проведении aCGH диагностирована делеция размером 19 тыс. п.н. в области короткого плеча 1-й хромосомы, охарактеризованная как вероятно патогенная и затрагивающая ген slc16a1, при дефектах которого описаны аутосомно-доминантные синдромы, характеризующиеся мягким клиническим фенотипом [10].
Обсуждение
В настоящей работе критерием отбора пациенток явилась величина воротниковой области 2,0 мм и более, так как уже при этом ее размере частота хромосомной патологии соответствовала 4,7%. В литературе отсутствует единое мнение о минимальном размере «патологической» ТВП: 2,5, 2,8, 3,0, 3,5 мм [11–14]. В то же время имеются данные о корреляции увеличения ТВП с повышенной частотой хромосомных нарушений определенного типа [15]. В проведенной работе эти закономерности не выявлены.
По данным литературы увеличение ТВП плода повышает риск наличия у него хромосомной патологии [1, 2]. По данным разных авторов от 10 до 40% плодов с изолированным увеличением ТВП имеют аномальный кариотип [16, 17]. Варьирование этой частоты, возможно, обусловлено особенностями измерения ТВП [16]. В представленном исследовании у всех женщин был высокий риск хромосомных нарушений, однако аномальный кариотип установлен в 24,2%, что согласуется с результатами других авторов [18]. Тем не менее, женщин, плод которых имеет подобную особенность фенотипа, следует рассматривать как группу риска по рождению аномального ребенка. Этим женщинам показана инвазивная пренатальная диагностика с целью определения кариотипа плода, а не прерывание беременности. Вопрос о тактике дальнейшего ведения беременности решается в зависимости от результатов: при патологии кариотипа – прерывание, при норме – пролонгирование. Однако при дальнейшем наблюдении за течением беременности плодом с нормальным кариотипом могут появиться основания для досрочного родоразрешения. В данной работе у 7 (3,4%) плодов при динамическом УЗИ диагностированы пороки развития несовместимые с жизнью, что отмечают и другие исследователи [19]. С помощью метода аCGH у 3 плодов в геноме были выявлены микрохромосомные изменения, охарактеризованные как патогенные и вероятно патогенные.
Следует подчеркнуть тот факт, что интерпретация результатов аCGH нередко представляет собой нетривиальную задачу, особенно тогда, когда найденные изменения в геноме отсутствуют у родителей пациента. В таком случае можно говорить или о возникновении изменений de novo, или об артефакте эксперимента. Для установления окончательного диагноза рекомендуется подтверждение найденных особенностей генома с помощью альтернативных методов, таких как, например, флуоресцентная ин-ситу гибридизация или полимеразная цепная реакция.
Прерывание беременности в ситуациях с вероятно патогенными изменениями не требуется. Последующее обследование супругов, у которых плод имел патогенную микроперестройку, позволило обнаружить у отца реципрокную транслокацию. Супругам были даны рекомендации об обследовании дочери, подготовке к последующей беременности с использованием ЭКО и преимплантационной генетической диагностики.
Заключение
Таким образом, определение нормального кариотипа плода не исключает возможность прерывания беременности. При наличии по данным УЗИ увеличения размера воротниковой области плода, помимо стандартного цитогенетического анализа, необходимо проведение молекулярно-генетического анализа, особенно если хромосомная патология не обнаружена. Такой подход имеет значение не только для уточнения диагноза и выработки однозначного заключения ведения беременности, но и для адекватного прогноза потомства у данной супружеской пары.



