Аборты являются самой распространенной гинекологической операцией. По оценкам ВОЗ приблизительно 25% всех беременностей в мире заканчивается искусственным абортом, что
составляет приблизительно 50 миллионов каждый год [3, 6]. Значительный вклад в эту статистику вносит Россия, занимая второе место после Китая по абсолютному числу абортов. При этом число абортов в России по сравнению со странами Восточной Европы и СНГ больше в 1,5–2,5 раза, а Западной Европы – в 3–15 раз. Существующая статистика не отражает достоверного состояния вопроса ни относительно общего числа абортов, ни числа осложнений после него. Вместе с тем данные отдельных научных исследований свидетельствуют о высоком уровне этих
осложнений [4, 7, 8].
В литературе обсуждается необходимость и важность профилактики инфекционных осложнений, связанных с проведением медицинского аборта, так как частота их не имеет тенденции к снижению и составляет от 7 до 25% [2, 6, 7]. По данным некоторых авторов [7], через 2 мес после проведенного аборта хронический воспалительный процесс в органах малого таза диагностируется в 18%, а через два года – в 12,5% случаев. С другой стороны, несмотря на устойчивую тенденцию снижения числа искусственных абортов в Российской Федерации, они по-прежнему занимают ведущее место в струк-
туре методов регуляции фертильности, внося значительный вклад в статистику репродуктивных потерь. Во всем мире признана концепция «Безопасного аборта», в соответствии с которой, наряду с применением собственно современных технологий искусственного прерывания беременности (ИПБ), равнозначным компонентом является профилактика развития инфекционных осложнений, а также реабилитация женщин после искусственного аборта.
Сохраняющаяся диспропорция между частотой использования женщинами эффективных методов контрацепции, с одной стороны, и искусственных абортов с целью регуляции рождаемости, с другой, позволяет считать, что проблема безопасного аборта еще долго будет оставаться актуальной. В этих условиях чрезвычайно важным является повышение качества медицинской помощи женщинам в полном объеме определения «безопасный аборт», целью которого является профилактика осложнений, в том числе инфекционных, использование современных технологий искусственного прерывания беременности, оптимизация контрацептивного поведения и, в конечном итоге, сохранение репродуктивного потенциала женщин.
Наиболее общей причиной обращения женщин репродуктивного возраста к гинекологу являются влагалищные инфекции. Бактериальный вагиноз, вульвовагинальный кандидоз и трихомониаз считаются в мире наиболее распространенными неспецифическими воспалительными и дисбиотическими процессами нижнего отдела генитального тракта [7, 10, 11]. Оценить частоту встречаемости бактериального вагиноза достаточно сложно, но большинство исследователей сходятся во мнении, что 10–41% женщин в течение репродуктивного возраста хотя бы раз сталкивались с этой проблемой [5, 8, 10]. Хотя определены антибактериальные схемы лечения, которые обычно высокоэффективны в эрадикации патогенных микроорганизмов, продолжительная эффективность лечения ставится под сомнение в связи с высоким риском хронизации и/или рецидивирования процесса. Это означает, что не во всех случаях лечение оказывается эффективным.
Есть данные о том, что применение метронидазола изменяет влагалищную микрофлору. Препарат оказывает бактерицидное действие не только по отношению к патологической микрофлоре, но и по отношению к Lactobacillus spp. in vitro. V. Redondo-Lo’pez и соавт. (1990) установили [12], что влагалищная флора женщин, леченных метронидазолом, обеднена лактобациллами; более чем у 50% женщин возникали рецидивирующие кандидозы. В других исследованиях уровень реинфекции достигал 14–39% случаев через мес после лечения метронидазолом и еще в 30% случаев – через 3 мес после лечения.
Вместе с тем в нескольких обзорах представлен опыт использования препаратов, содержащих живые лактобациллы, для лечения урогенитальных инфекций. Показано, что экзогенно введенные лактобациллы способны снижать уровень реинфекции у женщин с кандидозом, бактериальным вагинозом и рецидивирующим вагинитом [6, 11]. В открытом неконтролируемом исследовании H. Lauritzen и соавт. (1984) показали, что восстановительное лечение препаратом гинофлор значительно улучшает степень чистоты влагалища и степень пролиферации влагалищного эпителия [9].
Известно, что профилактика и лечение влагалищных инфекций снижает заболеваемость воспалительными заболеваниями органов малого таза после искусственного аборта [3, 6, 7].
В соответствии с концепцией «безопасного аборта» подготовка пациентки к искусственному прерыванию беременности (ИПБ) включает, в том числе, и стратегию снижения послеабортного инфекционного риска [3]. Эта стратегия заключается в применении антибиотиков в профилактических целях и/или исследовании на наличие инфекций, передаваемых половым путем (ИППП), и лечении выявленных случаев. Рутинное назначение антибиотиков/антисептиков перед абортом значительно снижает риск инфицирования.
Учитывая научные и клинические данные последних лет, свидетельствующие о том, что для полноценного устойчивого функционирования влагалищного биотопа необходим целый комплекс условий, включая, прежде всего, присутствие лактобактерий, нам представлялось важным изучить возможность применения препаратов флуомизин и гинофлор Э в программе реабилитации женщин при искусственном прерывании беременности Цель исследования: оценить эффективность и приемлемость применения препаратов флуомизин и гинофлор Э в программе профилактики воспалительных осложнений и реабилитации женщин после аборта.
Материал и методы исследования
В исследование были включены 100 женщин, средний возраст которых составил 28,9±0,4 года, обратившихся по поводу искусственного прерывания беременности (ИПБ) в сроки от 5 до 9 нед беременности Когорта исследуемых была представлена рожавшими женщинами (49,0%) и первобеременными (37,0%). Предшествовавшие настоящей беременности аборты имели 44,0% женщин, в том числе самопроизвольные аборты и неразвивающуюся беременность – 7,0% пациенток. В целом возрастная структура включенных в исследование женщин отражала статистику абортов
в России. В социальной структуре беременных преобладали служащие (80,0%), каждая десятая пациентка была домохозяйкой, студентки составили 8,0% и рабочие – 2,0%.
Критериями возможности прерывания беременности было отсутствие воспалительных заболеваний гениталий, в т.ч. кольпита, БВ у обследованных женщин.
Исследование состояло из двух этапов, На I этапе проводили углубленное исследование биоценоза влагалища. По результатам исследования 31 пациентке с установленными диагнозами бактериальный вагиноз и неспецифический вульвовагинит проводили санацию влагалища препаратом флуомизин, который содержит деквалиния хлорид (соединение четвертичного аммония с широким спектром антимикробной активности против грамположительных и грамотрицательных бактерий, грибов и простейших), в течение 6 дней до ИПБ.
На 2-ом этапе в течение 6 дней после ИПБ (независимо от применяемой технологии ИПБ) с целью восстановления нормального биоценоза влагалища женщинам, у которых на этапе подготовки к ИПБ использовали флуомизин, назначали гинофлор Э, содержащий не менее 100 млн жизнеспособных ацидофильных лактобактерий (L. acidophilus) и 0,03 мг эстриола, а также вспомогательные компоненты. Для этого пациентки, получавшие флуомизин, были разделены на две группы: в I группе (n=16) пациенткам была назначена терапия гинофлором Э (по 1 влагалищной табл. на ночь в течение 6 дней); пациенткам II группы (n=15) терапия не проводилась. Остальные 69 женщин составили контрольную группу.
Оценивали эффективность (клиническую и микробиологическую) препарата в программе профилактики и реабилитации женщин в связи с ИПБ. Всем беременным проводили стандартное
клинико-лабораторное обследование, включавшее микроскопическое исследование вагинального отделяемого и дополнительное исследование биоценоза влагалища методом ПЦР в реальном времени с помощью реагентов «Фемофлор» (ООО «НПО ДНК-технология», Москва). Набор реагентов «Фемофлор» включал смесь для ПЦР-амплификации, специфичную для всех бактерий (для определения общей бактериальной массы), смесь, специфичную для лактобацилл, и смеси, специфичные для условно-патогенных микроорганизмов. После прохождения амплификации автоматически рассчитывали общее количество бактериальной массы, лактобацилл и каждого из условно-патогенных микроорганизмов и по их соотношению определяли состояние микробиоценоза. Микроскопию влагалищных мазков производили после их окраски по Грамму. Из экспресс-методов диагностики использовали определение цвета, запаха, консистенции, количества и распределения вагинального отделяемого, pH-метрию вагинального отделяемого и аминный тест (с добавлением 10%-ного раствора КОН).
Статистическую обработку данных проводили с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 и Statistica 7.0 for Windows. Оценку достоверности результатов проводили с применением критерия Стьюдента (t), непараметрического критерия Фишера.
Результаты исследования и обсуждение
Анализ состояния здоровья обследуемых женщин показал, что более половины из них имели гинекологические заболевания в анамнезе: доброкачественные заболевания шейки матки (28,0%), воспалительные заболевания гениталий (14,0%) и ИППП (17,0%). Жалобы на бели предъявляли 17,0% беременных, неприятный запах – 30,0%, дискомфорт во влагалище – 20,0% пациенток.
Мы провели сравнительный анализ результатов оценки состояния влагалища и его микрофлоры на основании клинических исследований, микроскопического метода и ПЦР с помощью диагностической системы «Фемофлор». При стандартном гинекологическом обследовании беременных были диагностированы вагинит у 25,0% и вагиноз у 6,0% женщин.
Результаты микроскопического исследования влагалищного отделяемого в зависимости от числа лейкоцитов и характера микрофлоры были разделены на 4 типа (табл. 1). При этом число лейкоцитов до 10 в поле зрения считали нормальным, а его превышение расценивали как признак воспаления.
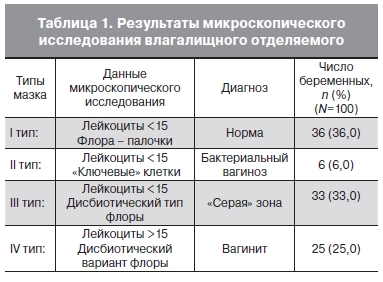
Полученные данные, таким образом, существенно расходились с субъективной оценкой беременных. Наибольшие трудности, вызвала интерпретация данных микроскопии III типа, когда при нормальном количестве лейкоцитов наблюдался дисбиотический характер микрофлоры влагалища: кокковая или смешанная флора, отсутствие флоры, дрожжи. Такое состояние биоценоза наблюдалось практически у каждой третьей обследованной беременной, что потребовало применения более информативных
методов исследования.
Для углубленного исследования состояния биоценоза влагалища у беременных была использована диагностическая система «Фемофлор». Состояние нормоценоза влагалища (доля лактофлоры более 80%) было определено лишь у 22,0% беременных. Более чем у половины
обследованных (52,0%) диагностировали относительный нормоценоз – вариант биоценоза влагалища, при котором на фоне сохраненной лактофлоры в диагностическом титре выявлено 104 геном-эквивалента (ГЭ) условно-патогенных микроорганизмов, таких как Ureaplasma spp., Mycoplasma spp., Candida spp. У 15,0% женщин был выявлен анаэробный дисбаланс и у 11,0% – умеренный анаэробный дисбаланс.
С целью снижения риска инфекционных осложнений 31 пациентке с установленными диагнозами вульвовагинит и бактериальный вагиноз на этапе подготовки к прерыванию беременности проводили санацию влагалища флуомизином в течение 6 дней. После завершения курса терапии флуомизином жалоб пациентки не предъявляли. Объективно у всех пациенток отмечены слизистые выделения, в скудном количестве — у 93,5% и умеренные — у 6,5% пациенток. Повторное исследование мазка влагалищного содержимого показало динамику снижения числа лейкоцитов по сравнению с показателями, которые были до начала лечения (табл. 2).
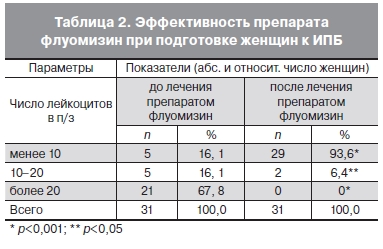
Анализ результатов клинической эффективности показал, что использование флуомизина привело к улучшению объективных и лабораторных показателей: у пациенток отсутствовали характерные жалобы, при микроскопическом исследовании – ключевые клетки. Полученные данные свидетельствуют о необходимости и эффективности терапии флуомизином в программе предабортной подготовки.
При выполнении искусственного аборта частота осложнений была низкой вне зависимости от способа ИПБ: вакуум-аспирации (n=70) или медикаментозного аборта (n=30) и составила 8,6 и 6,7% соответственно. Различия между группами были связаны с развитием эндометрита после вакуум-аспирации у 1,4% пациенток и отсутствием этого осложнения в группе с медикаментозным абортом.
Мы провели анализ изменений влагалищного микробиоценоза в зависимости от способа прерывания беременности. Известно, что влагалище представляет собой микроэкосистему, особенности которой определяются анатомическим строением, гистологической структурой слизистой оболочки, биологическими свойствами влагалищной жидкости, вагинальной микрофлорой. Функционирование и слаженное взаимодействие всех звеньев этой микроэкосистемы обеспечивается деятельностью иммунной, эндокринной систем и зависит от факторов как внутренней, так и внешней среды [1, 2, 8].
При повторном исследовании влагалищного содержимого после прерывания беременности картина микрофлоры влагалища менялась по-разному. В большей степени эти изменения наблюдались у пациенток, перенесших аборт методом вакуум-аспирации. Так, отклонения в биоценозе были диагностированы практически у каждой третьей (28,6%) пациентки; при этом дисбиоз наблюдался у 11,4% обследуемых, признаки вагинита были выявлены у 4,3% женщин; нормоценоз был определен только у каждой пятой (20,0%), промежуточный тип биоценоза – у 21,4% пациенток. У женщин, перенесших медикаментозный аборт, микробиоценоз влагалища изменялся в меньшей степени. Признаки вагинита не обнаружены ни у одной из пациенток, дисбиоз выявлен у 6,7% женщин, что достоверно ниже (p<0,05) по сравнению с изменениями после вакуум-аспирации. В свою очередь
после медикаментозного аборта достоверно чаще (p<0,05) у пациенток определяли нормоценоз
(43,3%) и промежуточный тип биоценоза (46,7%). Эти данные свидетельствуют о том, что ИПБ
существенно нарушает состояние экосистемы влагалища с развитием дисбиозов и неспецифических вагинитов, повышая риск развития воспалительных заболеваний в послеабортном периоде.
Антибиотикотерапия инфекционных осложнений, в том числе и нарушений влагалищного биоценоза, является традиционной. Вместе с тем наиболее интересной альтернативой представляется применение препаратов, которые наряду с антимикробным действием, обладают и способностями восстанавливать нормальную микрофлору влагалища [6, 9, 10]. Этими качествами наделен препарат гинофлор Э. Благодаря живым лактобациллам, присутствующим в этом препарате, в силу ряда механизмов происходит восстановление влагалищной экосистемы, значительно улучшается степень чистоты влагалища и пролиферации влагалищного эпителия. В конечном итоге, эти изменения снижают частоту реинфекции и хронизации процесса у женщин с кандидозом, бактериальным вагинозом и вагинитом [8, 10].
После окончания лечения гинофлором Э пациентки I группы характерных жалоб не предъявляли. Объективно слизистые выделения отмечены у всех пациенток: у 73,3% – в умеренном количестве, а у 26,7% пациенток – скудные. У 60,0% пациенток II группы сохранялись жалобы на обильные выделения из половых путей; на выделения с неприятным запахом указывали 26,7% женщин; зуд во влагалище отмечали 20,0% пациенток; жалобы на дискомфорт в области наружных половых органов предъявляли 33,3% женщин. Объективно у 20,0% женщин этой группы были отмечены творожистые выделения. При бактериоскопическом исследовании мазков из влагалища у 13,3% пациенток обнаружены ключевые клетки и дрожжеподобные грибы.
Использование препарата гинофлор Э в течение 6 дней после ИПБ привело к статистически достоверному (р<0,05) преобладанию лактобактерий у женщин I группы по сравнению с женщинами II группы, которым гинофлор Э не назначали Так, у женщин I группы во влагалищном секрете лактобактерии преобладали у 46,7% пациенток, только лактобактерии обнаружены у 53,3% женщин. Во II группе лактобактерии преобладали у 33,3% пациенток; у 6,7% женщин микроорганизмов обнаружено не было и у 60,0% микрофлору составляли другие микроорганизмы. При микроскопии влагалищных мазков содержание лейкоцитов менее 10 сохранилось у 86,7% пациенток I группы и 33,3% женщин II группы.
Состав микрофлоры влагалищного содержимого и число лейкоцитов в препаратах позволили оценить изменение степени чистоты влагалища у пациенток, принимавших гинофлор Э: I степень чистоты влагалища выявлена в 66,7% наблюдений; II степень – у 33,3% пациенток. Во II группе I степень чистоты влагалища определена только у 6,7% женщин, II степень чистоты – у 20,0% женщин, III степень – у 46,7% пациенток и IV степень чистоты влагалища –у 26,6% женщин. Таким образом, преобладание во влагалищном секрете лактобактерий отразилось как на клинических проявлениях, так и на степени чистоты влагалища.
Выводы
Применение ПЦР в реальном времени позволяет более точно оценить систему биоценоза влагалища и оптимизировать мероприятия по профилактике осложнений, связанных с искусственным прерыванием беременности. Использование комплексной оценки позволило установить, что 64% беременных в сроки 5–9 нед имели те или иные нарушения биоценоза влагалища. Деквалиния хлорид (флуомизин) обладает высокой клинической и микробиологической эффективностью при лечении бактериального
вагиноза и неспецифического вульвовагинита и может быть использован как местный антисептик в программе предабортной подготовки. Благодаря его применению, мы добились достоверно значимого (р<0,05) снижения содержания лейкоцитов во влагалищном содержимом и достигли I степени чистоты влагалища у 93,6% пациенток.
Искусственный аборт в анамнезе является прогностическим фактором нарушения биоценоза влагалища с преимущественным анаэробным дисбалансом.
Гинофлор Э обладает высокой клинической эффективностью в программе постабортной реабилитации. Рекомендованная схема применения достоверно (р<0,05) способствует восстановлению (с преобладанием лактобактерий) биоценоза влагалища преимущественно с I степенью чистоты влагалища.
Внедрение в практику предложенной системы профилактических мероприятий позволит уменьшить число осложнений индуцированного аборта и способствовать устойчивой реабилитации женщин после ИПБ.



