Синдром поликистозных яичников (СПКЯ) – полигенное эндокринное расстройство, обусловленное как наследственными факторами, так и факторами внешней среды. Ведущими признаками СПКЯ являются: гиперандрогения, менструальная и/или овуляторная дисфункция и поликистозная морфология яичников [1]. Общепризнано, что СПКЯ – самая частая причина нарушения менструальной функции и ановуляторного бесплодия. Так, в нашей стране СПКЯ встречается у 70% пациенток с ановуляторным бесплодием, у 65% женщин с андрогензависимыми дерматопатиями, у 55% больных с различными формами гиперандрогении [2]. До настоящего времени недостаточно изучен патогенез СПКЯ. Однако в последние годы отмечены несомненные успехи в решении многих вопросов развития этой патологии. Установлено 16 генов, мутация которых приводит к СПКЯ [3]. После обнаружения в тканях яичников инсулиновых рецепторов и чувствительности овариальной ткани к инсулину [4] важную роль в патогенезе СПКЯ отводят инсулинорезистентности [5–7]. Гиперинсулинемия напрямую действует на тека-клетки и строму и стимулирует синтез андрогенов яичниками; также способствует развитию ожирения, а гормональная дисфункция жировой ткани и периферический стероидогенез адипоцитами усиливают гиперандрогению [5–7]. Однако инсулинорезистентность и избыточная масса тела наблюдаются только примерно у 50% пациенток [8]. Очевидно, при нормальной и пониженной массе тела более значимы другие факторы патогенеза СПКЯ.
В патогенезе СПКЯ большое значение придают врожденному нарушению цирхорального ритма секреции гонадолиберина, повышению секреции лютеинизирующего (ЛГ) и дефициту фолликулостимулирующего гормона (ФСГ). Риск такой гормональной дизрегуляции возникает уже в эмбриональном периоде под влиянием патогенных факторов в I триместре беременности, когда происходит закладка гипоталамо-гипофизарной системы и яичников (в 5 недель) [9]. Важно отметить, что это совпадает с закладкой соединительной ткани. Неблагоприятные факторы в этом сроке гестации приводят к формированию дисплазии соединительной ткани у ребенка, особенно часто к ее недифференцированной форме. Недифференцированная дисплазия соединительной ткани (НДСТ) – это генетически детерминированное состояние соединительной ткани, обусловленное нарушением развития соединительной ткани в эмбриональном и постнатальном периодах, морфологической основой которого являются дефекты строения коллагена, чаще IV–VII типов, которые приводят к изменениям волокнистых структур и основного вещества соединительной ткани [10]. Во время эмбриогенеза в 5 недель из мезенхимы в яичнике образуется соединительная ткань: строма в корковом и мозговом веществе, белочная оболочка, тека-ткань.
Цель настоящей работы – оценить особенности клинических проявлений и течения СПКЯ у женщин с НДСТ, проанализировать, не является ли в ряде случаев СПКЯ проявлением ДСТ. В доступной литературе не встретились публикации, в которых СПКЯ рассматривается как вариант НДСТ.
Материалы и методы
Углубленное общеклиническое обследование в динамике (срок наблюдения от 5 до 18 лет) проведено 87 пациенткам в возрасте от 18 до 40 лет с выявленным СПКЯ согласно Роттердамским критериям с уточнениями 2012 г. [11–13]. Изучали медицинские документы: амбулаторные карты, выписки из роддома, стационаров, результаты анализов и обследований, сделанных ранее, проведенное лечение и его эффективность. Анализировали антропометрические показатели, индекс массы тела (ИМТ) и объективный статус больных. Особое внимание уделяли выявлению симптомов НДСТ. Оценивали менструальную функцию и фертильность, гинекологический статус. Проверяли уровни гормонов в крови: ЛГ, ФСГ, пролактина (ПРЛ), эстрадиола, тестостерона и свободного тестостерона, 17ОН-прогестерона, андростендиона, дегидроэпиандростерона (ДГЭА), С-пептида. Исследовали метаболические показатели: гликемию, липидный спектр, ферритин, содержание электролитов в крови. Неоднократно повторяли ультразвуковое исследование (УЗИ) органов малого таза в динамике и УЗИ органов брюшной полости. Выборочно по показаниям проводили магнитно-резонансную томографию (МРТ) гипофиза для исключения вторичной аденомы.
Статистический анализ
Статистическая обработка результатов исследования проводилась с использованием пакетов статистических программ Statistica 6.1 (компания-производитель StatSoft) и Microsoft Excel 2010. Для анализа клинической симптоматики и гормональных показателей наблюдаемых больных оценивали качественные и количественные данные. Качественные признаки представлены абсолютной частотой встречаемости признака и процентами. Оценивали распределение количественных данных наблюдаемых больных. При нормальном распределении рассчитывали среднее арифметическое значение (M) и стандартное отклонение (SD) в формате M (SD). При распределении признаков, отличающемся от нормального, описывали медиану (Ме) и квартили (Q1 и Q3) в формате Ме (Q1;Q3), где Q1 – 25 квартиль, Q3 – 75 квартиль. При нормальном распределении признаков и равенстве дисперсий (среднего квадратического отклонения) статистическую значимость различий в сравниваемых группах определяли по t-критерию Стьюдента и критерию Фишера. Критический уровень значимости при проверке статистических гипотез принимали равным p≤0,05.
Результаты и обсуждение
Наблюдаемые пациентки родились от доношенной беременности. Их матери при вынашивании беременности в I триместре перенесли вирусные простудные заболевания: 59 из 62 (95,2%); во II и III триместре у 52 (83,9%) матерей наблюдался дефицит железа. Роды были нормальными у всех женщин. Масса детей при рождении составила в среднем 3350 г; ни в одном случае не было дефицита массы тела, что, как известно, впоследствии может спровоцировать СПКЯ, так как вызывает гиперинсулинизм, а затем – ожирение [14]. Не удалось выявить наличие у пациенток наследственной отягощенности по СПКЯ, но примерно в половине случаев у родственников были признаки НДСТ (кифосколиоз, плоскостопие, гипермобильность суставов и т.д.). В допубертатном периоде в развитии девочек не было отмечено каких-либо отклонений от нормы. Возрастные темпы и показатели роста также не отличались от нормы и соответствовали наследственной предрасположенности. Сформировался женский фенотип у всех без исключения наблюдаемых больных; причем у 69 (79,3%) из них оказался нормальный ИМТ – 18,5–≤24,9 кг/м2, у 18 (20,7%) – дефицит массы тела (ИМТ 16,8–≤18,5 кг/м2). Симптомы НДСТ проявлялись в ряде случаев уже при рождении: из детских амбулаторных карт выяснено, что у 19 детей была косолапость, у 29 – плоскостопие. Известно, что симптомы НДСТ многообразны, и с возрастом нарастает количество и выраженность признаков. Однако нередко их выявляют несвоевременно, например, во время вынашивания пациентками беременности [10]. В таблице 1 представлена симптоматика НДСТ у наблюдаемых больных.
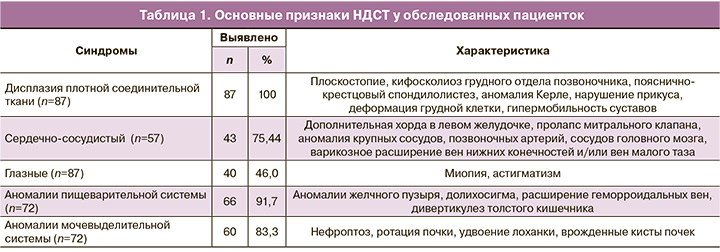
Дисплазия плотной соединительной ткани проявлялась заметнее, чем дисплазия соединительной ткани внутренних органов. Очевидно, поэтому ее отметили у всех пациенток, причем в большинстве случаев уже в дошкольном возрасте. У всех без исключения больных аномалии сочетались в разных вариантах. Дефицит массы тела также являлся симптомом НДСТ, так как другие возможные причины его были исключены. У 10 женщин выявили аномалии матки (седловидная, двурогая, однорогая, двухкамерная, с неполной перегородкой) или влагалища (с перегородкой). В возрастной группе больных старше 30 лет (n=52) разные сочетания признаков НДСТ встретились в 2,4 раза чаще, чем у пациенток до 30 лет (n=35; р<0,001), проявления НДСТ были разнообразнее и более выражены в старшем возрасте.
Ни в одном случае СПКЯ у наблюдаемых пациенток не был заподозрен в допубертатном периоде, несмотря на то, что примерно в половине случаев пубархе у них опережало телархе и начиналось в 8–10 лет. Диагноз СПКЯ всем наблюдаемым больным поставлен после 20 лет, хотя нарушение менструальной функции проявилось с менархе (как правило, возникала опсоменорея). Только в двух случаях встретилась первичная аменорея, и у обеих пациенток при углубленном обследовании по поводу бесплодия было установлено сочетание СПКЯ с неклассической формой врожденной дисфункции коры надпочечников. В литературе также встречаются описания отдельных клинических случаев подобного сочетания [15] и даже сочетания с классической вирилизирующей формой [16]. При аменорее I и СПКЯ такой вариант необходимо исключать, поскольку для СПКЯ аменорея I не характерна.
Возраст менархе у наблюдаемых больных в среднем составлял 13,9 (0,09) года (как и у сверстниц). У 13 пациенток оказались циклические ановуляторные кровотечения, диагностированные в связи с бесплодием только после 20 лет. Признаки кожной гиперандрогении – угревые высыпания, жирная себорея – нередко начинали проявляться до менархе. Гирсутизм и гипертрихоз возникали примерно через 5–7 лет после менархе и были выражены умеренно. В связи с проявлениями кожной гиперандрогении 12 больным в подростковом возрасте назначались контрацептивы (Диане-35 или Джес); эффект был умеренным и временным. В подростковом возрасте лишь единичным пациенткам (n=4) сделано УЗИ органов малого таза: патологии не выявлено. В дальнейшем характерная для СПКЯ эхографическая картина яичников установлена у этих и всех без исключения наблюдаемых больных. Важно отметить, что аномалия яичников касалась в первую очередь строения овариальной соединительной ткани: утолщение и склероз белочной оболочки, выраженная диффузная гиперплазия стромы. Структурные изменения яичников у большинства пациенток имели прогредиентное течение, нарастало увеличение размеров яичников, толщина коркового слоя, избыток интерстиция (табл. 2).

УЗИ органов малого таза всем больным повторяли неоднократно. Поэтому удалось установить, что эхографическая овариальная патология постепенно нарастала. У пациенток, которым при первичном осмотре не исполнилось 20 лет, первоначально не было найдено ультразвуковых признаков СПКЯ, но через 6–10 лет они имели классическую эхографическую картину СПКЯ.
Гормональные и метаболические результаты обследования наблюдаемых больных представлены в таблице 3. Из таблицы 3 видно, что уровень С-пептида у обследованных больных не превышал норму. С-пептид точно отражает продукцию инсулина островками поджелудочной железы, т.е. у больных исключена гиперинсулинемия, а значит, и инсулинорезистентность. Индекс HOMA-IR и индекс Caro проверены выборочно (n=26), оказались в норме у всех обследованных: индекс Caro >0,33, HOMA-IR <2,77.
Не установлено гипертриглицеридемии ни в одном случае. Известно, что возникновению гипертриглицеридемии способствует гиперинсулинизм, т.е. в патогенезе СПКЯ у наблюдаемых больных этот механизм не участвует. Даже у пациенток 38–40 лет отсутствовало висцеральное ожирение, не было кардиальных нарушений, гиперхолестеринемии, гипертриглицеридемии и дислипидемии, гликемия в пределах нормы, гликированный гемоглобин – 5,5–5,9% (исключен риск сахарного диабета и метаболического синдрома). Однако все пациентки прошли лечение метформином; при этом наблюдался нежелательный эффект – снижение массы тела и ухудшение самочувствия. Менструальная функция у них не улучшилась. Секрецию С-пептида проверили в динамике через 5–6 лет: возникновения гиперинсулинизма, сахарного диабета, ожирения не отмечено.
Статистическая значимость уровня ЛГ оказалась выше у пациенток в возрасте до 30 лет по сравнению с пациентками старше 30 лет: соответственно выше нормы – у 24 (66,7%) и у 14 (33,3%); критерий Фишера φ=2,99; p<0,01. У всех без исключения больных установлено нарушение соотношения ЛГ/ФСГ: >2 или <1 при норме в интервале 1–2. Известно, что диспропорция секреции гонадотропинов приводит прежде всего к неполноценности лютеиновой фазы менструального цикла и ановуляции. У 7 больных при проведении МРТ гипофиза выявлена вторичная гормонально-неактивная микроаденома гипофиза. Важно отметить, что при микроаденомах гипофиза не было повышения уровня ЛГ в крови, хотя это не отражалось на проявлениях гиперандрогении и менструальных нарушениях, а также возникали упорные цефалгии, преимущественно в лобной области. Именно такая симптоматика вынуждала проводить больным МРТ-контроль гипофиза.
Функциональная гиперпролактинемия отмечена у большинства больных, была умеренной и транзиторной (у всех пациенток гиперпролактинемия чередовалась со спонтанно возникающей нормопролактинемией), т.е. не требовалось применение агонистов дофамина. Тем не менее из анамнеза больных выяснено, что им назначался достинекс, и это неизменно приводило к гипопролактинемии.
Гипоэстрогения или тенденция к гипоэстрогении наблюдались у всех без исключения больных и были стабильными. Содержание в крови тестостерона было нормальным, но в 100% случаев свободный тестостерон, наиболее гормонально активный, превышал норму, что тормозило секрецию эстрадиола и отражалось на клинической картине (фенотип женский, рост нормальный, гирсутизм умеренный, но выражены симптомы кожной гиперандрогении – угревая болезнь); подавлялась продукция печенью глобулина, связывающего половые стероиды: 17,4 (1,21) нмоль/л при норме 14,7–122,5 нмоль/л. Поскольку гиперандрогения тормозит образование жировой ткани, очевидно, это также способствовало снижению массы тела наблюдаемых больных. Превышение других фракций андрогенов – ДГЭА, андростендиона, 17ОН-прогестерона – выявлено не у всех больных и наблюдалось эпизодически, что помогало в дифференциальной диагностике с надпочечниковой гиперандрогенией.
Трудно диагностировать СПКЯ у пациенток в возрасте до 20 лет. Однако при наличии у них признаков НДСТ следует заподозрить СПКЯ, а не считать угри просто ювенильными и нерегулярные месячные – физиологическими возрастными нарушениями. Практический опыт показал, что врожденную патологию позвоночника, почек, желчного пузыря и главное – сердечно-сосудистой системы выявляли у женщин с СПКЯ именно при вынашивании беременности. Требовалось медикаментозное вмешательство (обезболивающие, антибиотики, антиспастические, антиаритмические), что являлось дополнительной медикаментозной нагрузкой. Безусловно, врожденные анатомические аномалии устранить невозможно, но превентивные меры осложнений и усугубления патологии должны проводиться всегда, особенно при планировании беременности. Необходимо исключить патологию сердца и сосудов, препятствующих вынашиванию беременности из-за риска для жизни женщины (блокады сердца, выраженный пролапс митрального клапана – более II степени, аневризмы церебральных сосудов или артериовенозная мальформация), и, если возможно, провести коррекцию. При наличии дисплазии соединительной ткани следует обучить пациенток лечебной физкультуре, провести профилактическое лечение хондропротекторами. При выраженном нефроптозе важно до зачатия решить вопрос о подшивании почки. При врожденных аномалиях почек надо учесть высокий риск развития пиелонефрита беременной и обучить пациентку гигиеническим профилактическим мерам, а во время гестации чаще контролировать общий анализ мочи. При наличии перетяжек в желчном пузыре следует всегда (не только при вынашивании беременности) не допускать больших интервалов в приемах пищи: затрудненное опорожнение желчного пузыря неизбежно приводит к желчнокаменной болезни. Это особенно актуально при раннем гестозе, когда беременная женщина с аномалиями желчевыводящих путей длительно отказывается от еды.
Таким образом, одновременная закладка в 5 недель эмбриогенеза яичников, соединительной ткани, гипоталамо-гипофизарной системы под воздействием неблагоприятных генетических и факторов внешней среды может привести к формированию особой формы СПКЯ. Наблюдаемые больные – клинико-патогенетический вариант СПКЯ, при котором нет инсулинорезистентности и ожирения; наоборот, гиперандрогения тормозит развитие жировой ткани. Применение метформина еще больше снижает массу тела (усугубляет часто встречавшийся врожденный нефроптоз). Предупреждение прогрессирования СПКЯ у больных с НДСТ должно быть таким же, как и в других случаях СПКЯ [1], т.е. проводиться комбинированными гормональными контрацептивами.
Ясно, что пока нет эпидемиологических сведений о частоте НДСТ среди общей массы больных с СПКЯ. Однако известно, что в общей популяции НДСТ широко распространена повсеместно (встречается примерно у 8,5% жителей нашей страны) [17]. Не все больные с СПКЯ и нормальной массой тела или ее дефицитом обязательно должны иметь и НДСТ: возможны алиментарные, гипофизарные и другие причины снижения веса. Очевидно, НДСТ может сочетаться с СПКЯ и на фоне ожирения, метаболического синдрома, инсулинорезистентности, гиперинсулинемии. Изучение этого вопроса представляет несомненный интерес и является насущной задачей ближайшего времени.
Заключение
1. СПКЯ во многих случаях сочетается с НДСТ и сопровождается аномалиями не только яичников, но и других органов. При таком варианте поликистоза яичников у больных не наблюдаются инсулинорезистентность и ожирение; проводить им лечение метформином нецелесообразно.
2. У женщин с поликистозными яичниками при планировании беременности необходимо исключать и по возможности корректировать проявления НДСТ с целью предупреждения осложнений во время гестации.
3. При выявлении НДСТ у девочек-подростков следует исключать аномалию яичников для своевременной диагностики СПКЯ и предупреждения его прогрессирования.



