Синдром поликистозных яичников (СПКЯ) – наиболее распространенное эндокринное нарушение у женщин репродуктивного возраста. Распространенность СПКЯ зависит от критериев, на основании которых устанавливается диагноз, и составляет 15% в популяции женщин репродуктивного возраста при использовании «Роттердамских критериев» 2003 года [1]. СПКЯ – сложная патология, включающая как гормональные, так и метаболические нарушения и высокий сердечно-сосудистый риск в отдаленном прогнозе [2].
Инсулинорезистентность (ИР) и компенсаторная гиперинсулинемия рассматриваются в качестве основного патофизиологического механизма метаболических нарушений при СПКЯ, хотя и не являются обязательными диагностическими критериями этого синдрома [2–4]. Большинство женщин с СПКЯ (от 50 до 90%) имеют сниженную чувствительность к инсулину независимо от количества жировой ткани в организме и характера ее распределения [5, 6]. Однако существует значительный объем данных, поддерживающих точку зрения, что многие женщины с СПКЯ, особенно худые, не имеют ИР [1, 5, 7].
Второй патофизиологический механизм СПКЯ – нарушение функции β-клеток поджелудочной железы, которое прямо ассоциировано с семейным анамнезом СД 2-го типа при наличии родственников первой степени родства в данной семье [1]. ИР в сочетании с секреторной дисфункцией β-клеток имеет ключевое значение в развитии НТГ и СД 2-го типа у женщин с СПКЯ, которые могут проявиться даже в молодом возрасте [8]. Результаты исследований, оценивающих особенности функции β-клеток при СПКЯ, противоречат друг другу и содержат данные как о снижении функции β-клеток [9–11], так и о повышении ранней фазы секреции инсулина (по результатам орального теста толерантности к глюкозе (ОГТТ)) [5, 7, 12, 13]. Объяснение этим данным может быть следующее: функция β-клеток при СПКЯ, как и многие другие проявления синдрома, гетерогенна и во временном аспекте изменяется от высокой до сниженной [5, 12].
 В настоящее время не существует однозначных рекомендаций по коррекции метаболических нарушений у женщин с СПКЯ, особенно при нормальной массе тела без клинически значимых изменений углеводного метаболизма. Наше внимание привлекла аминокислота таурин – идеальный модулятор многих физиологических процессов в организме, в том числе и метаболизма глюкозы [14–17].
В настоящее время не существует однозначных рекомендаций по коррекции метаболических нарушений у женщин с СПКЯ, особенно при нормальной массе тела без клинически значимых изменений углеводного метаболизма. Наше внимание привлекла аминокислота таурин – идеальный модулятор многих физиологических процессов в организме, в том числе и метаболизма глюкозы [14–17].
Целью настоящего исследования было изучение особенностей углеводного метаболизма на основании ОГТТ у женщин с СПКЯ и здоровых женщин и коррекция выявленных метаболических дисфункций при СПКЯ с использованием таурина.
Материал и методы исследования
В исследование были включены 109 женщин в возрасте от 18 до 45 лет: 94 женщины с диагнозом СПКЯ (критерии «Роттердамского консенсуса», 2003 г.) и 15 практически здоровых женщин с регулярным менструальным циклом и ультразвуковыми признаками наличия лидирующего фолликула на 12–14-й день менструального цикла (группа контроля).
Группу лечения таурином составили 30 женщин с СПКЯ. Пациенткам из группы лечения назначался таурин (препарат дибикор, ООО «ПИК-ФАРМА») в дозе 500 мг 2 раза в день в течение 3 месяцев.
Всем женщинам исходно было выполнено антропометрическое обследование и 3-часовой ОГТТ с нагрузкой 75 г глюкозы. Лабораторное исследование включало определение уровня глюкозы и инсулина натощак, на 30-й, 60-й, 120-й и 180-й минутах ОГТТ. Женщинам из группы лечения через 3 месяца терапии таурином были повторены измерение антропометрических параметров и ОГТТ.
Чувствительность тканей к инсулину и функция β-клеток были определены при помощи математических моделей, полученных на основании метода эугликемического клэмпа (M. Stumvoll et al., 2000) [18]: «ISISTUM» = чувствительность периферических тканей к инсулину = 0,226–0,0032 × индекс массы тела (ИМТ) – 0,0000645 × инсулин на 120-й мин – 0,0037 × глюкоза на 60-й мин; «1st Phase» = индекс первой фазы секреции инсулина = 1283+1,829 × инсулин на 30-й мин – 138,7 × глюкоза на 30-й мин. + 3,772 × инсулин базальный.
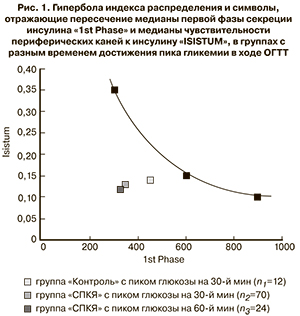
Для оценки соответствия функции β-клеток чувствительности периферических тканей к инсулину в группах сравнения использовали гиперболу индекса распределения – «Disposition index», предложенную R.N. Bergman и соавт. в 1981 г. и разработанную на основании технологии «клэмп». Линия этой гиперболы отражает идеальное соответствие функции β-клеток чувствительности периферических тканей к инсулину. В нашей работе были использованы математические модели для расчета этого показателя на базе ОГТТ. Были рассчитаны показатели первой фазы секреции инсулина по модели «1st Phase» и чувствительности периферических тканей к инсулину по модели «ISISTUM» [19]. Мы обозначили показатели в группах с разным временем достижения пиковых значений глюкозы и инсулина цветными символами. Символы, отражающие такое индивидуальное соотношение этих расчетных показателей в группах сравнения, выражали как медиану пересечения первой фазы секреции инсулина «1st Phase» с медианой чувствительности периферических тканей к инсулину «ISISTUM» и размещали их относительно линии гиперболы индекса распределения для каждой группы с разным временем достижения пика глюкозы и инсулина в ходе ОГТТ. Символы, находящиеся выше линии гиперболы, отражают неадекватно высокую функцию β-клеток, а ниже линии гиперболы – характеризуются неадекватно низкой функцией β-клеток относительно имеющейся в данной группе чувствительности периферических тканей к инсулину.
Результаты исследования и обсуждение
Поскольку группы контроля и СПКЯ не имели значимых различий по ИМТ, то при анализе результатов этот показатель не обсуждался, так ИМТ в группе контроля был 21,1 (20,8–22,5) кг/м2 против 21,9 (19,87–26,68) кг/м2 (p=0,457) в группе СПКЯ.
Группы с СПКЯ и разным временем достижения пика гликемии также не имели значимых различий ИМТ; так ИМТ был 21,9 (20,0–26,5) кг/м2 в группе с пиком глюкозы на 30-й минуте против 22,4 (19,7–28,2) кг/м2 в группе с пиком глюкозы на 60-й минуте (p=0,618). Группы женщин с СПКЯ, имеющие разное время достижения пика инсулина, также были сопоставимы по ИМТ: 22,3 (19,6–27,3) в группе с пиком инсулина на 30-й минуте, 21,9 (20,4–25,1) в группе с пиком инсулина на 60-й минуте и 21,7 (19,7–27,9) в группе с пиком инсулина на 120-й минуте (p=0,992).
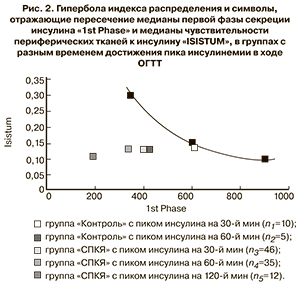 Здоровые женщины с разным временем достижения пика инсулина не имели значимых различий ИМТ: 21,05 (20,58–22,28) кг/м2 в группе с пиком инсулина на 30-й минуте против 21,0 (19,9–25,4) кг/м2 в группе с пиком инсулина на 60-й минуте (p=0,859).
Здоровые женщины с разным временем достижения пика инсулина не имели значимых различий ИМТ: 21,05 (20,58–22,28) кг/м2 в группе с пиком инсулина на 30-й минуте против 21,0 (19,9–25,4) кг/м2 в группе с пиком инсулина на 60-й минуте (p=0,859).
Сначала относительно линии гиперболы расположили символы, характеризующие отношение первой фазы секреции инсулина «1st Phase» и чувствительности периферических тканей к инсулину «ISISTUM», в группах с разным временем достижения пика глюкозы в ходе ОГТТ. Символы, отражающие медиану первой фазы секреции инсулина «1st Phase» и медиану чувствительности тканей к инсулину «ISISTUM» для групп здоровых женщин и женщин с СПКЯ, представлены на рис. 1, и все расположились ниже линии гиперболы индекса распределения, что говорит о наличии разной степени дисфункции β-клеток в группах сравнения. Символ группы здоровых женщин с пиком глюкозы на 30-й минуте ОГТТ имеет самое близкое расположение к линии гиперболы, что свидетельствует о более адекватной, хотя и не идеальной функции β-клеток в этой группе в отличие от групп женщин с СПКЯ, имеющих пик глюкозы на 30-й и 60-й минутах ОГТТ.
Затем относительно линии гиперболы были расположены символы, характеризующие отношение первой фазы секреции инсулина «1st Phase» и чувствительности периферических тканей к инсулину «ISISTUM», в группах с разным временем достижения пика инсулина в ходе ОГТТ. Символы, отражающие медиану первой фазы секреции инсулина «1st Phase» и медиану чувствительности тканей к инсулину «ISISTUM» для групп здоровых женщин и женщин с СПКЯ и разным временем достижения пика инсулина, представлены на рис. 2. Практически на линии гиперболы находится символ группы здоровых женщин, в которой пик инсулина был на 30-й минуте ОГТТ. Таким образом, в этой группе была более хорошая функция β-клеток относительно имеющейся чувствительности периферических тканей к инсулину. Символы, отражающие индекс распределения в остальных группах, были расположены ниже линии гиперболы, что свидетельствует о разной степени дисфункции β-клеток в этих группах. Самая выраженная дисфункция β-клеток была в группе женщин с СПКЯ и пиком инсулина на 120-й минуте теста, в то время как наименьшая степень дисфункции β-клеток была в группе здоровых женщин с пиком инсулина на 60-й минуте ОГТТ.
 Таким образом, можно заключить, что в целом у всех обследованных женщин группы СПКЯ была выявлена разная степень дисфункции β-клеток. Наиболее адекватная секреция инсулина в период первой фазы оказалась в группе СПКЯ, с пиком глюкозы и инсулина на 30-й минуте ОГТТ, а самая существенная дисфункция β-клеток была выявлена в группе СПКЯ при пике инсулина на 120-й минуте теста. Практически идеальная функция β-клеток оказалась, по нашим данным, в группе здоровых женщин с пиком инсулина на 30-й минуте ОГТТ. У остальных женщин из группы «Контроль» также была выявлена дисфункция β-клеток, но секреция инсулина в первую фазу у них была более адекватной, чем у женщин с СПКЯ, поэтому символы этих групп расположились ближе к линии гиперболы индекса распределения, чем в группе СПКЯ.
Таким образом, можно заключить, что в целом у всех обследованных женщин группы СПКЯ была выявлена разная степень дисфункции β-клеток. Наиболее адекватная секреция инсулина в период первой фазы оказалась в группе СПКЯ, с пиком глюкозы и инсулина на 30-й минуте ОГТТ, а самая существенная дисфункция β-клеток была выявлена в группе СПКЯ при пике инсулина на 120-й минуте теста. Практически идеальная функция β-клеток оказалась, по нашим данным, в группе здоровых женщин с пиком инсулина на 30-й минуте ОГТТ. У остальных женщин из группы «Контроль» также была выявлена дисфункция β-клеток, но секреция инсулина в первую фазу у них была более адекватной, чем у женщин с СПКЯ, поэтому символы этих групп расположились ближе к линии гиперболы индекса распределения, чем в группе СПКЯ.
Терапия дибикором значимо не повлияла на значения ИМТ: так, ИМТ в группе «Таурин» до лечения был 20,7 (19,8–22,6) кг/м2, а после лечения – 21,1 (19,5–23,5) кг/м2, p=0,306. В группе «Таурин» с пиком глюкозы на 30-й минуте ИМТ не изменился: 20,5 (19,6–22,6) кг/м2 до терапии дибикором и после приема дибикора – 20,8 (19,2–23,5) кг/м2, p=0,314.
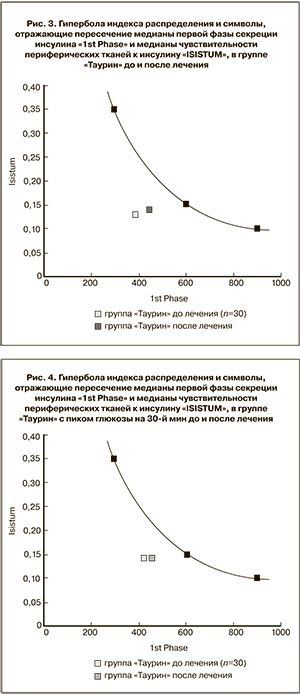
Мы расположили относительно линии гиперболы символы, находящиеся на пересечении медианы первой фазы секреции инсулина «1st Phase» и медианы чувствительности периферических тканей к инсулину «ISISTUM» и для группы «Таурин», получавшей лечение дибикором – до и после лечения. Символы, находящиеся на пересечении медиан первой фазы секреции инсулина «1st Phase» и чувствительности тканей к инсулину «ISISTUM» до и после терапии таурином, представлены на рис. 3. До лечения символ группы «Таурин» располагался ниже линии гиперболы, что свидетельствовало о недостаточной функции β-клеток относительно имеющейся в этой группе чувствительности тканей к инсулину. После лечения символ группы «Таурин» приблизился к линии гиперболы за счет улучшения первой фазы секреции инсулина («1st Phase» до 386,41 (214,21–552,83), после 442,53 (339,85–541,44), p=0,079) и повышения чувствительности периферических тканей к инсулину («ISISTUM» до 0,13 (0,12–0,14), после 0,14 (0,13–0,14), p=0,012). Символы группы «Таурин» с пиком гликемии на 30-й минуте до и после лечения изображены на рис. 4.
После лечения символ группы «Таурин» с пиком глюкозы на 30-й минуте также приблизился к линии гиперболы, но за счет улучшения только функции β-клеток («1st Phase» до 412,54 (194,61–536,26), после 445,89 (357,21–556,88), p=0,048), тогда как чувствительность периферических тканей к инсулину не изменилась и осталась на прежнем уровне («ISISTUM» до 0,14 (0,13–0,14), после 0,14 (0,13–0,14), p=0,088).
Таким образом, таурин (дибикор в дозе 1000 мг) не оказал значимого влияния на абсолютные значения глюкозы и инсулина в ходе ОГТТ, но способствовал качественным изменениям углеводного метаболизма путем модуляции соответствия ранней фазы секреции инсулина и чувствительности периферических тканей к гормону. Индекс распределения в группе «Таурин» через 3 месяца лечения приблизился к линии гиперболы, что свидетельствует об уменьшении дисфункции β-клеток и лучшем ее соответствии индивидуальной чувствительности к инсулину.
Заключение
Определяющая метаболическая дисфункция при СПКЯ – индивидуальное несоответствие секреторной функции β-клеток степени снижения чувствительности периферических тканей к инсулину. Действие таурина при СПКЯ реализуется путем модулирующего эффекта на соотношение чувствительности периферических тканей к инсулину и функцию β-клеток.



